Notícias
Informe Técnico - Câmara Pox/RedeVírus MCTI – nº02/2022

O monkeypox vírus, agente etiológico da varíola dos macacos, pertence ao gênero Orthopoxvirus , família Poxviridae . O monkeypox vírus pertence a mesma família do vírus causador da varíola humana, e apresenta algumas manifestações clínicas semelhantes, porém de menor gravidade. Foi descoberto pela primeira vez em 1958, quando dois surtos de uma doença com sinais clínicos semelhantes aos da varíola humana ocorreram em macacos de laboratório que eram mantidos para pesquisa.
A varíola dos macacos é uma doença zoonótica e, portanto, afeta também o ser humano. Surtos da doença vêm sendo registrado no continente afetando animais e em seres humanos a partir de 1970. Em 2003, o primeiro surto fora do continente africano ocorreu nos Estados Unidos. Foram registrados vários casos em seres humanos e a origem do surto foi atribuída à importação de roedores (ratos) da África, infectados com o monkeypox vírus. Em 2018, houve o relato, no Reino Unido, de 2 casos de infecção por monkeypox vírus em turistas que haviam retornado da África. E, em 2021, foi notificado um caso nos Estados Unidos, também associado a um turista. A situação atual observada traz um alerta mais elevado do que os surtos anteriores, pois apesar dos primeiros casos terem sido reportados no Reino Unido, infecções por monkeypox vírus foram relatadas em Portugal, Espanha e Estados Unidos. Este fato representa um sinal de alerta para o mundo, uma vez que o vírus pode ser transmitido por secreções respiratórias e contato próximo, além de ser veiculado de forma eficaz por animais, incluindo roedores.
Características do vírus
Os vírus dessa família têm como material genético o DNA de fita dupla, linear, com 170-250.000 pares de bases, sendo um vírus complexo estruturalmente. Por ser um vírus DNA apresenta uma estabilidade genética acentuada se comparada aos vírus de RNA, e o surgimento de variantes virais é menos frequente se comparado ao SARS-CoV2 (causador da COVID19), por exemplo. As partículas dos ortopoxvírus são muito estáveis a temperatura ambiente e à dessecação (desidratação).
Dois clados geneticamente distintos do vírus foram identificados – o clado da Bacia do Congo e o clado da África Ocidental – sendo o primeiro considerado mais virulento e transmissível. Os casos identificados na Europa são relacionados à infecção por vírus do clado da África Ocidental.
Sinais e Sintomas
A varíola dos macacos é geralmente uma doença autolimitada com os sintomas que duram de 2 a 4 semanas. O período de incubação da varíola dos macacos pode variar de 5 a 21 dias. Os sintomas iniciais incluem febre, dor de cabeça intensa, linfadenopatia, dor nas costas, mialgia e astenia intensa. A linfadenopatia é descrita como uma característica distintiva da varíola dos macacos em comparação com outras doenças que inicialmente podem ter sinais e sintomas semelhantes como a catapora, sífilis e o sarampo, porém nos casos de infecções por vaccínia vírus a linfadenopatia não é diferencial.
Os pacientes também apresentam erupções cutâneas. A erupção cutânea geralmente se inicia entre 1-3 dias após o aparecimento da febre. A erupção tende a ser mais concentrada na face e extremidades do que no tronco. Afeta a face (em 95% dos casos), palmas das mãos e plantas dos pés (em 75% dos casos). Também são afetadas as mucosas orais (em 70% dos casos), genitália (30%) e conjuntiva (20%), bem como a córnea. A erupção evolui sequencialmente de máculas (lesões com base plana) para pápulas (lesões firmes levemente elevadas), vesículas (lesões cheias de líquido claro), pústulas (lesões cheias de líquido amarelado) e crostas que secam e caem. O número de lesões varia de um a centenas.
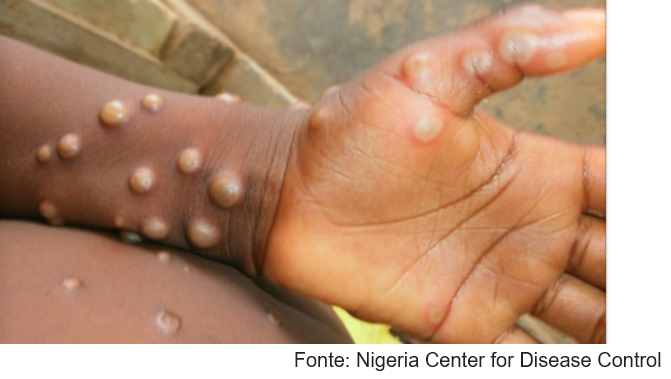
Casos graves ocorrem mais comumente entre crianças e estão relacionados à extensão da exposição ao vírus, estado de saúde do paciente e natureza das complicações, além do clado viral infectante. As complicações da varíola dos macacos podem incluir infecções secundárias, broncopneumonia, sepse, encefalite e infecção da córnea com consequente perda de visão.
A taxa de letalidade da varíola dos macacos varia entre 0 e 11% na população em geral, mas pode ser maior entre crianças pequenas. No Brasil, pessoas com menos de 40-50 anos de idade podem ser mais suscetíveis aos ortopoxvírus como resultado da interrupção da vacinação de rotina contra a varíola em todo o mundo após a erradicação da desta doença.
Na África as pessoas que vivem em áreas florestais ou próximas podem ter exposição indireta ou de baixo nível a animais infectados, possivelmente levando à infecção subclínica (assintomática). No Brasil, porém, por se tratar de uma doença exótica, a vigilância em relação também à saúde dos animais é essencial para que não tenhamos o estabelecimento de um ciclo silvestre.
Transmissão
A transmissão de humano para humano é geralmente mais limitada. A infecção pode resultar de contato próximo com secreções respiratórias, lesões na pele de uma pessoa infectada ou objetos contaminados. A transmissão por partículas respiratórias ou por gotículas geralmente requer contato pessoal prolongado, o que coloca em maior risco os profissionais de saúde, os membros da família e contatos próximos de casos ativos. A cadeia de transmissão mais longa documentada em uma comunidade foi de seis infecções sucessivas de pessoa para pessoa. A transmissão também pode ocorrer através da placenta da mãe para o feto.
No surto atualmente relatado na Europa a maioria dos casos tem sido descrita em homens que fazem sexo com homens, provavelmente como resultado de um contato próximo prolongado que facilita a transmissão. Transmissão sexual não parece acontecer. Outros casos envolvem os contatos diretos das pessoas inicialmente infectadas.
A infecção dos casos índices na África resulta do contato direto com sangue, fluídos corporais ou lesões cutâneas ou mucosas de animais infectados como algumas espécies de roedores, diferentes espécies de macacos e outros. O reservatório natural da varíola dos macacos ainda não foi identificado, embora os roedores sejam os mais prováveis. A ingestão de carne e outros produtos de origem animal malcozidas de animais infectados é um possível fator de risco nas regiões onde o vírus circula naturalmente, como no continente africano. Ressalta-se que o contato prolongado com animais infectados, usados como animais de extimação por exemplo, pode ser um fator epidemiologicamente importante, como aconteceu no surto de 2003, nos EUA.
Diagnóstico
O diagnóstico diferencial clínico que deve ser considerado inclui outras doenças exantemáticas, como vaccínia bovina, varicela, sarampo, infecções bacterianas da pele, sarna, sífilis e alergias associadas a medicamentos. A linfadenopatia durante o estágio prodrômico da doença pode ser uma característica clínica para distinguir a varíola de macacos da varicela, mas não de vaccínia bovina. Se houver suspeita de varicela, os profissionais de saúde devem coletar uma amostra apropriada e transportá-la com segurança para um laboratório com capacidade adequada. A confirmação da varíola dos macacos depende de um diagnóstico laboratorial. A amostra ideal é coletada de lesões de pele – o fluído de vesículas e pústulas e crostas secas. A coleta de biópsias deve ser evitada devido ao risco de disseminação do vírus. As amostras de lesão devem ser armazenadas em um tubo seco e estéril (sem meio de transporte viral) e mantidas frias. A reação em cadeia da polimerase (PCR) é o teste de laboratório preferencial devido à sua precisão e sensibilidade. Os exames de sangue de PCR geralmente são inconclusivos devido à curta duração da viremia em relação ao momento da coleta da amostra após o início dos sintomas e não devem ser coletadas rotineiramente dos pacientes. Como os ortopoxvírus fazem uma reação cruzada sorologicamente, os métodos de detecção de antígenos e anticorpos não fornecem confirmação específica para varíola de macaco, porém podem ser utilizados como exames suplementares, por isso é importante a coleta de sangue total e de soro. Para interpretar os resultados dos testes, é fundamental que as informações do paciente sejam fornecidas com as amostras, incluindo: a) data de início da febre, b) data de início da erupção cutânea, c) data da coleta da amostra, d) estado atual do indivíduo (estágio da erupção cutânea) e e) idade e f) se foi vacinado contra varíola.
Tratamento e vacina
Atualmente, não há tratamento específico recomendado para a varíola dos macacos. A vacinação prévia contra a varíola na infância pode resultar em um curso mais leve da doença. No entanto, atualmente no Brasil e em outros lugares do mundo, as vacinas originais contra a varíola não estão mais disponíveis para o público em geral. Uma vacina mais recente à base de vaccínia vírus foi aprovada para a prevenção da varíola e da varíola dos macacos em 2019 nos Estados Unidos mas, também, ainda não está amplamente disponível.
Reduzindo o risco de transmissão de humano para humano
A vigilância e a identificação rápida de novos casos são fundamentais para a contenção do surto. O contato próximo com pacientes com varíola de macaco é o fator de risco mais significativo. Os profissionais de saúde e os membros da família estão em maior risco de infecção. Os profissionais de saúde que cuidam de pacientes com infecção suspeita ou confirmada, ou manuseiam amostras deles, devem implementar precauções padrão de controle de infecção.
As amostras coletadas com suspeita de infecção devem ser manuseadas por pessoal treinado que trabalha em laboratórios devidamente equipados (nível de biossegurança 3). As amostras de pacientes devem ser preparadas com segurança para transporte com embalagem tripla de acordo com as orientações da OMS para transporte de substâncias infecciosas (categoria A).
Animais em cativeiro que estão potencialmente infectados ou tiveram contato com pessoas suspeitas de infecção devem ser isolados de outros animais e colocados em quarentena imediata por 30 dias.
Diagnóstico diferencial de vaccínia bovina
Como nos últimos anos no Brasil tivemos muitos surtos de vaccínia bovina, folders educativos podem ser encontrados nas seguintes publicações: https://pubmed.ncbi.nlm.nih.gov/33922509/ e https://www.sciencedirect.com/science/article/pii/S0264410X17305406?via%3Dihub#m0005
Métodos de sanitização, desinfecção e esterilização e o isolamento de pacientes
Como a transmissão do vírus ocorre por contato direto, pelo ar e por fômites e o vírus é muito resistente à dessecação especial atenção deve ser dada aos métodos de desinfeção e prevenção da disseminação.
Há necessidade do isolamento dos pacientes no ambiente hospitalar pelo alto risco de infecção nosocomial. Mesmo sendo um vírus de um clado menos patogênico, em pacientes imunossuprimidos o quadro pode se tornar muito grave. Devido a ser um vírus exótico no Brasil os pacientes não hospitalizados também devem ficar em isolamento.
A sanitização de superfícies contaminadas pode ser feita em uma solução de hipoclorito a 0.5% ou acido peracético 0.1% ou a esterilização por autoclavação. Para a desinfecção pode ser utilizada a solução de álcool iodado com 2% de iodo livre, iodopovidona. O vírus é sensível a luz ultra-violeta, mas muito resistente à dessecação.

Referências:
- Berthet N, Descorps-Declère S, Besombes C, Curaudeau M, Nkili Meyong AA, Selekon B, Labouba I, Gonofio EC, Ouilibona RS, Simo Tchetgna HD, Feher M, Fontanet A, Kazanji M, Manuguerra JC, Hassanin A, Gessain A, Nakoune E. Genomic history of human monkey pox infections in the Central African Republic between 2001 and 2018. Sci Rep. 2021 Jun 22;11(1):13085. doi: 10.1038/s41598-021-92315-8. PMID: 34158533; PMCID: PMC8219716.
- Bothra A, Maheswari A, Singh M, Pawar M, Jodhani K. Cutaneous manifestations of viral outbreaks. Australas J Dermatol. 2021 Feb;62(1):27-36. doi: 10.1111/ajd.13421. Epub 2020 Sep 8. PMID: 32895964.
- Barbosa Costa G, Silva de Oliveira J, Townsend MB, Carson WC, Borges IA, McCollum AM, Kroon EG, Satheshkumar PS, Reynolds MG, Nakazawa YJ, de Souza Trindade G. Educational Approach to Prevent the Burden of Vaccinia Virus Infections in a Bovine Vaccinia Endemic Area in Brazil. Pathogens. 2021 Apr 23;10(5):511. doi: 10.3390/pathogens10050511. PMID: 33922509; PMCID: PMC8145679.
- Center for Disease Control and Prevention website: https://www.cdc.gov/poxvirus/monkeypox/index.html . 2022.
- Damaso CR, Esposito JJ, Condit RC, Moussatché N. An emergent poxvirus from humans and cattle in Rio de Janeiro State: Cantagalo virus may derive from Brazilian smallpox vaccine. Virology. 2000 Nov 25;277(2):439-49. doi: 10.1006/viro.2000.0603. PMID: 11080491.
- European Centre for Disease Prevention and Control website: https://www.ecdc.europa.eu/en/news-events/monkeypox-cases-reported-uk-and-portugal . 2022.
- Fenner F, Wittek R, Dumbell KR. The Orthopoxviruses.1989. Academic Press, London.
- Fenner, F. Smallpox and its eradication. 1988. Geneva: World Health Organization.
- Mahase E. Seven monkeypox cases are confirmed in England. BMJ. 2022 May 17;377:o1239. doi: 10.1136/bmj.o1239. PMID: 35580887.
- McCollum AM, Damon IK. Human monkeypox. Clin Infect Dis. 2014 Jan;58(2):260-7. doi: 10.1093/cid/cit703. Epub 2013 Oct 24. Erratum in: Clin Infect Dis. 2014 Jun;58(12):1792. PMID: 24158414.
- Moore M, Zahra F. Monkeypox. 2022 Feb 28. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 34662033.
- Nigeria Center for Disease Control website: https://ncdc.gov.ng/themes/common/docs/protocols/96_1577798337.pdf . 2022
- Oliveira G, Assis F, Almeida G, Albarnaz J, Lima M, Andrade AC, Calixto R, Oliveira C, Diomedes Neto J, Trindade G, Ferreira PC, Kroon EG, Abrahão J. From lesions to viral clones: biological and molecular diversity amongst autochthonous Brazilian vaccinia virus. Viruses. 2015 Mar 16;7(3):1218-37. doi: 10.3390/v7031218. PMID: 25785515; PMCID: PMC4379567.
- de Oliveira JS, Costa GB, Franco Luiz APM, Leite JA, Bonjardim CA, Abrahão JS, Drumond BP, Kroon EG, Trindade GS. Cross-sectional study involving healthcare professionals in a Vaccinia virus endemic area. Vaccine. 2017 Jun 5;35(25):3281-3285. doi: 10.1016/j.vaccine.2017.04.048. Epub 2017 May 8. PMID: 28495317.
- Rao AK, Schulte J, Chen TH, Hughes CM, Davidson W, Neff JM, Markarian M, Delea KC, Wada S, Liddell A, Alexander S, Sunshine B, Huang P, Honza HT, Rey A, Monroe B, Doty J, Christensen B, Delaney L, Massey J, Waltenburg M, Schrodt CA, Kuhar D, Satheshkumar PS, Kondas A, Li Y, Wilkins K, Sage KM, Yu Y, Yu P, Feldpausch A, McQuiston J, Damon IK, McCollum AM; July 2021 Monkeypox Response Team. Monkeypox in a Traveler Returning from Nigeria - Dallas, Texas, July 2021. MMWR Morb Mortal Wkly Rep. 2022 Apr 8;71(14):509-516. doi: 10.15585/mmwr.mm7114a1. PMID: 35389974; PMCID: PMC8989376.
- World Health Organization website: https://www.who.int/health-topics/monkeypox/#tab=tab_1