Vacinas
VACINAS
28/08/2021 a 03/09/2021
A Índia aprovou uma nova vacina COVID que usa fitas circulares de DNA para preparar o sistema imunológico contra o vírus SARS-CoV-2. O ZyCoV-D, que é administrado na pele sem uma injeção, demonstrou ser 67% protetor contra a COVID-19 sintomática em ensaios clínicos e provavelmente começará a ser administrado na Índia no mês de setembro de 2021. Embora a eficácia não seja particularmente alta em comparação com a de muitas outras vacinas COVID-19, o fato de ser uma vacina de DNA é significativo, dizem os pesquisadores (02/09/2021). Fonte: Nature
21/08/2021 a 03/09/2021
O objetivo do estudo foi avaliar o título de anticorpos IgG anti-SARS-CoV-2 contra a subunidade S1 da proteína spike do vírus como um marcador da resposta humoral em 477 pacientes e a concentração de interferon-gama como um indicador de resposta celular em 28 indivíduos. Nos estudos, pesquisadores usaram ensaios imunoenzimáticos sorológicos. IgG foi medido nas semanas 2 e 3 após a primeira dose e 1-5 semanas após a segunda dose de uma vacina de mRNA em indivíduos soropositivos e soronegativos, bem como em convalescentes sintomáticos e assintomáticos. Altos níveis de anticorpos foram observados em 98% da coorte vacinada, e a presença de células T protetoras foi confirmada nas amostras de sangue de todos os participantes. A resposta imune humoral é diversificada e é visível logo 2–3 semanas após a primeira dose da vacina de mRNA. O nível de proteção aumentou significativamente após a segunda dose, com o aumento sendo muito maior em indivíduos saudáveis pré-vacinais e menor em convalescentes. Na segunda e terceira semanas após a segunda dose, a concentração de anticorpos IgG foi maior e, nas semanas seguintes, diminuiu gradativamente. Medições sorológicas regulares em oito indivíduos mostram que os títulos de anticorpos são menores quatro meses após a vacinação do que antes da segunda dose (31/07/2021). Fonte: Cells
As mutações do SARS-CoV-2 podem diminuir as respostas imunes protetoras induzidas pela vacina, particularmente à medida que os títulos de anticorpos diminuem com o tempo. Neste estudo, pesquisadores avaliaram o impacto das variantes SARS-CoV-2 B.1.1.7 (Alfa), B.1.351 (Beta), P.1 (Gama), B.1.429 (Epsilon), B.1.526 (Iota) e B.1.617.2 (Delta) na ligação, neutralização e anticorpos competidores de ECA2 eliciados pelo mRNA-1273 da vacina ao longo de sete meses. As respostas de neutralização com reatividade cruzada foram raras após uma única dose. No pico da resposta à segunda dose da vacina, todos os indivíduos tiveram respostas a todas as variantes. Anticorpos de ligação e funcionais contra variantes persistiram na maioria dos indivíduos, embora em níveis baixos, por 6 meses após a série primária da vacina de mRNA-1273. Em todos os ensaios, B.1.351 teve o reconhecimento de anticorpos mais baixo. Esses dados complementam os estudos em andamento para informar a necessidade potencial de vacinações de reforço adicionais (12/08/2021). Fonte: Science
Estudo constatou que as vacinas Pfizer-BioNTech e Oxford-AstraZeneca oferecem boa proteção contra novas infecções contra a Delta, mas a eficácia é reduzida em comparação com Alpha. Duas doses de ambas as vacinas ainda fornecem pelo menos o mesmo nível de proteção de COVID-19 por infecção natural; pessoas que foram vacinadas após já terem sido infectadas com COVID-19 tiveram ainda mais proteção do que indivíduos vacinados que não haviam tomado a vacina COVID-19 antes. Duas doses de ambas as vacinas ainda forneciam pelo menos o mesmo nível de proteção de COVID-19 por infecção natural; pessoas que foram vacinadas após já terem sido infectadas com COVID-19 tiveram ainda mais proteção do que indivíduos vacinados que não haviam tomado vacina COVID-19 antes. No entanto, as infecções por Delta após duas doses de vacina tiveram níveis de pico de vírus semelhantes aos de pessoas não vacinadas; com a variante Alfa, os níveis de pico do vírus nas pessoas infectadas após a vacinação foram muito mais baixos (19/08/2021). Fonte: University Oxford
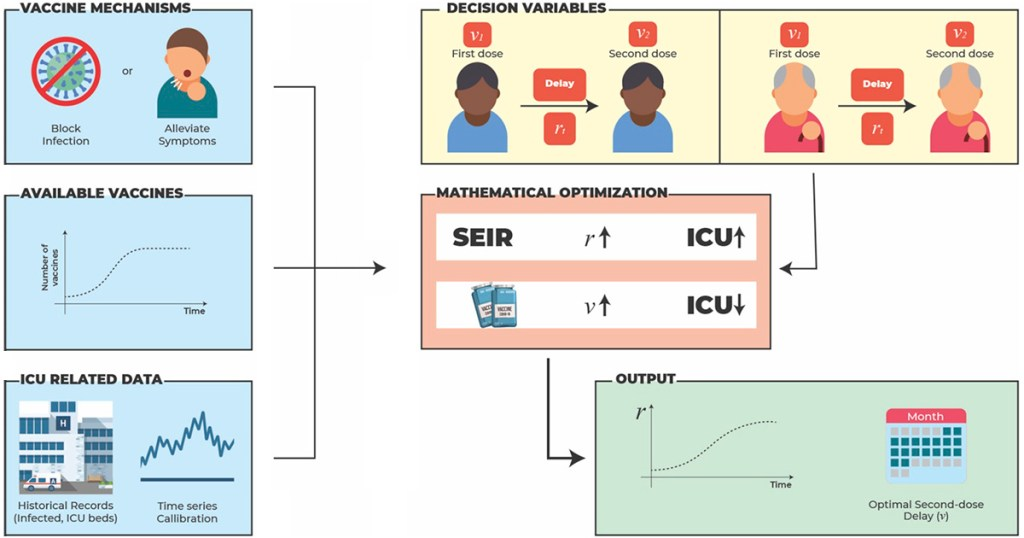
Em regiões de prevalência da variante delta do coronavírus, o intervalo entre doses de vacina de COVID-19 precisa ser mais curto do que doze semanas para que se tenha um controle efetivo da pandemia. É o que sugere modelo matemático desenvolvido pelo Centro de Ciências Matemáticas Aplicadas à Indústria (CeMEAI) a partir de dados preliminares da eficácia da vacina para a variante delta (18/08/2021). Fonte: Jornal USP PNAS
A Pfizer e a BioNTech anunciaram ontem (26/08/2021) a assinatura de uma acordo com a farmacêutica brasileira Eurofarma para a produção de vacina contra a COVID-19. De acordo com o comunicado das empresas, as atividades de transferência técnica, desenvolvimento no local e instalação de equipamentos começarão imediatamente. A Eurofarma vai receber o produto de instalações dos Estados Unidos. A vacina será produzida no Brasil e distribuída em toda a América Latina. A expectativa é que o laboratório brasileiro seja capaz de produzir 100 milhões de doses por ano (27/08/2021). Fonte: Agência Brasil
O presente estudo de coorte retrospectivo avaliou a eficácia das vacinas Vaxzevria e CoronaVac para infecção relacionada à COVID-19 em 60.577.870 de vacinados brasileiros de 18 de janeiro a 30 de junho de 2021. Os resultados mostram que a vacinação com Vaxzevria ou CoronaVac é considerada eficaz contra a infecção por SARS-CoV-2 e altamente eficaz contra hospitalização, admissão na UTI e morte em indivíduos de até 79 anos. De 80-89 anos de idade, 91,2 de eficácia contra morte foi observado em indivíduos vacinados com Vaxzevria versus 67,3 para Coronvac. Acima de 90 anos, 70,5 de proteção foi conferida a indivíduos vacinados com Vaxzevria versus 35,4 em indivíduos vacinados com Coronavac. O estudo conclui que ambas as vacinas demonstraram eficácia geral contra COVID-19 grave até 80 anos de idade. Ademais, os pesquisadores sugerem que indivíduos com 90 anos ou mais podem se beneficiar de uma terceira dose de reforço acelerada (25/08/2021). Fonte: medRxiv
As vacinas de mRNA-1273 e BNT162b2 tiveram eficácia de ~ 95% em ensaios clínicos realizados nos Estados Unidos, quando as variantes WA-1 e p.Asp614Gly circularam mais amplamente. Uma questão crítica é se essas e outras vacinas mediarão a proteção contra variantes emergentes. Neste estudo, pesquisadores demonstraram como a dose e o número de imunizações influenciam a proteção contra a variante B.1.351 de SARS-CoV-2. Primatas não humanos receberam duas doses de 30 ou 100 µg da vacina de mRNA-1273 da Moderna, uma única imunização de 30 µg ou nenhuma vacina. Em contraste com a proteção de alto nível ou completa observada nas vias aéreas inferiores contra o desafio de B.1.351 para todas as doses, o controle da replicação viral nas vias aéreas superiores foi observado apenas em animais que receberam duas doses de 100 µg. Esses dados estabelecem que um regime de duas doses de mRNA-1273 será crítico para fornecer proteção das vias aéreas superiores e inferiores contra as principais variantes preocupantes (20/08/2021). Fonte: Nature Immunology
14/08/2021 a 20/08/2021
A vacina de mRNA da Pfizer / BioNTech (BNT162b2) SARS-CoV-2 demonstrou 95% de eficácia após 2 doses durante os ensaios clínicos. Frente aos relatos de que indivíduos com infecção anterior por SARS-CoV-2 elicitam respostas de anticorpos mais fortes após 1 dose em comparação com indivíduos sem infecção anterior foi realizado um estudo prospectivo para esta avaliação. Participantes virgens de infecção (n = 30) tinham níveis médios de SARS-CoV-2 spike-RBD IgG na linha de base de 4,03 AU/mL e aumentando para 1.822 AU/ml após 1 dose de vacina e para 15.005 AU/ml após 2 doses de vacina. Os níveis médios de IgG de indivíduos previamente infectados (n = 29) aumentaram de 621,3 AU/ml no início do estudo para 30.173 AU/ml após 1 dose e 36.600 AU/ml após 2 doses. Logo, os pesquisadores citam que os indivíduos com infecção prévia por COVID-19 documentada podem estar suficientemente protegidos contra reinfecção após uma única dose de vacina de mRNA, o que poderia liberar a disponibilidade de milhões de doses adicionais (06/08/2021). Fonte: Jama
Estudo prospecivo realizado pela faculdade de medicina da USP avaliou que pacientes com doenças reumáticas autoimunes (DRA) apresentaram resposta de anticorpos moderada à Coronavac após tomarem a segunda dose da vacina, resposta essa considerada satisfatória em 70% deles. E também demonstrou um bom perfil de segurança para este grupo. Como era esperado pela própria característica da doença, segundo os pesquisadores, seis semanas após a segunda dose houve menor taxa de soroconversão (geração de anticorpos IgG) no grupo com doença reumática (70%) em comparação com o grupo controle (95%). Em relação à produção de anticorpos neutralizantes, o teste que avalia a capacidade da vacina em induzir uma resposta imunológica e conseguir bloquear a ligação do vírus na célula em mais de 30%, também foi diminuída no grupo de pacientes com doenças autoimunes (56% contra 79%) (16/08/2021). Fonte: Jornal da USP
Pesquisadores compararam os genomas SARS-CoV-2 de 76 casos de descoberta após a vacinação completa com BNT162b2 (Pfizer / BioNTech), mRNA-1273 (Moderna) ou JNJ-78436735 (Janssen) com controles não vacinados (fevereiro a abril de 2021) na região metropolitana de Nova York, incluindo sua relação filogenética, distribuição de variantes e perfis de mutação da spike completa. A idade média deles era 48 anos; sete necessitaram de hospitalização e um morreu. A maioria das infecções breakthrough (57/76) ocorreu com B.1.1.7 (Alpha) ou B.1.526 (Iota). Entre os 7 casos hospitalizados, 4 foram infectados com B.1.1.7, incluindo 1 óbito. Ambas as análises estatísticas não combinadas e combinadas considerando idade, sexo, tipo de vacina e mês do estudo como covariáveis apoiaram a hipótese nula de distribuições de variantes iguais entre vacinados e não vacinados em testes qui-quadrado e McNemar (p> 0,1) destacando uma alta eficácia da vacina contra B.1.1.7 e B.1.526. Não houve associação clara entre os avanços entre o tipo de vacina recebida e a variante. No grupo vacinado, as mutações da spike no domínio N-terminal e no domínio de ligação ao receptor que foram associadas à evasão imune foram superrepresentadas. A evolução dinâmica das variantes do SARS-CoV-2 requer análises genômicas amplas de infecções revolucionárias para fornecer informações da vida real sobre o escape imunológico mediado por variantes circulantes e suas mutações de spike (10/08/2021). Fonte: The Journal of Clinical Investigation
Pesquisadores alertam que duas doses de vacina são cruciais para a proteção contra a variante delta de SARS-CoV-2. O estudo constatou que o regime de duas doses da vacina Pfizer-BioNTech COVID-19 é 88% eficaz contra a doença sintomática causada pela variante delta, enquanto a vacina Oxford-AstraZeneca é 67% eficaz. Ele mostra que, embora duas doses de ambas as vacinas ofereçam boa proteção contra a delta, uma única dose de qualquer vacina foi apenas cerca de 30% eficaz contra a variante. Segundo estimativas, na Inglaterra, cerca de 84.600 mortes e 23 milhões de infecções foram evitadas como resultado do programa de vacinação COVID-19 até 6 de agosto (16/08/2021). Fonte: BMJ
07/08/2021 a 13/082021
Estudo cita que vem sendo relatado um número crescente de casos com reação cutânea tardia após imunização com vacinas baseadas em mRNA contra SARS-CoV-2. Esta reação adversa, que é considerada uma reação de hipersensibilidade do tipo retardado ou mediada por células T, foi descrita para as vacinas Moderna (mRNA-1273) e Comirnaty (Pfizer / BioNTech, BNT162b2). Pesquisadores descreveram uma grande reação cutânea local tardia em um paciente que recebeu a vacina de vetor viral Vaxzevria (ChAdOx1-S, AstraZeneca) e que o curso do tempo e os sintomas clínicos da reação cutânea tardia após as vacinas de mRNA têm um padrão semelhante que é reconhecido no paciente após a vacinação com Vaxzevria. Este fenômeno não foi descrito nos ensaios clínicos de Vaxzevria e, até onde sabe-se, é o primeiro relato dessa reação adversa a uma vacina SARS-CoV-2 baseada em vetor. Com isso, os pesquisadores esperam aumentar a conscientização sobre as reações retardadas no local da injeção que também ocorrem após as vacinas com vetores virais e encorajar relatórios adicionais e educação do paciente em relação às reações cutâneas após a vacinação contra COVID-19 (05/08/2021). Fonte: Drugs in R&D
A FDA (Food and Drug Administration) dos EUA alterou as autorizações de uso de emergência para a vacina Pfizer-BioNTech COVID-19 e a vacina Moderna COVID-19 para permitir o uso de uma dose adicional em certos indivíduos imunocomprometidos, especificamente, receptores de transplante de órgãos ou aqueles que são diagnosticados com doenças consideradas como tendo um nível equivalente de imunocomprometimento (12/08/2021). Fonte: FDA
A EMA autorizou a vacina Comirnaty da Pfizer para prevenir a COVID-19 em pessoas com 12 anos ou mais. Comirnaty contém uma molécula chamada RNA mensageiro (mRNA) com instruções para a produção de uma proteína do SARS-CoV-2, o vírus que causa o COVID-19. Comirnaty não contém o vírus em si e não pode causar COVID-19 (11/08/2021). Fonte: EMA
Anteriormente, foi demonstrado que esquemas heterólogos incorporando uma vacina de adenovírus vetorizada (ChAdOx1 nCoV-19, AstraZeneca) e uma vacina de mRNA (BNT162b2, Pfizer – BioNTech) em um intervalo de 4 semanas são mais reatogênicos do que esquemas homólogos. O presente estudo demonstra a segurança e imunogenicidade de esquemas heterólogos com as vacinas de vetor viral ChAdOx1 nCoV-19 (AstraZeneca) e BNT162b2 (Pfizer – BioNTech) (06/08/2021). Fonte: The Lancet
Iniciaram-se os ensaios clínicos da ButanVac, o composto candidato à vacina que será produzido integralmente no Brasil pelo Instituto Butantan, sem a necessidade de importação de insumos. Em 9 de julho, dois dias depois de a Agência Nacional de Vigilância Sanitária (Anvisa) aprovar o início dos testes, seis voluntários passaram por exames de triagem na Faculdade de Medicina da Universidade de São Paulo (USP) em Ribeirão Preto antes de receber a primeira dose do composto, prevista para ser dada nas semanas seguintes. A primeira das três fases de testes serve para avaliar a segurança do produto e envolverá a participação de 418 voluntários, que serão aleatoriamente separados em dois grupos: um receberá duas doses da ButanVac, com intervalo de 28 dias, e outro duas doses de placebo (composto inócuo). Na segunda etapa, da qual devem participar mais de 5 mil pessoas, será avaliada a capacidade da ButanVac de gerar resposta imune. Nessa fase, os dados serão comparados com os de vacinas contra a COVID-19 já em uso (agosto/2021). Fonte: Revista FAPERJ
31/07/2021 a 06/08/2021
Pesquisadores da Fiocruz Minas e da Universidade Federal de Minas Gerais (UFMG) que atuam no desenvolvimento da SpiN-TEC, vacina contra a COVID-19, submeteram à Anvisa um pedido de autorização para o início dos testes do imunizante em seres humanos. De acordo com o coordenador do estudo a ideia é que o imunizante funcione como dose de reforço, uma vez que a maior parte da população já terá sido vacinada em 2022, quando a SpiN-TEC poderá estar disponível. Inicialmente, os testes serão feitos com pessoas que já tenham recebido as duas doses CoronaVac há seis meses. A vacina SpiN-TEC consiste na fusão de duas proteínas, S e N, que resultam em uma proteína “quimera”. Essa associação confere à SpiN-TEC um diferencial em relação aos demais imunizantes, que contemplam apenas a proteína S, na qual ocorrem a maior partes das mutações do vírus e a eficiência dos anticorpos neutralizantes. Já a proteína N é menos sujeita às mutações que geram novas variantes. Dessa forma, os pesquisadores têm a expectativa de que a SpiN-TEC possa oferecer proteção contra as variantes do coronavírus. É uma vacina que atua na produção de anticorpos e também no nível celular, induzindo resposta de linfócitos Ts, células com funções imunológicas de efetuação de respostas antivirais (06/08/2021). Fonte: Fiocruz
A Fiocruz, o Governo do Estado do Ceará e a Universidade Estadual do Ceará (Uece) selaram um acordo de cooperação para desenvolvimento e produção da vacina HH-120-Defenser contra a COVID-19, e elaboração de projetos de pesquisa e desenvolvimento tecnológico. O Laboratório de Biotecnologia e Biologia Molecular (LBBM) da Uece é o responsável pelo desenvolvimento da vacina HH-120-Defenser. A cooperação com a Fiocruz visa realizar ajustes solicitados pela Agência Nacional de Vigilância Sanitária (Anvisa) na fase de testes em animais, revendo e ampliando resultados. Após essa etapa, os pesquisadores poderão enviar a documentação e solicitar autorização para testes em humanos. O estudo com o imunizante começou em abril de 2020, tendo como ponto de partida o conhecimento já existente sobre o coronavírus aviário atenuado, semelhante ao Sars-CoV-2, e que já vem sendo utilizado há muito tempo e não tem potencial agressor em humanos. Na fase pré-clínica dos estudos (Fase 1), a vacina HH-120-Defenser obteve “resultados promissores” em testes realizados com camundongos, com mais de 90% de proteção comprovada (06/08/2021). Fonte: Fiocruz
Dois estudos de Israel, publicados como pré-impressões em 16 de julho, descobriram que duas doses da vacina feita pela empresa farmacêutica Pfizer, com sede na cidade de Nova York, e a empresa de biotecnologia BioNTech, com sede em Mainz, Alemanha, são 81% eficazes na prevenção Infecções por SARS-CoV-2. E as pessoas vacinadas que são infectadas têm até 78% menos probabilidade de espalhar o vírus para membros da família do que as pessoas não vacinadas(27/07/2021). Fonte: Nature
Os pesquisadores desenvolveram uma vacina de subunidade de proteína composta de proteína de ectodomínio de spike (StriFK) mais um adjuvante híbrido de zinco-alumínio modificado com bisfosfonato de nitrogênio (FH002C). StriFK-FH002C gerou títulos de anticorpos neutralizantes substancialmente mais elevados em camundongos, hamsters e macacos cynomolgus do que aqueles observados no plasma isolado de indivíduos convalescentes COVID-19. StriFK-FH002C também induziu respostas de células T auxiliares polarizadas Th1 e Th2 em camundongos. A vacinação de hamsters com StriFK-FH002C reduziu a transmissão do vírus dentro da gaiola para hamsters não vacinados em co-alojamento. Em resumo, StriFK-FH002C representa uma vacina candidata SARS-CoV-2 baseada em subunidade de proteína eficaz (20/07/2021). Fonte: Science
Pesquisadores vem desenvolvendo uma vacina COVID-19, hAd5 S-Fusion + N-ETSD, que expressa as proteínas spike(S) SARS-CoV-2 e nucleocapsídeo (N) com modificações para aumentar as respostas imunes fornecidas usando uma plataforma de adenovírus humano serótipo 5 (hAd5). A vacinação subcutânea (SC) e de reforço SC de camundongos CD-1 com esta vacina de antígeno duplo induz células T auxiliares 1 (Th1) polarizadas e respostas humorais a S e N que são maiores do que aquelas visto com hAd5 S de tipo selvagem entregando apenas S não modificado. Os pesquisadores compararam a vacinação de primer SC com intranasal (IN) com reforços SC ou IN e mostraram que um primer IN com um reforço IN é tão eficaz na geração de respostas humorais tendenciosas de Th1 quanto as outras combinações testados, mas um SC prime com um reforço IN ou SC induz maiores respostas de células T. Os pesquisadres utilizaram um SC + IN (SC + IN) combinado com ou sem reforço e descobriram que o prime SC + IN sozinho que é tão eficaz na geração de respostas humorais e de células T quanto o prime SC + IN com reforço. A descoberta de que a entrega somente do SC + IN tem o potencial de fornecer ampla imunidade incluindo imunidade da mucosa contra SARS-CoV-2 apoiando testes adicionais desta vacina e abordagem de entrega em modelos animais de desafio viral (21/07/2021). Fonte: Nature
Revisão detalha as vacinas do vetor adenoviral COVID-19 atualmente em ensaios clínicos em humanos e fornece uma visão geral das novas tecnologias empregadas em seu projeto. Como essas vacinas formaram a base da campanha global de vacinação COVID-19, esta revisão fornece uma consideração completa do impacto e do desenvolvimento desta plataforma emergente (05/08/2021). Fonte: Nature

24/07/2021 a 30/07/2021
Pesquisadores brasileiros da empresa Invent Biotecnologia apresentaram a proposta de construção vacinal baseada em Salmonella enterica Typhimurium carreando proteínas virais contra SARS-CoV-2. Destacam que dispoem da tecnologia e dominam o processo vacinal com comprovada eficácia para outras doenças como Rhodococcus equi, utilizando protocolos de imunização com uma ou duas doses orais e até mesmo com uma única dose nasal, sendo capazes de proteger camundongos contra a infecção experimental com o agente causador, levando a imunidade celular, humoral sistêmica e de mucosa com geração de memória imunológica. Nesta proposta, as construções vacinais serão administradas por via oral ou nasal, com a finalidade de facilitar processos de produção, trazer baixo custo de operação, diminuir riscos de contaminação, observados para as vacinas injetáveis, possibilitando uma ampla utilização em larga escala. Tal proposta, se exitosa durante todo o ciclo de desenvolvimento, virá em estágio subsequente às vacinas que, por ora, já tenham sido desenvolvidas (01/05/2021). Fonte: BV-CDI FAPESP
Este artigo resume por meio de meta-análises a eficácia geral da vacina de mRNA BNT162b2 a partir de estudos observacionais. Uma busca sistemática da literatura sem restrição de idioma foi realizada em bancos de dados eletrônicos para identificar estudos observacionais elegíveis que relataram a eficácia ajustada da vacina de mRNA BNT162b2 para prevenir COVID-19 confirmado por RT-PCR. Meta-análises com o modelo de efeitos aleatórios foram usadas para calcular a razão de risco combinada (HR) e razão da taxa de incidência combinada (IRR) em intervalos de confiança de 95%, e a eficácia da vacina foi indicada como (HR combinada - 1) / HR ou (IRR - 1 agrupado) / IRR. Dezenove estudos foram incluídos para esta meta-análise. A meta-análise revelou efeito protetor significativo contra COVID-19 confirmado por RT-PCR ≥ 14 dias após a primeira dose, com eficácia da vacina de 53% e ≥ 7 dias após a segunda dose, com eficácia da vacina de 95%. Apesar de sua eficácia, o relato de dados de segurança da vacina pelas partes interessadas relevantes deve ser incentivado, pois o mRNA de BNT162b2 é uma nova vacina que não obteve aprovação total. Existem dados limitados sobre a eficácia da vacina entre pacientes imunocomprometidos; portanto, a vacina deve ser usada com cautela nessa população de pacientes (09/07/2021). Fonte: Inflammopharmacology
Neste artigo, pesquisadores discutem a mistura de vacinas contra a COVID-19. A mistura de vacinas COVID-19 está surgindo como uma boa maneira de fornecer às pessoas a proteção de que precisam quando enfrentam problemas de segurança e suprimentos imprevisíveis. A maioria das vacinas contra SARS-CoV-2 deve ser administrada em duas doses, mas vários estudos agora confirmam a ideia de que misturar uma dose Oxford–AstraZeneca com uma dose da vacina Pfizer–BioNTech desencadeia uma resposta imunológica semelhante a - ou até mais forte que - duas doses de qualquer uma das vacinas. Os resultados anunciados por um grupo do Reino Unido sugerem que a combinação às vezes supera duas injeções da mesma vacina, e um quadro semelhante está emergindo de estudos alemães. As pessoas agora podem “se sentir um pouco mais confortáveis” com a ideia de misturar e combinar. Os resultados também estão dando aos pesquisadores a confiança de que a combinação de outras vacinas COVID-19, que ainda não foram testadas em conjunto, também pode funcionar. Mas pelo menos 16 vacinas foram aprovadas para uso em um ou mais países, e os estudos combinados até agora têm sido pequenos, portanto, ensaios mais extensos e monitoramento de longo prazo para efeitos colaterais são extremamente necessários (01/07/2021). Fonte: Nature
Pesquisadores discutem o programa norte-americano Operation Warp Speed e suas implicações para a segurança global de vacinas. O programa já forneceu US $ 18 bilhões em financiamento para o desenvolvimento de vacinas destinadas à população dos Estados Unidos. Dependendo da segurança e eficácia, as vacinas podem ser disponibilizadas por meio de mecanismos para uso emergencial, acesso ampliado com consentimento informado ou licenciamento completo (26/03/2021). Fonte: The Lancet
Estudo de coorte prospectivo nacional foi realizado na Lituânia e avaliou a resposta sorológica a uma e duas doses da vacina BNT162b2 (Comirnaty, Pfizer-BioNTech) em profissionais de saúde saudáveis e em pacientes com doenças hematológicas malignas. Os participantes elegíveis tinham 18 anos ou mais, haviam recebido ambas as doses da vacina e tinham biobancos de sangue disponíveis antes da vacinação e após a segunda dose. Amostras biobancadas e dados de saúde foram obtidos do Vilnius University Hospital Santaros Klinikos Biobank. O ensaio de micropartículas quimioluminescentes do Abbott Architect SARS-CoV-2 IgG Quant II foi usado para quantificar as concentrações séricas de anticorpo anti-SARS-CoV-2-S1 IgG (anticorpo anti-S1 IgG) 0–10 dias antes da primeira vacina BNT162b2, no dia da segunda imunização (por volta do dia 21) e 7 a 21 dias após a segunda imunização. Os eventos adversos foram avaliados por um questionário padronizado. Infecções disruptivas foram caracterizadas clinicamente e por genotipagem SARS-CoV-2 sempre que possível. Todos os participantes da coorte de profissionais de saúde saudáveis montaram uma resposta robusta de anticorpos IgG anti-S1 após a segunda dose da vacina BNT162b2 (do ponto de tempo 0 ao ponto de tempo 2) com um IQR relativamente estreito. No entanto, as respostas (do ponto de tempo 0 ao ponto de tempo 1 ao ponto de tempo 2) em pacientes com malignidades hematológicas foram heterogêneas, com respostas medianas variando em até três ordens de magnitude no ponto de tempo 2 entre os diferentes grupos de tratamento (02/07/2021). Fonte: The Lancet
No presente estudo, 69 profissionais de saúde que foram expostos a pacientes com síndrome respiratória aguda grave coronavírus-2 foram monitorados para níveis específicos de imunoglobulina (Ig) G e IgA em diferentes períodos de tempo. Antes da vacinação, após a primeira rodada de vacinação aos 21 dias (quando a segunda dose da vacina foi administrada) e 24 dias após a segunda rodada de vacinação, com uma vacina baseada em mRNA. Os níveis basais de IgG e IgA em indivíduos previamente infectados e indivíduos não infectados diferiram notavelmente. A vacinação aumentou os níveis de IgG e IgA após a primeira dose na maioria dos indivíduos de ambos os grupos, cujos níveis aumentaram ainda mais após a segunda rodada de vacinação. As associações entre os níveis de IgG e IgA após a primeira e segunda rodadas de vacinação demonstraram que em todo o grupo de vacinação, independentemente da exposição anterior ao agente infeccioso, o incremento e os níveis de IgG e IgA foram semelhantes. Assim, os níveis após a vacinação foram estatisticamente semelhantes, independentemente da linha de base inicial antes da vacinação. No presente estudo, a soroconversão foi alcançada em todos os indivíduos após a segunda rodada de vacinação, com níveis de anticorpos semelhantes (13/06/2021). Fonte: Molecular Medicine Reports
Estudo de coorte incluiu aproximadamente 10,2 milhões de pessoas da vacina inativada CoronaVac para SARS-CoV-2 foi conduzida no Chile a partir de 2 de fevereiro de 2021. Entre as pessoas que foram totalmente imunizadas, a eficácia da vacina ajustada foi de 65,9% (intervalo de confiança de 95% [IC], 65,2 a 66,6) para a prevenção de COVID-19 e 87,5% (IC 95%, 86,7 a 88,2) para a prevenção de hospitalização, 90,3% (IC 95%, 89,1 a 91,4) para a prevenção de admissão na UTI, e 86,3% (IC 95%, 84,5 a 87,9) para a prevenção de morte relacionada a COVID-19 (07/07/2021). Fonte: New England Journal Medicine
17/07 a 23/072021
Pesquisadores realizaram um estudo de modelagem para avaliar como regimes alternativos de dosagem de vacinas contra COVID-19 poderiam acelerar a vacinação global COVID-19 e reduzir a mortalidade. Primeiro, eles utilizaram a alta correlação entre a resposta de anticorpos neutralizantes e a eficácia contra a doença para mostrar que metade ou mesmo um quarto das doses de algumas vacinas geram respostas imunes associadas à alta eficácia da vacina. Também descobriram que, para os países que escolhem entre vacinas aprovadas, mas de menor eficácia, disponíveis imediatamente e aguardando vacinas de mRNA, o uso de vacinas imediatamente disponíveis reduz a mortalidade. O modelo também sugere que o adiamento da segunda dose da vacina provavelmente terá benefícios substanciais na mortalidade para combinações múltiplas, mas não para todas as variantes da vacina, ressaltando a importância da vigilância contínua (29/06/2021) Preprint. Fonte: SSRN
Aspectos científicos procedimentais e regulamentares dos processos de licenciamento COVID-19 são descritos nesta revisão. Em geral, os ensaios clínicos de fase 1 (segurança da vacina) e 2 (determinação da dose, esquema de vacinação) podem ser combinados, e os ensaios clínicos combinados de fase 2/3 são recomendados para determinar a segurança e eficácia. Ao aplicar estes requisitos fundamentais não apenas para a aprovação e análise de ensaios clínicos, mas também para a avaliação regulamentar durante a avaliação dos pedidos de autorização de introdução no mercado, várias vacinas COVID-19 eficazes e seguras foram licenciadas na UE por procedimentos inéditos, rápidos e flexíveis (06/07/2021). Fonte: Vaccines
10/07 a 16/07/2021
Um estudo da Public Heatlh England (PHE) mostrou que a aplicação de duas doses da vacina AstraZeneca apresenta 92% de efetividade contra a hospitalização pela variante Delta (B.1.617.2) do SARS-CoV-2. A variante, antes conhecida como indiana, tem se espalhado rapidamente pelo Reino Unido e já teve casos confirmados no Brasil. A vacina também demonstrou uma alta efetividade contra a variante Alpha (B.1.1.7), identificada pela primeira vez no Reino Unido, com redução de 86% nas internações. A pesquisa analisou 14.019 casos da variante Delta que chegaram às emergências dos hospitais ingleses entre 12 de abril e 4 de junho deste ano. Destes, 122 foram hospitalizados. Foi comparado o risco de internação entre os não vacinados e os vacinados com primeira e segunda doses. Outros 13.192 casos envolvendo a variante Alpha foram identificados, com 166 internações. A efetividade média em relação à taxa de hospitalização para vacinados com a variante Delta foi similar à da variante Alpha, levando em conta os dois imunizantes: Alpha com 78% (uma dose) e 92% (duas doses); Delta com 75% e 94% (respectivamente) (16/06/2021). Fonte: Public Health England
Estudo mostra que uma das principais características das vacinas de adenovírus é a capacidade de gerar populações fortes e sustentadas do elemento de célula T Killer do sistema imunológico. Em um modelo animal, os pesquisadores observaram que os vetores de adenovírus são capazes de entrar em células de tecido de longa vida, conhecidas como células reticulares fibroblásticas, que por sua vez formaram pequenos aglomerados bem organizados, atuando como "campos de treinamento" para essas células T, parecendo explicar como essas vacinas sustentam respostas robustas do sistema imunológico. Dos resultados os pesquisadores citam que a abordagem da geração mediada pelo vetor Adenovírus de depósitos antigênicos locais pode gerar imunidade local muito substancial no pulmão e a criação de tais depósitos em fibroblastos de vida longa, juntamente com a reprogramação de nichos fibroblásticos pode sustentar as respostas de células T locais, e ser relevante no desenvolvimento da imunidade local. Além disso, esses nichos imunoestimulantes locais podem contribuir para a proteção sistêmica, conforme evidenciado pela ampla distribuição de células T após a vacinação do vetor Adenovírus (15/07/2021 e 16/07/2021). Fonte: Nature e University Oxford
A vacina CoronaVac demonstrou ser bem tolerada com um bom perfil de segurança em indivíduos com 18 anos ou mais em ensaios de fase 1/2, e forneceu uma boa resposta humoral contra SARS-CoV-2. Neste artigo, pesquisaores apresentam os resultados provisórios de eficácia e segurança de um ensaio clínico de fase 3 da CoronaVac na Turquia, que envolveu 10.218 adultos participantes entre 18 e 59 anos, designados aleatoriamente para receber duas doses de vacina (6.650) ou placebo (3.568). Durante um período de acompanhamento médio de 43 dias, nove casos de COVID-19 sintomático, confirmados por teste RT-PCR, foram relatados na vacina (31,7 casos por 1000 pessoas-ano) e 32 foram relatados no grupo de placebo (192,3 casos por 1000 pessoas-ano) 14 dias ou mais após a segunda dose, produzindo uma eficácia da vacina de 83,5%. As descobertas sugerem que duas doses de CoronaVac têm eficácia robusta (dentro do perfil de produto alvo da OMS para vacinas SARS-CoV-2) e tolerabilidade aceitável quando administrada com um intervalo de 14 dias (08/07/2021). Fonte: The Lancet
Pesquisadores afirmam que um ¼ da dose da vacina Moderna contra a COVID-19 ainda desperta uma grande resposta imunológica. O estudo mostrou que duas doses, cada uma contendo apenas um quarto da dose padrão da vacina Moderna, deram origem a anticorpos protetores de longa duração e células T que combatem o vírus, de acordo com testes em quase três dezenas de pessoas. Os resultados sugerem a possibilidade de administrar doses fracionadas para esticar o estoque limitado de vacinas e acelerar o esforço global de imunização, o que pode ajudar a resolver a escassez aguda de vacinas no mundo (09/07/2021). Fonte: Nature
Em artigo de revisão, pesquisadores discutem os mecanismos imunológicos de proteção induzida por vacina contra COVID-19 em humanos. A maioria das vacinas COVID-19 são projetadas para induzir respostas imunes, idealmente anticorpos neutralizantes (NAbs), contra a proteína spike de SARS-CoV-2. Diversas vacinas, incluindo mRNA, vetor adenoviral, subunidade de proteína e vacinas de vírus inativados de células inteiras, já relataram eficácia em ensaios de fase III e receberam aprovação de emergência em muitos países. As duas vacinas de mRNA aprovadas até agora mostram eficácia mesmo após apenas uma dose, quando não-NAbs e respostas moderadas de células T auxiliares 1 são detectáveis, mas quase nenhum NAbs. Após uma única dose, as vacinas de adenovírus induzem anticorpos polifuncionais que são capazes de mediar a neutralização do vírus e de conduzir outras funções efetoras dependentes de anticorpos, bem como respostas de células T potentes. Esses dados sugerem que a proteção pode exigir níveis baixos de NAbs e pode envolver outros mecanismos efetores imunológicos, incluindo não-NAbs, células T e mecanismos imunes inatos. Identificar os mecanismos de proteção, bem como os correlatos de proteção, é crucialmente importante para informar o desenvolvimento de novas vacinas e orientar o uso de vacinas COVID-19 licenciadas em todo o mundo (01/07/2021). Fonte: Nature Reviews Immunology
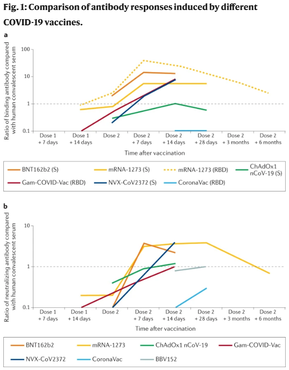
Anvisa aprovou mais duas pesquisas clínicas de vacinas contra a COVID-19. O primeiro estudo será para testar uma vacina desenvolvida pelo Instituto de Biologia Médica da Academia Chinesa de Ciências Médicas. Os testes serão em adultos com mais de 18 anos e serão aplicadas duas doses, com intervalo de 14 dias entre elas. A nova candidata usa o vírus inativado, com uma tecnologia semelhante a da Coronavac. Já o segundo estudo é sobre a vacina AstraZeneca, em uma nova versão. As duas novas vacinas já estão preparadas para imunizar contra as novas variantes do coronavírus. Ao todo, os estudos vão envolver mais de 36 mil voluntários pelo mundo e 8 mil no Brasil. Com a autorização dessas novas pesquisas, chega a 11 o número de estudos clínicos aprovados pela Anvisa de imunizantes contra a COVID-19 (14/07/2021). Fonte: Agência Brasil
02/07 a 09/07/2021
Anvisa autorizou nesta quarta-feira (7/7) o início da vacinação de voluntários do estudo clínico da vacina Butanvac. O protocolo clínico da Butanvac já havia sido aprovado pela Agência no dia 9 de junho, mas ainda havia informações pendentes especificamente sobre os dados gerados pelo Butantan relativos à inativação do vírus. A pesquisa clínica de fase 1 e 2 da Butanvac está dividida em três etapas (A, B e C). Neste momento, está autorizada a etapa A do estudo, que vai envolver 400 voluntários. Ao todo, as fases clínicas 1 e 2 têm previsão de seis mil voluntários com 18 anos ou mais. A vacina será aplicada com duas doses, em um intervalo de 28 dias entre a primeira e a segunda dose. O estudo deve ser realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP) e no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (HCFMRP) (07/07/2021). Fonte: Anvisa
Estudo avaliou a eficácia da vacinação no Chile com a vacina Coronavac, baseada em tecnologia de vírus inativado. O estudo foi conduzido de 2 de fevereiro a 1º de maio de 2021, e a coorte incluiu aproximadamente 10,2 milhões de pessoas. Entre as pessoas que foram totalmente imunizadas, a eficácia ajustada da vacina foi de 65,9% para a prevenção de COVID-19 e 87,5% para a prevenção de hospitalização, 90,3% para a prevenção de admissão na UTI, e 86,3% para a prevenção de morte relacionada a COVID-19. Os resultados sugerem que a vacina SARS-CoV-2 inativada preveniu efetivamente a COVID-19, incluindo doença grave e morte, um achado que é consistente com os resultados dos testes de fase 2 da vacina (07/07/2021). Fonte: New England J. Medicine
Em estudo, os soros de receptores de uma única dose de vacina Ad26.COV2.S para a COVID-19 (Janssen) foram testados quanto à atividade neutralizante contra várias variantes de preocupação de SARS-CoV-2. Todas as variantes testadas demonstraram suscetibilidade à neutralização sérica induzida por Ad26.COV2.S, embora reduzida em comparação com a cepa B.1. A redução mais pronunciada foi observada para as variantes B.1.351 (Beta; 3,6 vezes) e P.1 (Gama; 3,4 vezes) que contêm mutações semelhantes no domínio de ligação ao receptor (RBD), enquanto apenas uma redução de 1,6 vezes foi observado para a variante B.1.617.2 (Delta) de ampla disseminação (01/07/2021). Fonte: biorxiv
Estudo descreve a durabilidade de 8 meses das respostas imunes humorais e celulares em 20 indivíduos que receberam uma ou duas doses de 5 × 1010 vp ou 1011 vp da vacina Ad26.COV2.S (Janssen) e em 5 participantes que receberam placebo. Foram avaliadas as respostas de anticorpos e células T no dia 239, que foi 8 meses após o regime de vacina de dose única (N = 10) ou 6 meses após o regime de vacina de duas doses (N = 10). Também foi relatado respostas de anticorpos neutralizantes contra a cepa parental SARS-CoV-2 WA1 / 2020, bem como contra as variantes SARS-CoV-2 D614G, B.1.1.7 (alfa), B.1.617.1 (kappa), B .1.617.2 (delta), P.1 (gama), B.1.429 (epsilon) e B.1.351 (beta) (07/07/2021). Fonte: medrxiv
A pesquisa sobre o ChAdOx1 nCoV-19, também conhecido como a vacina Oxford-AstraZeneca, indica que um longo intervalo entre a primeira e a segunda dose não compromete a resposta imunológica após uma segunda dose tardia, e uma terceira dose da vacina continua a aumentar os anticorpos contra SARS-CoV-2. Ao examinar os efeitos de um atraso de até 45 semanas entre a primeira e a segunda dose nos participantes do estudo, os resultados demonstraram que os níveis de anticorpos aumentaram após uma segunda dose atrasada. Além disso, um atraso maior entre a primeira e a segunda doses pode ser benéfico, resultando em um título de anticorpo aumentado e resposta imune aprimorada após a segunda dose (28/06/2021). Fonte: University Oxford
Estudo indica que duas doses, cada uma contendo apenas um quarto da dose padrão da vacina Moderna COVID, deram origem a anticorpos protetores de longa duração e células T que combatem o vírus, de acordo com testes em quase três dezenas de pessoas. Os resultados sugerem a possibilidade de administrar doses fracionadas para esticar o estoque limitado de vacinas e acelerar o esforço global de imunização (09/07/2021). Fonte: Nature
Estudo de coorte prospectivo, unicêntrico e longitudinal com profissionais de saúde do Sheba Medical Center (Tel-Hashomer, Israel). 2.607 participantes tiveram um ensaio anti-SARS-CoV-2 IgG negativo antes de receber a primeira dose da vacina BNT162b2 intramuscular e foram acompanhados semanalmente por 5 semanas após a primeira dose da vacina; uma segunda dose foi dada na semana 3. Amostras de soro foram obtidas no início do estudo e os anticorpos foram testados em 1-2 semanas após a primeira dose da vacina, na semana 3 com a administração da segunda dose da vacina e nas semanas 4–5. A primeira dose de vacina induziu respostas positivas de IgG e anticorpos neutralizantes na semana 3 em 88,0% e 71,0% dos indivíduos, respectivamente, que aumentaram rapidamente na semana 4 (ou seja, 1 semana após a segunda dose da vacina) em 98,4% e 96,5% dos indivíduos, respectivamente. No geral, a análise de regressão de desfecho mostrou que as concentrações mais baixas de anticorpos foram consistentemente associadas ao sexo masculino, idade avançada (ou seja, ≥66 anos), imunossupressão e outras comorbidades específicas: diabetes, hipertensão, doenças cardíacas e doenças autoimunes. A vacina BNT162b2 induz uma resposta robusta e rápida de anticorpos. A correlação significativa entre os anticorpos IgG do domínio de ligação ao receptor e os títulos de neutralização sugere que os anticorpos IgG podem servir como um correlato da neutralização. A segunda dose da vacina é particularmente importante para indivíduos mais velhos e imunossuprimidos, destacando a necessidade de segundas vacinações em tempo hábil e, potencialmente, uma reavaliação do longo intervalo entre as doses em alguns países. As respostas de anticorpos foram reduzidas em populações suscetíveis e, portanto, podem ser mais propensas a infecções emergentes (02/07/2021). Fonte: The Lancet
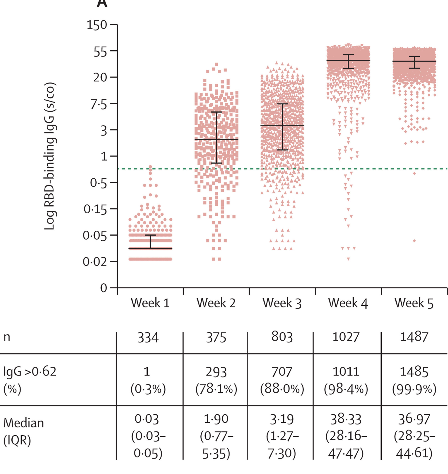
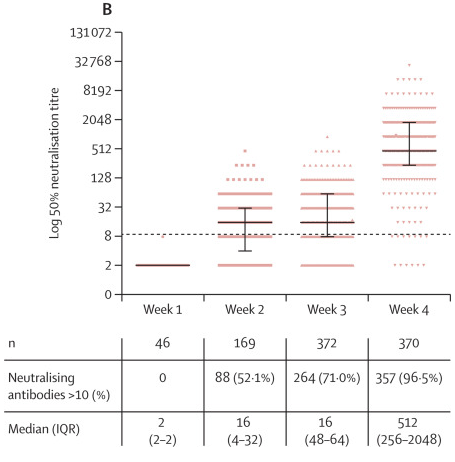
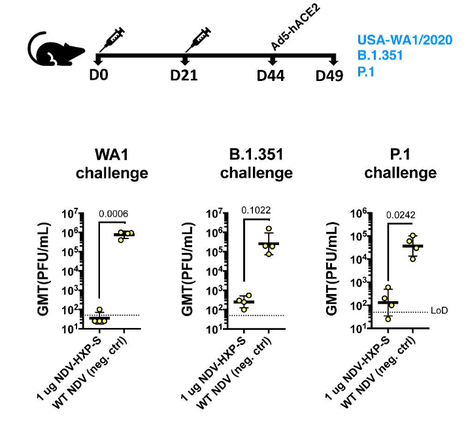
Pesquisadores desenvolveram uma vacina COVID-19 baseada no vírus da doença de Newcastle (NDV) que pode ser fabricada com alto rendimento em ovos embrionados. Neste estudo, forneceram evidências de que o vetor de NDV que expressa um antígeno de S otimizado (NDV-HXP-S) é uma vacina versátil que pode ser usada viva ou inativada para induzir respostas de anticorpos fortes e também para neutralizar variantes de preocupação. A imunidade conferida pelo NDV-HXP-S neutraliza eficazmente a infecção por SARS-CoV-2 em camundongos e hamsters. É digno de nota que os lotes de vacinas produzidos por fabricantes de vacinas do vírus da gripe à base de ovo existentes no Vietnã, Tailândia e Brasil exibiram excelente imunogenicidade e eficácia em hamsters, demonstrando que as vacinas NDV-HXP-S podem ser produzidas rapidamente em grande escala para atender às demandas globais (07/07/2021). Fonte: MedRxiv
28/06 a 02/07/2021
Estudo demonstrou que a imunização com vacina baseada em mRNA da SARS-CoV-2 induz uma resposta persistente de células B do centro germinativo (GC), permitindo a geração de imunidade humoral robusta. Foram avaliadas as respostas das células B específicas para o antígeno no sangue periférico e nos linfonodos (LNs) em indivíduos que receberam duas doses de BNT162b2. Os plasmablastos secretores de anticorpos (PBs) circulantes, secretores de IgG e IgA direcionados à proteína S atingiram o pico uma semana após a segunda imunização e, em seguida, diminuíram, tornando-se indetectáveis três semanas depois. Essas respostas dos plasmoblastos precederam os níveis máximos de anticorpos anti-S neutralizantes para a cepa de SARS-CoV-2 selvagem, bem como variantes emergentes, especialmente em indivíduos previamente infectados com SARS-CoV-2, que produziram as respostas sorológicas mais robustas . Ao examinar os aspirados de linfonodos, foram identificadas as células B de centro germinativo que se ligaram à proteína S em todos os participantes amostrados após a imunização primária. Notavelmente, altas frequências de células B e PBs do GC de ligação a proteína S foram mantidas nesses linfonodos por pelo menos doze semanas após a imunização de reforço. Os anticorpos monoclonais derivados de células B de GC dirigiam-se predominantemente ao domínio de ligação ao receptor da proteína S, com menos clones que se ligavam ao domínio N-terminal ou a epítopos compartilhados com as proteínas S dos betacoronavírus humanos OC43 e HKU1. Os últimos clones de células B com reatividade cruzada apresentaram níveis mais elevados de hipermutação somática em comparação com aqueles que reconheceram apenas a proteína S SARS-CoV-2, sugerindo uma origem de células B de memória (28/06/2021). Fonte: Nature
Estudo da vacina CoronaVac demonstrou que ela é bem tolerada e segura e induz respostas humorais em crianças e adolescentes com idade entre 3–17 anos. Os títulos de anticorpos neutralizantes induzidos pela dose de 3.0 μg foram maiores do que os da dose de 1.5 μg. Os resultados apoiam o uso de uma dose de 3.0 μg com um esquema de duas imunizações em estudos posteriores em crianças e adolescentes (28/06/2021). Fonte: The Lancet
O comitê de medicamentos humanos (CHMP) da EMA aprovou locais de fabricação adicionais para a produção de Comirnaty, a vacina COVID-19 desenvolvida pela BioNTech e Pfizer. Os novos locais que realizarão as etapas de fabricação do produto acabado em diferentes estágios do processo que estarão localizados em Reinbek, Alemanha, operado pela Allergopharma GmbH & Co. KG e o outro em Stein, Suíça, operado pela Novartis Pharma(22/06/2021). Fonte: EMA
A Variante Delta SARS-CoV-2 continua a conduzir um aumento acentuado nos casos COVID-19 no Reino Unido, com um tempo de duplicação atual de 3,5-16 dias, consistente com o anterior ondas pandêmicas durante 2020–21, e um aumento sustentado no número de reprodução (R) para 1.2–1.4. As admissões hospitalares diárias e o número de pacientes que requerem ventilação mecânica estão agora aumentando na Inglaterra e na Escócia, apesar da rolagem contínua - fora da vacinação generalizada no Reino Unido. A vacina ChAdOx1 nCoV-19 (AZD1222, Oxford – AstraZeneca) forma o núcleo do programa de vacinação do Reino Unido e do programa global COVAXX. Para determinar a sensibilidade da variante Delta a anticorpos neutralizantes (NAbs) induzidos por AZD1222 e para comparar isso com as medições anteriores de NAbs induzidos por BNT162b2 (Pfizer – BioNTech), está sendo realizado uma segunda análise inicial dos participantes do estudo Legacy vacinados com AZD1222. Os dados reforçam a necessidade de reconhecer a proteção aumentada oferecida por uma segunda dose de vacina como casos de COVID-19 associados ao aumento da variante delta. Eles também sugerem que mais imunizações de reforço podem ser necessárias, especialmente para grupos mais suscetíveis que receberam vacinas que induzem NAbs abaixo da média. Assim como acontece com as vacinas de mRNA, pode ser viável priorizar o uso da vacina AZD1222, em vista do fornecimento severamente restrito, para pessoas com história confirmada de COVID-19. No geral, os resultados destacam a necessidade urgente de expansão do monitoramento sorológico de NAbs dentro de subpopulações. Isso permitirá um melhor entendimento da evolução da eficácia da vacina e facilitará a produção de vacinas atualizadas, garantindo assim a proteção máxima contra as variantes do SARS-CoV-2 (28/06/2021). Fonte: The Lancet
O município de Botucatu, no interior paulista, registrou queda de 71,3% nos casos de COVID-19 em seus moradores seis semanas após iniciar a vacinação em massa na população. Os dados são de um estudo realizado com o apoio do Ministério da Saúde sobre a eficácia da vacina da AstraZeneca/Oxford, produzida pela Fundação Oswaldo Cruz (Fiocruz) no Brasil. O início do programa de vacinação em massa ocorreu na cidade no dia 16 de maio, quando 65 mil moradores foram vacinados em um único dia. Até o momento, cerca de 77 mil moradores receberam, pelo programa, a primeira dose da vacina, cuja segunda dose é aplicada após 90 dias. Botucatu tem cerca de 150 mil habitantes, dos quais 106 mil são maiores de 18 anos(28/06/2021). Fonte: Agência Brasil
O estudo, da Universidade de Oxford, mostrou que uma terceira dose da vacina aumenta as respostas imunes de anticorpos e de células T. Ao mesmo tempo, a aplicação da segunda dose pode ser adiada para até 45 semanas após a aplicação da primeira e, ainda assim, levar a um aprimoramento da resposta imune. O governo do Reino Unido diz que analisa planos para uma campanha de aplicação de doses de reforço no outono do Hemisfério Norte, com três quintos dos adultos já com as duas doses de vacinas contra COVID-19 aplicadas. O diretor do Grupo de Vacinas de Oxford, afirmou que as evidências de que a vacina protege contra as variantes existentes por um período sustentável significam que uma dose de reforço pode não ser necessária(28/06/2021). Fonte: Agência Brasil
Esquemas mistos envolvendo Pfizer-BioNTech e Oxford-AstraZeneca geram uma forte resposta imunológica contra a proteína IgG de spike de SARS-CoV2 com doses administradas com quatro semanas de intervalo; dados para o intervalo entre as doses de 12 semanas serão lançados em breve. As respostas imunes diferiram de acordo com a ordem de imunização, com Oxford-AstraZeneca seguido por Pfizer-BioNTech gerando a melhor resposta imune fora dos dois esquemas mistos. Doses alternadas das vacinas Oxford-AstraZeneca e Pfizer-BioNTech geram respostas imunes robustas contra COVID-19, de acordo com pesquisadores que conduzem o estudo Com-COV conduzido pela Universidade de Oxford(28/06/2021). Fonte: University Oxford
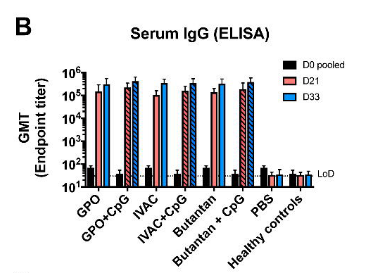
Pesquisadores avaliaram a imunogenicidade e a reatogenicidade da vacina BNT162b2 (Comirnaty, BioNTech, Mainz, Alemanha) administrada como segunda dose em participantes preparados com ChAdOx1-S (Vaxzevria, AstraZeneca, Oxford, Reino Unido). Entre 24 e 30 de abril de 2021, 676 indivíduos foram inscritos e designados aleatoriamente para o grupo de intervenção (n = 450) ou grupo de controle (n = 226) em cinco hospitais universitários na Espanha. Os títulos médios geométricos de anticorpos RBD aumentaram de 71,46 BAU / mL na linha de base para 7756,68 BAU / no dia 14. A IgG contra a proteína S trimérica aumentou de 98,40 BAU / mL para 3684,87 BAU / mL. A proporção intervencionista: controle foi de 77,69 para a proteína RBD e 36,41 para a proteína IgG de spike trimérica. As reações foram leves (n = 1210 [68%]) ou moderadas (n = 530 [30%]), com dor no local da injeção (n = 395 [88%]), induração (n = 159 [35%]), dor de cabeça (n = 199 [44%]) e mialgia (n = 194 [43%]) os eventos adversos mais comumente relatados. Não foram relatados eventos adversos graves. O BNT162b2 administrado como uma segunda dose em indivíduos vacinados com ChAdOx1-S induziu uma resposta imune robusta, com um perfil de reatogenicidade aceitável e administrável. Este estudo está registrado como EudraCT (2021-001978-37) e ClinicalTrials.gov (NCT04860739) e está em andamento (25/06/2021). Fonte: The Lancet
Estudo teve como objetivo desenvolver uma vacina multi-antígeno oral SARS-CoV-2 composta pelo domínio de ligação ao receptor (RBD) da proteína S viral, dois domínios da proteína do nucleocapsídeo viral (N) e enterotoxina B termolábil (LTB ), um potente adjuvante da mucosa. As respostas imunes humorais, mucosas e mediadas por células de um esquema de vacinação de três doses e um esquema de imunização subcutânea heterólogo e de reforço oral foram avaliadas em camundongos e ratos, respectivamente. Os camundongos que receberam a vacina oral em comparação com os camundongos de controle mostraram aumento significativo do anticorpo neutralizante do vírus pós-dose-3, produção de IgG e IgA anti-S e secreção de IFN-γ e IL-2 estimulada pela proteína N pelas células T. Quando administrada como reforço a ratos após iniciação parenteral com a proteína S1 viral, a vacina oral elicitou títulos de anticorpos neutralizantes marcadamente mais altos do que o reforço oral com placebo. Um único reforço oral após duas doses subcutâneas de priming induziu níveis séricos de IgG e IgA mucosal semelhantes aos aumentados por três doses subcutâneas. Em conclusão, a vacina SARS-CoV-2 de múltiplos epítopos com adjuvante de LTB oral desencadeou respostas imunes humorais, celulares e mucosas versáteis, que provavelmente fornecem proteção, ao mesmo tempo que minimizam os obstáculos técnicos que atualmente limitam a vacinação global (09/06/2021). Fonte:bioRxiv
Estudo descreve um caso de deficiência visual aguda após a segunda dose da vacina Pfizer-BioNTech. O perfil de segurança da vacina parece comparável ao de outras vacinações de vírus, embora, dada a situação de emergência, o monitoramento dos efeitos de longo prazo não tenha sido possível(04/06/2021). Fonte: Inflammation Research
Este trabalho demonstra a segurança da vacina Oxford-AstraZeneca e que qualquer desenvolvimento de efeitos colaterais pode ser facilmente gerenciado com um diagnóstico imediato e em um curto espaço de tempo com alguns medicamentos comumente usados (01/06/2021). Fonte:Viruses
Pesquisadores conduziram um estudo observacional prospectivo incluindo dados de 704.003 receptores de primeiras doses da vacina BNT162b2; 6536 eventos adversos após a imunização (EAPV) foram relatados, dos quais 65,1% tiveram pelo menos um EAPV neurológico (99,6% não graves). Trinta e três eventos graves foram relatados; 17 (51,5%) eram neurológicos. No momento da redação deste relatório, 16/17 casos haviam recebido alta sem óbitos. Os dados sugerem que a vacina BNT162b2 mRNA COVID-19 é segura; seus benefícios individuais e sociais superam a baixa porcentagem de EAPV neurológicos graves (18/06/2021). Fonte: Clinical Immunology
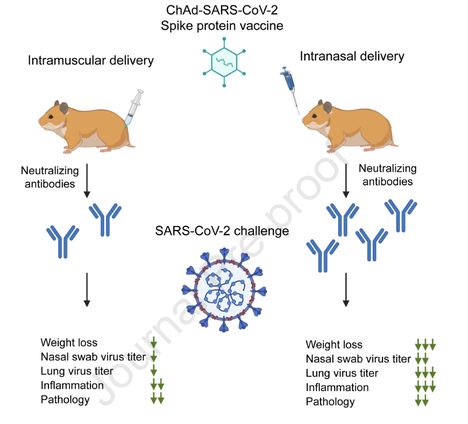
Pesquisadores compararam a capacidade protetora de entrega intranasal e intramuscular de vacina vetorizada de adenovírus de chimpanzé que codifica uma proteína spike estabilizada de pré-fusão (ChAd-SARS-CoV-2-S) em hamsters sírios dourados. Enquanto a imunização com ChAd-SARS-CoV-2-S induziu anticorpos robustos específicos da proteína spike capazes de neutralizar o vírus, os níveis de anticorpos no soro foram mais elevados em hamsters vacinados por via intranasal em comparação com a via intramuscular. Consequentemente, contra o desafio com SARS-CoV-2, os hamsters imunizados com ChAd-SARS-CoV-2-S foram protegidos contra menos perda de peso e reduziram a infecção viral em esfregaços nasais e pulmões e reduziram a patologia e a expressão de genes inflamatórios nos pulmões, em comparação com hamsters imunizados com ChAd-Control. A imunização intranasal com ChAd-SARS-CoV-2-S forneceu proteção superior contra infecção por SARS-CoV-2 e inflamação no trato respiratório superior. Esses achados apoiam a administração intranasal da vacina candidata ChAd-SARS-CoV-2-S para prevenir a infecção, doença e possível transmissão de SARS-CoV-2 (22/06/2021). Fonte: Cell Reports
21 a 25/06/2021
Os anticorpos neutralizantes induzidos por vacinas são essenciais no combate à pandemia de COVID-19. No entanto, atrasos no reforço da imunização devido à disponibilidade limitada de vacinas podem deixar os indivíduos vulneráveis à infecção e a cursos prolongados ou graves da doença. O surgimento de variantes de preocupação do SARS-CoV-2 (VOC), B.1.1.7 (Reino Unido), B.1.351 (África do Sul) e P.1 (Brasil) pode exacerbar esse problema, já que os dois últimos são capazes de escapar do controle de anticorpos. Esses resultados questionam se os anticorpos neutralizantes contribuem significativamente para a proteção contra COVID-19 após vacinação única e sugerem que a imunidade celular é central para as defesas iniciais contra COVID-19 (16/06/2021). Fonte: Clinical Infections Diseases
Estudo demostrou que a vacina Ad26.COV2.S (Janssen), que expressa uma proteína Spike estabilizada da cepa WA1/2020, induz respostas imunes humorais e celulares que reagem de forma cruzada com a variante sul africana B.1.351 e protegem contra o desafio de B.1.351 em macacos rhesus. Ad26.COV2.S induziu menor ligação e anticorpos neutralizantes contra B.1.351 em comparação com WA1/2020, mas desencadeou respostas de células T CD8 e CD4 que eram comparáveis contra WA1/2020, B.1.351, B.1.1.7, P.1 e variantes CAL.20C. A infecção B.1.351 de macacos rhesus de controle simulado resultou em níveis mais elevados de replicação do vírus em lavagem broncoalveolar e esfregaços nasais do que a infecção WA1/2020. Ad26.COV2.S forneceu proteção robusta contra WA1/2020 e B.1.351, embora se tenha observado níveis mais elevados de vírus em animais vacinados após o desafio com B.1.351. Estes dados demonstram que Ad26.COV2.S forneceu proteção robusta contra o desafio B.1.351 em macacos rhesus, e, portanto, têm implicações importantes para o controle da vacina de variantes de preocupação do SARS-CoV-2 (23/06/2021). Fonte: Nature
Artigo discute o que pode ter dado errado com a vacina da empresa alemã CureVac, que apresentou desempenho surpreendentemente fraco CureVac. O resultado não é apenas uma decepção, é um quebra-cabeça científico. A empresa culpa a rápida mudança do vírus pandêmico. Mas vários pesquisadores externos suspeitam que o projeto da vacina é o culpado. Muitos cientistas e investidores esperavam que o candidato do CureVac, que usa RNA mensageiro (mRNA) para codificar a proteína S do SARS-CoV-2, tivesse uma boa chance de se tornar uma das novas armas mais poderosas contra a pandemia. Ele se baseia essencialmente na mesma nova tecnologia de mRNA das vacinas da Pfizer-BioNTech e Moderna, que demonstraram mais de 90% de eficácia em seus testes e possuia algumas vantagens práticas de transporte e armazenamento em relação às vacinas rivais. Mas os resultados provisórios de um grande ensaio clínico revelaram que ele ofereceu apenas 47% de eficácia (25/06/2021). Fonte: Science
Um ensaio de fase 3 internacional, randomizado, duplo-cego, controlado por placebo, analisou a segurança e eficácia da vacina Ad26.COV2.S (Janssen). Foram distribuídos aleatoriamente participantes adultos em uma proporção de 1: 1 para receber uma dose única de Ad26.COV2.S (5 × 1010 partículas virais) ou placebo. Os desfechos primários foram a eficácia da vacina contra a COVID-19 com um início de pelo menos 14 dias e pelo menos 28 dias após a administração entre os participantes da população por protocolo com teste negativo para SARS-CoV-2. A população por protocolo incluiu 19.630 participantes negativos para SARS-CoV-2 que receberam Ad26.COV2.S e 19.691 que receberam placebo. Ad26.COV2.S protegeu contra COVID-19 crítico moderado a grave com início pelo menos 14 dias após a administração. A eficácia da vacina foi maior contra COVID-19 crítico-grave (76,7% para início em ≥14 dias e 85,4% para início em ≥28 dias). Apesar de 86 de 91 casos (94,5%) na África do Sul com vírus sequenciado com a variante 20H/501Y.V2, a eficácia da vacina foi de 52,0% e 64,0% contra COVID-19 crítico moderado a grave com início em pelo menos 14 dias e pelo menos 28 dias após a administração, respectivamente, e a eficácia contra COVID-19 crítico-grave foi de 73,1% e 81,7%, respectivamente. A reatogenicidade foi geralmente leve a moderada e transitória. A incidência de eventos adversos graves foi equilibrada entre os dois grupos. Três mortes ocorreram no grupo da vacina (nenhuma foi relacionada à COVID-19) e 16 no grupo do placebo (5 foram relacionadas à COVID-19). Em conclusão, uma dose única de Ad26.COV2.S protegeu contra a infecção sintomática de COVID-19 e SARS-CoV-2 assintomática e foi eficaz contra doenças críticas graves, incluindo hospitalização e morte. A segurança é semelhante à de outros ensaios de fase 3 com vacinas para COVID-19 (10/06/2021). Fonte: New Engl. J. Medicine

14 a 18/06/2021
Um estudo da Public Heatlh England (PHE) mostrou que a aplicação de duas doses da vacina AstraZeneca apresenta 92% de efetividade contra a hospitalização pela variante Delta (B.1.617.2) do SARS-CoV-2. A variante, antes conhecida como indiana, tem se espalhado rapidamente pelo Reino Unido e já teve casos confirmados no Brasil. A vacina também demonstrou uma alta efetividade contra a variante Alpha (B.1.1.7), identificada pela primeira vez no Reino Unido, com redução de 86% nas internações. A pesquisa analisou 14.019 casos da variante Delta que chegaram às emergências dos hospitais ingleses entre 12 de abril e 4 de junho deste ano. Destes, 122 foram hospitalizados. Foi comparado o risco de internação entre os não vacinados e os vacinados com primeira e segunda doses. Outros 13.192 casos envolvendo a variante Alpha foram identificados, com 166 internações. A efetividade média em relação à taxa de hospitalização para vacinados com a variante Delta foi similar à da variante Alpha, levando em conta os imunizantes da Astrazeneca e da Pfizer (também utilizada no Reino Unido): Alpha com 78% (uma dose) e 92% (duas doses); Delta com 75% e 94% (respectivamente). (16/06/2021). Fonte: Public Health England
Artigo buscou avaliar as respostas imunes humorais e celulares ao SARS-CoV-2 de tipo selvagem e as variantes de preocupação B.1.1.7 e B.1.351 em uma coorte de 121 profissionais de saúde vacinados (HCW) com BNT162b2. Vinte e três HCW se recuperaram de doença COVID-19 leve e exibiram uma resposta de recall com altos níveis de anticorpos funcionais específicos para SARS-CoV-2 e células T específicas para o vírus após uma única vacinação. Respostas imunes específicas também foram detectadas em HCW soronegativos após uma vacinação, mas uma segunda dose foi necessária para atingir altos níveis de anticorpos funcionais e respostas imunes celulares em todos os indivíduos. Os anticorpos induzidos pela vacinação neutralizaram de forma cruzada as variantes B.1.1.7 e B.1.351, mas a capacidade de neutralização e a funcionalidade mediada por Fc contra B.1.351 foi consistentemente 2 a 4 vezes menor do que a do vírus homólogo. Os pesquisadores não observaram diferenças na ativação de células T CD4 + em resposta a antígenos variantes, indicando que as proteínas S das cepas B.1.1.7 e B.1.351 não escapam da imunidade mediada por células T induzida pela proteína S de tipo selvagem. Em conclusão, o estudo mostra que algumas variantes podem escapar parcialmente da imunidade humoral induzida pela infecção por SARS-CoV-2 ou vacinação pela BNT162b2, mas a ativação de células T CD4 + específicas de S não é afetada pelas mutações em B.1.1.7 e B .1.351 variantes (25/05/2021). Fonte: Science
Estudo busca avaliar a tolerância à vacina Pfizer-BioNTech em 1.808 pacientes alérgicos. As reações alérgicas após a vacinação foram relatadas com maior frequência em indivíduos alérgicos: após a primeira dose (p = 0,00001) e após a segunda dose (p = 0,001). A rinite foi o sintoma mais frequente observado em pacientes alérgicos. Não ocorreram reações alérgicas graves durante todo o ciclo de vacinação. Embora a vacina Pfizer-BioNTech seja menos tolerada por indivíduos alérgicos do que não alérgicos, os sintomas adversos que ocorrem são leves e não impedem uma conclusão bem-sucedida do ciclo de vacinação (25/05/2021). Fonte: Vaccines
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a indicação da vacina Comirnaty, da Pfizer, para crianças com 12 anos de idade ou mais. Com isso, a bula da vacina passará a indicar essa nova faixa etária para o Brasil. De acordo com a agência, a ampliação foi aprovada após a apresentação de estudos desenvolvidos pelo laboratório que indicaram a segurança e eficácia da vacina para esse grupo. Os estudos foram desenvolvidos fora do Brasil e avaliados pela Anvisa (11/06/2021). Fonte: Agência Brasil
Atualmente, três vacinas estão autorizadas para adultos nos Estados Unidos. Em estudos com dezenas de milhares de pessoas, essas vacinas foram seguras e eficazes. A vacina fabricada pela Pfizer foi recentemente autorizada para crianças a partir de 12 anos. Recomenda-se que duas doses desta vacina sejam administradas com 3 semanas de intervalo. As outras 2 vacinas foram autorizadas para pessoas com 18 anos ou mais, mas devem estar disponíveis para adolescentes em breve. Estudos em crianças maiores de 6 meses estão em andamento e se esses estudos mostrarem que são seguras e eficazes, as vacinas podem estar disponíveis para crianças de 6 meses ou mais no final de 2021 ou início de 2022 (04/06/2021). Fonte: Jama
Um relatório de monitoramento de segurança da vacina Janssen (Johnson & Johnson) COVID-19 durante março de 2021 a abril de 2021 nos Estados Unidos, descreveu 3 mulheres adultas, que desenvolveram trombose com síndrome de trombocitopenia (TTS) após a administração de Vacina COVID-19 Ad26.cov2-s. As mulheres adultas receberam a vacina COVID-19 IM Ad26.cov2-s. Após 6-11 dias, as mulheres desenvolveram sinais e sintomas como cefaleia, paresia do lado esquerdo, inchaço na perna esquerda, hematomas, náuseas, vômitos, falta de ar ou estado mental alterado. A contagem de plaquetas estava na faixa de 15.000 / µL-60.000 / µL. As mulheres foram diagnosticadas com TTS (05/06/2021). Fonte: Reactions Weekly
02 a 09/06/2021
A Anvisa concedeu a autorização para a pesquisa clínica da vacina Butanvac, do Instituto Butantan. Com isso os testes com a vacina em humanos poderão ter início no Brasil. Antes de iniciar a vacinação dos voluntários, o Butantan ainda apresentará algumas informações complementares sobre testes em andamento com a vacina. Logo em seguida, o Butantan deve iniciar a aplicação experimental da Butanvac. Esta será a primeira vez que a Butanvac será aplicada em humanos e por isso serão conduzidas as fases clínicas 1 e 2. Neste momento, está autorizada a etapa A do estudo que vai envolver 400 voluntários. Ao todo, a fase clínica 1 e 2 tem previsão de 6 mil voluntários com 18 anos ou mais. A vacina será aplicada com duas doses em um intervalo de 28 dias entre a primeira e a segunda dose. O estudo deve ser realizado no Hospital das Clínicas (FMUSP) e no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (09/06/2021). Fonte: Anvisa
Estudo avaliou a eficácia em curto prazo da primeira dose da vacina mRNA BNT162b2, da farmacêutica Pfizer/BioNtech, contra a infecção por SARS-CoV-2 de 13 a 24 dias após a imunização em um ambiente real. Foram analisados dados de 503.875 indivíduos, dos quais 351.897 tinham dados de acompanhamento para os dias 13 a 24. A incidência cumulativa de infecção por SARS- CoV-2 foi de 2.484 indivíduos (0,57%) durante os dias 1 a 12 e 614 indivíduos (0,27%) nos dias 13 a 24. A incidência média ponderada (SE) diária de infecção por SARS-CoV-2 nos dias 1 a 12 foi 43,41 infecções por 100.000 habitantes e 21,08 infecções por 100.000 habitantes nos dias 13 a 24, com uma redução do risco relativo (RRR) de 51,4%. A diminuição na incidência foi evidente a partir do dia 18 após a primeira dose. RRRs semelhantes foram calculados em indivíduos com 60 anos ou mais (44,5%), aqueles com menos de 60 anos (50,2%). Os pesquisadores concluem que os resultados de eficácia de uma dose única da vacina BNT162b2 foram comparáveis aos do ensaio clínico randomizado de fase III (07/06/2021). Fonte: JAMA
Estudo estimou, em um ambiente de vida real na Dinamarca, a eficácia da vacina (VE) do mRNA BNT162b2 contra infecção confirmada por SARS-CoV-2, na admissão hospitalar e morte entre cinco grupos prioritários para vacinação. Participaram da pesquisa 864.096 indivíduos que foram os primeiros a receber a vacina de mRNA BNT162b2: 46.101 residentes em instituições de longa permanência (LTCF), 61.805 indivíduos com 65 anos ou mais vivendo em casa, mas necessitando de ajuda prática e cuidados pessoais (65PHC), 98.533 indivíduos ≥85 anos de idade (+85), 425.799 profissionais de saúde (PS) e 231.858 indivíduos com comorbidades que predispõem à doença COVID-19 grave. 7 dias após a segunda dose, o VE contra a infecção por SARS-CoV-2 em todos os grupos variou de 53-86%. Em 65PHC, HCW e SCD, observou-se uma redução substancial no risco de infecção 0-7 dias após a segunda dose variando de 46-71%. O VE contra as admissões relacionadas a COVID-19 variou de 75-87% em todos os grupos, exceto +85 e profissionais de saúde onde nenhum evento ocorreu. Para os óbitos relacionados ao COVID-19, um VE significativo foi observado em residentes de ILPI (VE de 89%) e 65PHC (VE de 97%), enquanto nenhum evento foi observado nos três grupos restantes. VE contra todas as causas de morte variou de 26-73% em todos os grupos, exceto HCW, onde um VE insignificante foi estimado. Para todas as causas de admissão, o VE variou de 37-50% em todos os grupos, exceto no SCD, onde um VE negativo foi observado. O estudo concluiu que, em um cenário da vida real e mais de 7 dias após a segunda dose de BNT162b2 mRNA ter sido administrada aos indivíduos mais vulneráveis, a vacina foi associada a uma redução da infecção por SARS-CoV-2 (53-86%) e admissões relacionadas (≥75%) ou óbitos (≥89%) por COVID- 19 (02/06/2021). Fonte: medRxiv
Pesquisadores relatam as respostas imunes humorais e celulares de 20 indivíduos vacinados com Ad26.COV2.S, da farmacêutica Janssen, do ensaio clínico de fase 1/2 de COV1001 contra a cepa WA1/2020 de SARS-CoV-2 original, bem como contra as variantes preocupantes B.1.1.7, CAL .20C, P.1. e B.1.351. A vacina Ad26.COV2.S induziu títulos médios de anticorpos neutralizantes de pseudovírus que foram 5,0 e 3,3 vezes mais baixos contra as variantes B.1.351 e P.1, respectivamente, em comparação com WA1/2020 no dia 71 após a vacinação. Os títulos médios de anticorpos de ligação foram 2,9 e 2,7 vezes mais baixos contra as variantes B.1.351 e P.1, respectivamente, em comparação com WA1/2020. Fagocitose celular dependente de anticorpos, deposição de complemento e respostas de ativação de células NK foram amplamente preservadas contra a variante B.1.351. As respostas das células T CD8 e CD4, incluindo as respostas da memória central e efetora, foram comparáveis entre as variantes WA1/2020, B.1.1.7, B.1.351, P.1 e CAL.20C. Estes dados mostram que as respostas de anticorpos neutralizantes induzidas por Ad26.COV2.S foram reduzidas contra as variantes B.1.351 e P.1, mas as respostas de anticorpos não neutralizantes funcionais e as respostas de células T foram amplamente preservadas contra as variantes de SARS-CoV-2. Essas descobertas têm implicações para a proteção da vacina contra as variantes do SARS-CoV-2 preocupantes (09/06/2021). Fonte: Nature
Pesquisadores relataram a imunogenicidade e segurança da vacina inativada contra SARS-CoV-2, a KCONVAC das empresas Shenzhen Kangtai Biological Products e Beijing Minhai Biotechnology Company, em adultos saudáveis. Ensaios clínicos randomizados, duplo-cegos e controlados por placebo de fase 1 e fase 2 do KCONVAC foram conduzidos em adultos chineses saudáveis com idade entre 18 e 59 anos. Os participantes no estudo de fase 1 foram randomizados para receber duas doses, uma de cada nos dias 0 e 14, de KCONVAC (5 ou 10 μg/dose) ou placebo. Os participantes do estudo de fase 2 foram randomizados para receber KCONVAC (a 5 ou 10 μg/dose) ou placebo nos dias 0 e 14 (regime 0/14) ou dias 0 e 28 (regime 0/28). Ambas as doses de KCONVAC são bem toleradas e capazes de induzir respostas imunes robustas em adultos saudáveis. Esses resultados apóiam o teste da vacina de 5 μg no regime 0/28 em um próximo ensaio de eficácia de fase 3 (05/06/2021). Fonte: Chinese Medical Journal
As informações são limitadas para as vacinas de RNA mensageiro BNT162b2 (Pfizer – BioNTech) e de mRNA – 1273 (Moderna) em relação à eficácia das vacinas (VE) na prevenção da infecção por SARS–CoV–2 ou na atenuação de doenças quando administrada em condições reais. Neste estudo, coortes prospectivas de 3.975 profissionais de saúde, socorristas e outros trabalhadores essenciais e de linha de frente completaram o teste de SARS-CoV-2 semanal durante 14 de dezembro de 2020 a 10 de abril de 2021. Os esfregaços nasais de concha média auto-coletados foram testados por meio de RT – PCR. O SARS–CoV–2 foi detectado em 204 (5,1%) participantes; 16 foram parcialmente (≥14 dias após a dose – 1 a 13 dias após a dose – 2) ou totalmente (≥14 dias após a dose – 2) vacinados e 156 não foram vacinados; 32 com estado indeterminado (<14 dias após a dose – 1) foram excluídos. O VE ajustado da vacinação completa foi de 91% contra infecção por SARS–CoV–2 sintomática ou assintomática e a VE da vacinação parcial foi de 81%. Entre os participantes parcial ou totalmente vacinados com infecção por SARS–CoV–2, a carga viral média de RNA (Log10 cópias / mL) foi 40% menor, o risco de COVID–19 febril auto-relatado foi 58% menor e 2,3 dias a menos foram passados doentes na cama em comparação com participantes infectados não vacinados. Os pesquisadores concluíram que as vacinas de mRNA autorizadas foram altamente eficazes entre adultos em idade produtiva na prevenção de infecções por SARS-CoV-2 quando administradas em condições do mundo real e carga de RNA viral atenuada, sintomas febris e duração da doença entre aqueles com infecção invasiva, apesar da vacinação (02/06/2021). Fonte: medRxiv
Diante da escassez de vacinas COVID-19 e efeitos colaterais imprevistos, alguns países adotaram uma estratégia não comprovada: trocar as vacinas no meio do caminho. A maioria das vacinas autorizadas requer duas doses administradas com semanas ou meses de intervalo, mas o Canadá e vários países europeus agora estão recomendando uma vacina diferente para a segunda dose em alguns pacientes. Os dados iniciais sugerem que a abordagem, nascida da necessidade, pode realmente ser benéfica. Em três estudos recentes, os pesquisadores descobriram que seguir uma dose da vacina feita pela AstraZeneca com uma dose da vacina Pfizer-BioNTech produz fortes respostas imunológicas, medidas por exames de sangue. Dois dos estudos sugerem que a resposta da vacina mista será pelo menos tão protetora quanto duas doses do produto Pfizer-BioNTech, uma das vacinas COVID-19 mais eficazes (09/06/2021). Fonte: Science
31/05/2021
O projeto S propôs a imunização de toda a população adulta do município de Serrana, no interior paulista, com a vacina CoronaVac, do Butantan, dos resultados tiveram uma redução dos casos sintomáticos de COVID-19 de 80%, as internações, 86%, e as mortes, 95% após a segunda vacinação do último grupo. A principal conclusão do Projeto S foi a redução constatada por meio da comparação dos dados desde o início do projeto – até completar a vacinação de todos os grupos – com o restante do trimestre avaliado (fevereiro, março e abril de 2021). Os resultados também mostraram que a vacinação protege tanto os adultos que receberam as duas doses do imunizante quanto as crianças e adolescentes com menos de 18 anos, que não foram vacinados. A redução de casos em pessoas que não receberam a vacina indica a queda da circulação do vírus, segundo os pesquisadores. Outra conclusão importante é a avaliação da incidência da doença em Serrana na comparação com as cidades vizinhas. Serrana tem cerca de 10 mil moradores que trabalham em Ribeirão Preto diariamente. Porém, enquanto Ribeirão Preto e cidades da região vêm apresentando alta nos casos de COVID-19, Serrana manteve taxas de incidência baixas graças à vacinação. Ou seja, além da queda das infecções, os moradores que transitam em outras cidades não trouxeram um incremento relevante nos casos. O projeto S criou um “cinturão imunológico” em Serrana, uma barreira coletiva contra o vírus, reduzindo drasticamente a transmissão no município (31/05/2021). Fonte: Butantan

Para avaliar a resistência potencial de novas variantes à neutralização induzida pelo CoronaVac, foram avaliados soros de 93 profissionais de saúde saudáveis do Hospital Nanjing Drum Tower (China) que receberam duas doses de CoronaVac. Os soros foram obtidos antes da primeira dose e no dia 14 após as duas doses. Pesquisadores testaram sua atividade de neutralização contra vírus pseudotipados SARS-CoV-2 baseados em lentivírus contendo a proteína spike da cepa de referência Wuhan-1 (tipo selvagem), bem como seis variantes circulantes, incluindo D614G, B.1.1.7 (identificado pela primeira vez no Reino Unido), B.1.351 (identificado pela primeira vez na África do Sul), P.1 (identificado pela primeira vez no Brasil), B.1.429 (identificado pela primeira vez na Califórnia, EUA) e B.1.526 (identificado pela primeira vez em Nova York, NY, EUA). Todos os soros pré-vacinais mostraram níveis indetectáveis de neutralização contra as sete variantes do SARS-CoV-2 testadas. Após a inoculação de duas doses, 76 (82%) amostras de soro foram capazes de neutralizar o pseudovírus do tipo selvagem. Em comparação com a atividade contra a cepa de tipo selvagem, os soros pós-vacinação foram igualmente eficazes na neutralização das variantes D614G, B.1.1.7 e B.1.429, enquanto a eficiência da neutralização do soro diminuiu significativamente para B.1.526 (por um fator de 4,03 ), P.1 (por um fator de 3,92) e B1.351 (por um fator de 5,27). Além disso, apenas uma pequena proporção de soros pós-vacina foi capaz de neutralizar B.1.526 (24 [26%]), P.1 (32 [34%]) e B. 1.351 (cinco [5%]). De forma consistente, os soros pós-vacina tiveram títulos significativamente reduzidos de IgG específicos para o domínio de ligação ao receptor contendo E484K (RBD) em comparação com aqueles específicos para RBD de tipo selvagem, que podem ser responsáveis pelo escape imunológico por VOCs contendo E484K (27/05/2021). Fonte: The Lancet
Pesquisadores obtiveram amostras de soro e saliva de grupos de indivíduos vacinados (Pfizer BNT-162b2), infectados e não infectados e caracterizaram a resposta de anticorpos a cepas mutantes de RBD. Indivíduos vacinados apresentam uma resposta humoral robusta após a segunda dose e altos títulos de anticorpos IgG na saliva. As respostas de anticorpos, no entanto, mostram diferenças consideráveis na ligação a mutantes de RBD de variantes emergentes de preocupação e uma redução substancial na ligação de RBD e a neutralização é observada contra uma variante sul-africana isolada de paciente. Tomados em conjunto, os dados reforçam a importância da segunda dose de Pfizer BNT-162b2 para adquirir altos níveis de anticorpos neutralizantes e altos títulos de anticorpos na saliva sugerem que os indivíduos vacinados podem ter reduzido o potencial de transmissão. A neutralização substancialmente reduzida para a variante sul-africana destaca ainda mais a importância das estratégias de vigilância para detectar novas variantes e direcioná-las em futuras vacinas (25/05/2021). Fonte: Nature

Anvisa recebeu uma solicitação da Pfizer para ampliar a faixa etária de indicação da sua vacina contra a COVID-19. A empresa quer incluir o público adolescente com 12 anos de idade ou mais na bula da vacina, que hoje está registrada no Brasil. Atualmente, a vacina Comirnaty está autorizada para pessoas com 16 anos de idade ou mais. O pedido da Pfizer foi protocolado no dia 13 de maio e o prazo de avaliação da Anvisa é de até 30 dias (31/05/2021). Fonte: ANVISA
28/05/2021
Na ausência de reatividade do anticorpo de vacinação para o domínio de ligação ao receptor (RBD) do SARS-CoV-2, a atividade neutralizante e o número de células B de memória específicas do RBD permanecem relativamente estáveis de 6 a 12 meses (coorte de 63 indivíduos convalescentes de COVID-19 avaliados 1,3, 6,2 e 12 meses após a infecção, 41% dos quais também receberam vacinas de mRNA). A vacinação aumenta todos os componentes da resposta humoral e, como esperado, resulta em atividades de neutralização do soro contra variantes preocupantes que são comparáveis ou maiores do que a atividade de neutralização contra a cepa Wuhan Hu-1 original obtido pela vacinação de indivíduos virgens. O mecanismo subjacente a essas respostas de base ampla envolve mutação somática contínua de anticorpos, renovação clonal de células B de memória e desenvolvimento de anticorpos monoclonais que são excepcionalmente resistentes às mutações do RBD do SARS-CoV-2, incluindo aquelas encontradas em variantes preocupantes. Além disso, os clones de células B que expressam anticorpos amplos e potentes são seletivamente retidos no repertório ao longo do tempo e se expandem dramaticamente após a vacinação. Os dados sugerem que a imunidade em indivíduos convalescentes será muito duradoura e que indivíduos convalescentes que receberem vacinas de mRNA produzirão anticorpos e células B de memória que devem ser protetores contra variantes circulantes de SARS-CoV-2. Se as respostas de memória evoluírem de maneira semelhante em indivíduos vacinados, o reforço adicional em tempo apropriado com as vacinas disponíveis poderia abranger a maioria das variantes circulantes de preocupação (09/05/2021). Fonte: Biorxiv.
Durante a videoconferência do governador de Connecticut, em 24 de maio de 2021, o comissário de saúde Dr. Gifford, anunciou que “pelo menos dezoito adolescentes e jovens adultos mostraram sintomas de problemas cardíacos após receber a vacina COVID-19”. O Dr. Gifford explicou que todos, exceto um dos jovens hospitalizados por sinais de problemas cardíacos, foram liberados. "Um indivíduo ainda está hospitalizado, os outros 17 foram mandados para casa e estão bem." A partir de 13 de maio, indivíduos com 12 anos ou mais tornaram-se elegíveis para receber uma vacina COVID-19 (Pfizer, Moderna e Johnson & Johnson (Janssen)). Durante a reunião do Grupo de Trabalho Técnico de Segurança da Vacina COVID-19 (VaST) do CDC dos EUA em 17 de maio de 2021, formam incluídas várias apresentações sobre miocardite após a vacinação de mRNA do Departamento de Defesa, Sistema de Relatório de Eventos Adversos da Vacina e Vacina Datalink de segurança. O VaST concluiu que há relativamente poucos relatos de miocardite até o momento. Estes casos parecem ocorrer predominantemente em jovens, no sexo masculino, após a dose 2 em vez da dose 1 e, normalmente, 4 dias após a vacinação. O CDC declarou 'sistemas de monitoramento de segurança, taxas de notificações de miocardite na janela após a vacinação com COVID-19 não diferiram das taxas basais esperadas. No entanto, os membros do VaST acharam que as informações sobre relatórios de miocardite devem ser comunicadas aos provedores (17/05/2021). Fontes: VaST - CDC
26/05/2021
A Moderna anunciou que o estudo TeenCOVE em adolescentes de sua vacina contra a COVID-19 (mRNA-1273) atende ao endpoint primário e que tem planos para enviar dados para as agências reguladoras no início de junho. O estudo de fase 2/3 realizado pelos pesquisadores incluiu 3.723 participantes de 12 a 17 anos. Eles foram separados aleatoriamente em dois grupos diferentes e, seguindo a proporção 2:1, a cada dois jovens imunizados, um recebia o placebo. Para determinar se algum indivíduo foi ou não infectado pelo SARS-CoV-2, o trabalho se baseou em duas definições: a primária, da Moderna, que requer dois ou mais sintomas e um teste PCR positivo duas semanas depois da segunda dose de vacina, e a secundária, ligada ao Centro de Controle de Doenças dos Estados Unidos (CDC), que exige somente um sintoma da doença e um teste PCR positivo. Nenhum caso de COVID-19 foi observado nos participantes que receberam duas doses da vacina da Moderna, enquanto 4 pessoas do grupo placebo contraíram o vírus, portanto, o imunizante apresentou eficácia de 100% (segundo a definição primária) e 93% (segundo a definição secundária). Os eventos adversos foram de baixa ou média intensidade, sendo os principais sintomas dor no local da injeção (o mais comum), dor de cabeça, fadiga, mialgia e calafrios após a segunda dose (25/05/2021). Fonte: Moderna
O Ministério da Saúde brasileiro protocolou, em 24 de maio de 2021, nova solicitação de autorização para importar 20 milhões de doses da vacina Covaxin/ BBV152, fabricada na Índia, onde o imunizante tem autorização para uso emergencial. Após a negativa do pedido anterior, ocorrido por ocasião da Reunião Extraordinária Pública – RExtra 5/2021, realizada no dia 31/3/2021, quando a Diretoria Colegiada da Agência decidiu, por unanimidade, negar a autorização excepcional e temporária para importação e distribuição da referida vacina, o Ministério da Saúde e a empresa Precisa Medicamentos seguiram em tratativas com a Anvisa a fim de adequar os aspectos que motivaram o indeferimento. No que se refere ao cumprimento das Boas Práticas de Fabricação pela fabricante Bharat Biotech, um dos principais aspectos que motivou a decisão negativa anterior, a empresa protocolou novo pedido de certificação na Anvisa, referente à linha de produção do produto acabado. O pedido está sendo analisado de acordo com a Lei 14.124/21 e a RDC 476/21 (25/05/2021). Fonte: Anvisa
O objetivo deste estudo foi avaliar a eficácia da vacina (VE) de mRNA BNT162b2 contra a infecção por SARS-CoV-2. A VE para infecção documentada foi de 61,9% (IC 95% = 19,2–82,0%) 14–20 dias após a primeira dose, 87,9% (IC 95% = 51,7–97,0%) 21–27 dias após a primeira dose e 96,0 % (95% CI = 82,2–99,1) 7 ou mais dias após a segunda dose (19/05/2021). Fonte: The Journal of Infectious Diseases
Para investigar se a administração da vacina BNT162b2, anti-SARS-CoV-2, poderia ser priorizada com base no estado serológico, pesquisadores compararam as respostas de IgG 14 dias após a administração da primeira e da segunda dose em 12 convalescentes COVID-19 (definidos como tendo um esfregaço nasofaríngeo prévio positivo para RNA de SARS-CoV-2, seguido por um esfregaço negativo) e em 54 indivíduos naïve (que não tiveram contato com o vírus) pareados por idade e sexo. As respostas imunes foram medidas usando o imunoensaio quimioluminescente Liaison® para IgG S1 / S2 de SARS-CoV-2 no dia da vacinação (t0), 14 dias após a primeira dose (t1) e 14 dias após a segunda dose (t2). A Figura 1 mostra que convalescentes COVID-19 já são positivos para IgG quando a vacina é administrada e que 14 dias após a primeira dose eles mostram níveis absolutos de IgG anti-S1 / S2 mais elevados em comparação com vacinados que não tiveram contato com o vírus. Além disso, os níveis de IgG de COVID-19 convalescentes 14 dias após a primeira dose são muito semelhantes aos de vacinados naïve após a segunda dose. Apenas 2% dos vacinados naïve, mas 75% dos convalescentes COVID-19 apresentaram níveis de IgG superiores a 80 após a primeira dose da vacina. Os resultados sugerem que uma única dose de BNT162b2 pode ser suficiente para convalescentes atingirem níveis de IgG anti-S1 / S2 comparáveis aos alcançados em indivíduos naïve após o esquema regular de 2 doses. As doses salvas poderiam ser redirecionadas para a lista de espera, contribuindo para alcançar a imunidade coletiva mais rapidamente (28/04/2021). Fonte: Vaccine
Uma nova candidata à vacina contra a COVID-19, desenvolvida pelo Instituto Leloir, em Buenos Aires, desencadeou uma forte resposta imunológica contra o SARS-CoV-2 em estudos pré-clínicos em camundongos. O imunizante é resultado de uma colaboração entre o instituto argentino e a empresa de biotecnologia Vaxinz, dos Estados Unidos. Pesquisadores da EPM-Unifesp entraram na parceria para avaliar, entre outros pontos, a neutralização viral e a reação do imunizante a novas variantes. A Unifesp também vai coordenar os estudos no Brasil. A vacina gera uma potente resposta imunológica contra o vírus SARS-CoV-2 em 100% dos animais vacinados. A proteção é mantida por pelo menos cinco meses e todos os animais imunizados apresentaram altos níveis de resposta imune celular específica. A vacina usa a tecnologia de vetor viral (adenovírus humano Ad26), a mesma usada na vacina da Janssen/Johnson mas os desenvolvedores afirmam que há avanços na tecnologia e trata-se de uma vacina de 2ª geração. Os pesquisadores estão testando o imunizante nas variantes do Brasil, Reino Unido e África do Sul. As instituições pretendem iniciar as fases dois e três do estudo ainda no segundo semestre de 2021. Os testes serão feitos, a princípio, no Brasil e na Argentina (26/05/2021). Fonte: G1
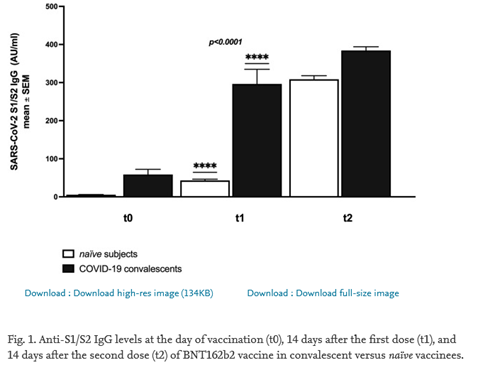
Estudo relata os dados de segurança e imunogenicidade provisórios do Dia 42 de um estudo cego, escalonado, randomizado e controlado de uma candidata a vacina de partícula semelhante a vírus produzida em plantas que exibe a glicoproteína S de SARS-CoV-2 (CoVLP: NCT04450004). Os resultados co-primários foram a tolerabilidade / segurança de curto prazo e imunogenicidade das formulações de CoVLP avaliadas por anticorpos neutralizantes (NAb) e respostas celulares. Os desfechos secundários neste estudo em andamento incluem avaliações de segurança e imunogenicidade até 12 meses após a vacinação. Adultos (18-55 anos, n = 180) foram randomizados para receber duas doses intramusculares de CoVLP (3,75 μg, 7,5 μg e 15 μg) com 21 dias de intervalo, sozinho ou com adjuvante AS03 ou CpG1018. Todas as formulações foram bem toleradas e os eventos adversos após a vacinação foram geralmente leves a moderados, transitórios e mais elevados nos grupos com adjuvante. Não houve efeito da dose CoVLP nos NAbs séricos, mas os títulos aumentaram significativamente com ambos os adjuvantes. Após a segunda dose, os NAbs nos grupos CoVLP + AS03 eram mais de dez vezes maiores do que os títulos em soros convalescentes do coronavirus 2019. As respostas celulares do interferon-γ e da interleucina-4 específicas da proteína spike (S) também foram induzidas (18/05/2021). Fonte: Nature
Estudo apresenta uma descrição detalhada da resposta imune, em camundongos, após vacinação com uma vacina de RNA autoamplificante (saRNA) e uma vacina de vetor adenoviral (ChAdOx1 nCoV-19 / AZD1222) contra SARS-CoV-2. Foi demonstrado que as respostas de anticorpos são maiores em regimes de vacinação heteróloga de duas doses do que em regimes de dose única. Os títulos de neutralização após o estímulo inicial heterólogo foram pelo menos comparáveis ou superiores aos títulos medidos após a vacinação do reforço inicial homólogo com vetores virais. É importante ressaltar que a resposta imune celular após um regime heterólogo é dominada por células T citotóxicas e células T CD4 Th1+, que é superior à resposta induzida em regimes de vacinação homólogos em camundongos. Esses resultados reforçam a necessidade de ensaios clínicos para investigar a imunogenicidade de regimes heterólogos com tecnologias alternativas de vacinas (17/05/2021). Fonte: Nature Communications
Estudo avaliou a eficácia de 2 vacinas inativadas contra SARS-CoV-2 para a prevenção do COVID-19 sintomático. Os achados do ensaio clínico randomizado incluiu 40.382 participantes que receberam pelo menos 1 dose de uma vacina inativada (de um total de 2 doses) desenvolvida a partir das cepas WIV04 (5 µg / dose) ou HB02 (4 µg / dose) de SARS-CoV-2 ou um controle apenas de hidróxido de alumínio, com um desfecho primário da incidência de COVID-19 sintomático pelo menos 14 dias após a segunda injeção. A eficácia para as 2 vacinas, em comparação com um controle apenas de hidróxido de alumínio, foi de 72,8% no grupo WIV04 e 78,1% no grupo HB02; ambas as comparações foram estatisticamente significativas, de modo que as duas vacinas SARS-CoV-2 inativadas demonstraram eficácia contra COVID-19 sintomático (26/05/2021). Fonte: JAMA
24/05/2021
Estudo mostra que duas doses de vacina Pfizer ou Astrazeneca são efetivas contra a variante indiana. Para determinar quem estava infectado com qual variante, os pesquisadores usaram dados de todos os casos de COVID-19 na Inglaterra em que havia um sequenciamento genético do coronavírus. A partir desses dados, estimaram a proporção de casos no país que eram causados pela B.1.617.2 em comparação com a linhagem predominante (B.1.1.7) por status de vacinação (com uma, duas ou nenhuma dose). Ao todo, um total de 12.675 casos sequenciados foram incluídos na análise, dos quais 11.621 tiveram a linhagem B.1.1.7 detectada; os outros 1.054 tiveram a linhagem B.1.617.2 detectada. Os números constatados são os de efetividade, ou seja: o impacto real da vacina na população. A efetividade mede o quanto a vacina consegue reduzir os casos de uma doença na vida real. A vacina da Pfizer/BioNTech teve uma efetividade de 88% contra casos sintomáticos de COVID-19 causados pela variante indiana (B.1.617.2) duas semanas após a segunda dose. Em relação à variante britânica (B.1.1.7), a efetividade foi um pouco maior: 93%. A vacina de Oxford/AstraZeneca teve 60% de efetividade contra casos sintomáticos de COVID-19 causados pela variante indiana (B.1.617.2) após a segunda dose. Em relação à variante britânica (B.1.1.7), a efetividade também foi um pouco maior: 66%. O estudo diz que níveis ainda mais altos de efetividade são esperados contra a hospitalização e morte por COVID. Hoje, os casos e períodos de acompanhamento não são suficientes para estimar a efetividade das vacinas contra casos graves pela variante B.1.617.2. Estudo também demonstra a necessidade de duas doses para maior proteção contra a doença (22/05/2021). Fonte: Press release GOV.UK
Artigo cita que as vacinas aprovadas no COVAX mostraram eficácia em ensaios randomizados; no entanto, não houve comparações diretas entre cada vacina. As vacinas COVID-19, aprovadas e em desenvolvimento, representam várias tecnologias novas e existentes, incluindo mRNA (Pfizer – BioNTech e Moderna), vetor viral (Oxford – AstraZeneca, Janssen, Cansino e Gamaleya), vírus inativos (Sinovac e Sinopharm), vírus atenuado (Codagenix) e vacinas de proteína (Novavax e Sanofi – GlaxoSmithKline). A maioria dos países tem ou terá acesso a mais de um tipo de vacina (15/05/2021). Fonte: The Lancet
Vacinas de subunidades baseadas em proteínas recombinantes contra SARS-CoV-2 foram relatadas usando o domínio de ligação ao receptor (RBD) e os trímeros da spike de pré-fusão (S-2P). A nova versão de trímeros de spike de pré-fusão, denominado HexaPro, demonstrou possuir dois RBD na conformação “para cima”, devido à sua propriedade física, em oposição a apenas um RBD exposto encontrado em S-2P. A proteína spike HexaPro oferece um candidato promissor para a vacina SARS-CoV-2. Os camundongos imunizados pelo HexaPro recombinante adjuvado com hidróxido de alumínio usando um regime de iniciação-reforço produziram anticorpos neutralizantes de alto título por até 56 dias após a imunização inicial contra infecção por SARS-CoV-2. Os resultados indicam que a vacina de subunidade HexaPro confere atividade de neutralização em soros coletados de camundongos recebendo o regime de iniciação-reforço (12/05/2021). Fonte: Vaccines
A estratégia de segunda dose atrasada foi ideal para eficácias da vacina acima de 80% e taxas de vacinação em ou abaixo de 0,3% da população por dia, tanto sob os pressupostos de vacinas esterilizantes e não esterilizantes, resultando em reduções de mortalidade cumulativa absoluta entre 26 e 47 por 100.000 individuos. A estratégia de segunda dose retardada para pessoas com menos de 65 anos teve um desempenho consistentemente bem abaixo de todas as taxas de vacinação testadas. Uma estratégia de vacinação com segunda dose retardada, pelo menos para pessoas com menos de 65 anos, pode resultar na redução da mortalidade cumulativa sob certas condições (12/05/2021). Fonte: The BMJ
Os participantes com 80 anos ou mais vacinados com BNT162b2 antes de 4 de janeiro de 2021 tinham uma chance maior de teste positivo para COVID-19 nos primeiros nove dias após a vacinação indicando que aqueles o alvo inicial tinha um risco subjacente de infecção mais alto. A eficácia da vacina foi, portanto, comparada com o período de referência pós-vacinação. Os efeitos da vacina foram observados 10 a 13 dias após a vacinação, atingindo uma eficácia da vacina de 70% e, em seguida, estabilizando. A partir de 14 dias após a segunda dose, foi encontrada uma eficácia da vacinação de 89% em comparação com o risco inicial aumentado. Os participantes com 70 anos ou mais vacinados a partir de 4 de janeiro com ChAdOx1-S tinham um risco subjacente semelhante de COVID-19 para indivíduos não vacinados. Com o BNT162b2, a eficácia da vacina atingiu 61% de 28 a 34 dias após a vacinação, então estabilizou. Com ChAdOx1-S, os efeitos foram observados de 14 a 20 dias após a vacinação, atingindo uma eficácia de 60% 28 a 34 dias, aumentando para 73% a partir do dia 35. Além da proteção contra doenças sintomáticas, outros 43% reduziram o risco de admissão hospitalar de emergência e 51% reduziram o risco de morte naqueles que receberam uma dose de BNT162b2. Os participantes que receberam uma dose de ChAdOx1-S tiveram mais 37% de redução no risco de internação hospitalar de emergência. O acompanhamento foi insuficiente para avaliar o efeito de ChAdOx1-S na mortalidade. Combinado com o efeito contra a doença sintomática, uma única dose de qualquer vacina foi cerca de 80% eficaz na prevenção da admissão hospitalar com COVID-19 e uma dose única de BNT162b2 foi 85% eficaz na prevenção de morte com COVID-19 (13/05/2021). Fonte: The BMJ
21/05/2021
As vacinas que induzem imunidade protetora contra SARS-CoV-2 e betaCoVs que circulam em animais têm o potencial de prevenir futuras pandemias de betaCoV. Pesquisadores mostram que a imunização de macacos com uma nanopartícula de domínio de ligação ao receptor multimérico (RBD) de SARS-CoV-2 com adjuvante 3M-052 / Alum induziu respostas de anticorpos de neutralização cruzada (nAb cruzado) contra batCoVs, SARS-CoV-1, SARS-CoV-2 e variantes B.1.1.7, P.1 e B.1.351 de SARS-CoV-2. A vacinação com nanopartículas resultou em um título ID50 de neutralização média geométrica recíproca de SARS-CoV-2 de 47.216, e proteção contra SARS-CoV-2 no trato respiratório superior e inferior de macacos. Os pesquisadores resaltam que o mRNA modificado com nucleosídeo que codifica um pico transmembranar estabilizado ou RBD monomérico também induziu SARS-CoV-1 e batCoV cross-nAbs, embora em títulos mais baixos. Esses resultados demonstram que as vacinas de mRNA atuais podem fornecer alguma proteção contra surtos zoonóticos de betaCoV e fornecer uma plataforma para o desenvolvimento de vacinas pan-betaCoV (10/05/2021). Fonte: Nature
Neste estudo, pesquisadores relatam a segurança e imunogenicidade de uma vacina de DNA (INO-4800) direcionada ao antígeno spike de comprimento total do SARS-CoV-2 quando administrada a adultos com alto risco de exposição. A vacina INO-4800 foi avaliada em 401 participantes randomizados em uma proporção de 3: 3: 1: 1 para receber INO-4800 (dose de 1 mg ou 2 mg) ou placebo (1 ou 2 injeções) por via intradérmica (ID) seguido de eletroporação (EP) usando CELLECTRA® 2000 nos dias 0 e 28 (NCT04642638). A maioria dos eventos adversos (EAs) foram de grau 1 e 2 e não pareceram aumentar em frequência com a segunda dose. O aumento médio geométrico (GMFR) dos níveis de anticorpos neutralizantes e de ligação foram significativamente maiores no grupo de dose de 2,0 mg versus o grupo de dose de 1,0 mg. As respostas imunes de células T medidas pelo ensaio ELISpot também foram maiores no grupo de dose de 2,0 mg em comparação com o grupo de dose de 1,0 mg. Os pesquisadores concluem que a vacina INO-4800, em ambas as doses de 1,0 mg e 2,0 mg, quando administrada em um regime de 2 doses, mostrou-se segura e bem tolerada em todas as idades adultas. No entanto, a análise comparativa de imunogenicidade favoreceu a seleção da dose de 2,0 mg de INO-4800 para o avanço para uma avaliação de eficácia de Fase 3 (07/05/2021). Fonte: medRxiv
Mulheres grávidas apresentam risco aumentado de morbidade e mortalidade devido à COVID-19, mas foram excluídas dos ensaios de fase 3 da vacina COVID-19. Os dados sobre a segurança da vacina e imunogenicidade nessas populações são, portanto, limitados. Este estudo avaliou a imunogenicidade de vacinas de RNA mensageiro (mRNA) COVID-19 em mulheres grávidas e lactantes, inclusive contra variantes emergentes de SARS-CoV-2. Foi realizado um estudo exploratório, descritivo e prospectivo de coorte que envolveu 103 mulheres que receberam uma vacina COVID-19 de dezembro de 2020 a março de 2021 e 28 mulheres que confirmaram a infecção por SARS-CoV-2 de abril de 2020 a março de 2021. Este estudo envolveu 30 grávidas, 16 lactantes e 57 mulheres não grávidas ou lactantes que receberam as vacinas mRNA-1273 (Moderna) ou BNT162b2 (Pfizer-BioNTech) COVID-19 e 22 mulheres grávidas e 6 não grávidas com SARS-CoV-2 não vacinadas. Após a segunda dose da vacina, foi relatada febre em 4 mulheres grávidas (14%), 7 mulheres lactantes (44%) e 27 mulheres não grávidas (52%). Respostas de anticorpos neutralizantes e funcionais e de não-neutralizantes, bem como respostas de células T CD4 e CD8, estavam presentes em mulheres grávidas, lactantes e não grávidas após a vacinação. Anticorpos ligantes e neutralizantes também foram observados no sangue do cordão umbilical e no leite materno. Os títulos de anticorpos de ligação e neutralização contra as variantes de preocupação B.1.1.7 e B.1.351 de SARS-CoV-2 foram reduzidos, mas as respostas das células T foram preservadas contra as variantes virais. Nesta análise exploratória de uma amostra de conveniência, o recebimento de uma vacina de mRNA COVID-19 foi imunogênica em mulheres grávidas, e os anticorpos desencadeados pela vacina foram transportados para o sangue do cordão umbilical e o leite materno. Mulheres grávidas e não grávidas que foram vacinadas desenvolveram respostas de anticorpos de reação cruzada e respostas de células T contra as variantes do SARS-CoV-2 (13/05/2021). Fonte: JAMA
Um estudo realizado por pesquisadores brasileiros aponta que a vacina CoronaVac foi 42% efetiva "no cenário de mundo real" contra a COVID-19, considerando apenas pessoas vacinadas com mais de 70 anos e em um período de extensa transmissão da variante P.1., detectada inicialmente em Manaus. Além disso, o estudo concluiu que a proteção contra a doença só se torna efetiva 14 dias após a aplicação da segunda dose e que a imunidade adquirida diminui conforme aumenta a idade do grupo imunizado. Considerando os dados 14 dias após a 2ª dose, a efetividade foi de: 61,8% de efetividade (70-74 anos); 48,9% (75-79 anos) e 28,0% (80 anos ou mais). Os estudo contou com a participação de 7.950 pessoas com uma idade média de 76 anos. Segundo os pesquisadores, parte dos resultados já era esperada porque, em geral, a resposta dos idosos à vacinação é menor do que entre os mais jovens. Os achados ressaltam a necessidade de manter intervenções não farmacêuticas (máscaras, distanciamento social e higiene das mãos) enquanto a vacinação em massa com CoronaVac é usada como parte de uma resposta epidêmica (21/05/2021). Fonte: medRxiv
19/05/2021
Entre as vacinas administradas a crianças estão as que visam o rotavírus, um vírus de RNA de fita dupla segmentado que representa uma das principais causas de gastroenterite grave. Para explorar a viabilidade de estabelecer uma vacina combinada de rotavírus-SARS-CoV-2, gerou-se rotavírus SA11 recombinantes (r) com RNAs de segmento 7 modificados que continham cassetes de codificação para NSP3, um sinal de parada-reinício 2A translacional e um sinal FLAG marcado porção da proteína spike (S) do SARS-CoV-2: fragmento S1, domínio N-terminal (NTD), domínio de ligação ao receptor (RBD), RBD estendido (ExRBD) ou domínio de núcleo S2 (CR). A geração de rSA11 contendo a sequência de codificação S1 exigiu uma inserção de sequência de 2,2 kbp, a maior dessas inserções já introduzida no genoma do rotavírus. A imunotransferência mostrou que os vírus rSA11 contendo as sequências codificantes menores de NTD, RBD, ExRBD e CR expressaram produtos de proteína S de tamanho esperado, com ExRBD expresso nos níveis mais elevados. Esses vírus rSA11 eram geneticamente estáveis durante a passagem em série. Em contraste, o vírus rSA11 contendo a sequência de codificação S de comprimento total (rSA11 / NSP3-fS1) não conseguiu expressar seu produto fS1 de 80 kDa esperado, por razões inexplicáveis. Além disso, rSA11 / NSP3-fS1 era geneticamente instável, com variantes sem a inserção S1 aparecendo durante a passagem em série. Os resultados enfatizam a utilidade potencial das vacinas de rotavírus como vetores de expressão de porções imunogênicas da proteína SARS-CoV-2 S, incluindo NTD, RBD, ExRBD e CR, que têm tamanhos menores do que o fragmento S1 (03/05/2021). Fonte: Vaccines

O estudo revisou e fez uma meta-análise sistemática das características clínicas das vacinas em ensaios clínicos para fornecer uma estimativa melhor de sua eficácia, efeitos colaterais e imunogenicidade. As publicações relevantes foram sistematicamente pesquisadas e coletadas dos principais bancos de dados até 12 de março de 2021. Um total de 25 RCTs (123 conjuntos de dados), 58.889 casos que receberam a vacina COVID-19 e 46.638 controles que receberam placebo foram incluídos na meta-análise. No total, as vacinas COVID-19 baseadas em mRNA e vetoriais de adenovírus tiveram 94,6% e 80,2% de eficácia em ensaios clínicos randomizados de fase II / III, respectivamente. A eficácia da vacina vetorizada por adenovírus após a primeira dose foi de 97,6% e após a segunda dose foi de 98,2% e, após 3 semanas de injeções, 95% foi a mais alta contra o antígeno do domínio de ligação ao receptor (RBD). As vacinas baseadas em mRNA tiveram o nível mais alto de efeitos colaterais relatados, exceto diarréia e artralgia. As vacinas com adjuvante de alumínio tiveram os menores efeitos colaterais sistêmicos e locais entre o adjuvante das vacinas ou sem adjuvante, exceto para vermelhidão no local da injeção. As vacinas com vetor de adenovírus e baseadas em mRNA para COVID-19 mostraram a maior eficácia após a primeira e segunda doses, respectivamente. As vacinas baseadas em mRNA tiveram maiores efeitos colaterais. Poucos experimentaram efeitos adversos extremos e todos estimularam respostas imunológicas robustas (06/05/2021). Fonte: Vaccines

Artigo busca descrever o curso das reações cutâneas localizadas no local da injeção da vacina Moderna COVID-19, reações subsequentes à segunda dose da vacina. Este estudo retrospectivo de série de casos foi realizado no Yale New Haven Hospital, um centro médico terciário em New Haven, Connecticut, com 16 pacientes encaminhados com reações cutâneas localizadas no local da injeção de 20 de janeiro a 12 de fevereiro de 2021. As reações cutâneas localizadas tardias desenvolveram-se em uma variação de 7 (2-12) dias após a administração da vacina Moderna COVID-19. Essas reações ocorreram no local da injeção ou próximo a ela e foram descritas como placas rosa pruriginosas, dolorosas e edematosas (12/05/2021). Fonte: Jama
Revisão discute as possíveis abordagens pelas quais o repertório de memória específico da influenza desenvolvido durante a vida das populações idosas pode convergir para montar uma resposta imune eficaz contra a proteína spike de SARS-CoV-2 com a possibilidade de desenvolver vacinas únicas para COVID-19 e gripe (12/05/2021). Fonte: International Reviews Immunology
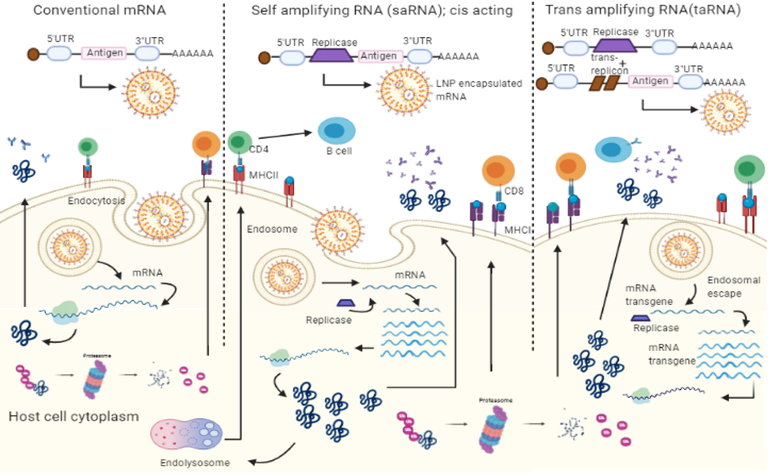
Artigo faz uma análise preliminar da rede de patentes de vacinas COVID-19 baseadas em mRNA e destaca o complexo cenário de propriedade intelectual por trás destas vacinas, demonstrando que apesar dessas conquistas científicas impressionantes, barreiras como a cadeia de frio da vacina e múltiplas formas de proteção de propriedade intelectual impedem o acesso equitativo e a alocação justa. Esta plataforma de tecnologia de vacina usa tecnologia de mRNA, tecnologia de nanopartículas de lipídios e tecnologia de sistema de entrega para alcançar uma resposta biológica desejada. Essa complexa matriz de patentes, licenças e acordos entre diferentes entidades destaca os meandros envolvidos no desenvolvimento biofarmacêutico. Artigo apresenta o cenário de patentes para as respectivas entidades. Patentes e pedidos de patentes que são relevantes para a respectiva plataforma de tecnologia de vacinas e pertencentes ou atribuídas a qualquer uma das entidades discutidas foram identificados e destacados (12/05/2021). Fonte: Nature Biotecnology

Estudo examinou a segurança e imunogenicidade da vacina SARS-CoV-2 inativada da Chinese Academy of Medicine Sciences. Em um ensaio clínico de fase I (CTR20200943 e NCT04412538), randomizado, duplo-cego e controlado por placebo envolvendo 192 adultos saudáveis 18–59 anos, duas injeções de três doses (50 EU, 100 EU, 150 EU) de uma vacina SARS-CoV-2 inativada ou placebo foram administrados por via intramuscular em um intervalo de 2 ou 4 semanas. A vacinação foi concluída em 191 indivíduos. Quarenta e quatro reações adversas ocorreram em 28 dias, mais comumente dor leve e vermelhidão no local da injeção ou leve fadiga. Nos dias 14 e 28, as taxas de seroconversão foram 87,5% e 79,2% (50 EU), 100% e 95,8% (100 EU) e 95,8% e 87,5% (150 EU), respectivamente, com títulos médios geométricos (GMTs) de 18,1 e 10,6, 54,5 e 15,4, e 37,1 e 18,5, respectivamente, para os intervalos de 2 e 4 semanas. A seroconversão foi associada com a suprarregulação síncrona de anticorpos contra a proteína S, proteína N e vírion e uma resposta de linfócitos T citotóxicos (CTL). Não foram observadas citocinas nem células imunes relacionadas à imunopatologia. A análise do transcriptoma revelou a diversidade genética das respostas imunológicas induzidas pela vacina. Os pesquisadores concluem que, em uma população de 18 a 59 anos, esta vacina inativada SARS-CoV-2 foi segura e imunogênica (12/05/2021). Fonte: Vaccine

A Anvisa recebeu, na noite do dia 18/5/2021, o pedido de autorização temporária para uso emergencial, em caráter experimental, da vacina Convidecia, contra a COVID-19. O pedido foi feito pela empresa Belcher Farmacêutica, representante do laboratório chinês CanSino Biologics no Brasil. A análise da documentação já foi iniciada. No momento, está sendo feita a triagem para verificar se todas as informações para a avaliação da Agência foram devidamente apresentadas. Os prazos para a decisão da Anvisa em relação ao pedido da CanSino foram regulamentados pela Lei 14.124, de 10 de março de 2021. A Agência deve se manifestar em até sete dias úteis, caso todos os requisitos legais tenham sido cumpridos pela empresa solicitante (19/05/2021). Fonte: Anvisa
Pesquisadores mostram que identificar quantidade ideal de anticorpos para uma proteção mais robusta pode agilizar testes clínicos. Eles analisaram a relação entre os níveis de neutralização in vitro e a proteção observada contra a infecção por SARS-CoV-2 usando dados de sete vacinas atuais e de coortes de convalescença. Estimaram o nível de neutralização para 50% de proteção contra infecção detectável de SARS-CoV-2 em 20,2% do nível médio de convalescença. O nível de neutralização estimado necessário para proteção de 50% contra infecção grave foi significativamente menor (3% do nível médio de convalescença). A modelagem da queda do título de neutralização ao longo dos primeiros 250 dias após a imunização prediz que ocorrerá uma perda significativa na proteção contra a infecção por SARS-CoV-2, embora a proteção contra doenças graves deva ser mantida em grande parte. Os títulos de neutralização contra algumas variantes do SARS-CoV-2 preocupantes são reduzidos em comparação com a cepa da vacina, e o modelo prevê a relação entre a neutralização e a eficácia contra as variantes virais. Neste estudo, os pesquisadores mostraram que o nível de neutralização é altamente preditivo de proteção imunológica e forneceram um modelo baseado em evidências de proteção imunológica contra SARS-CoV-2 que ajudará no desenvolvimento de estratégias de vacina para controlar a trajetória futura da pandemia (17/05/2021). Fonte: Nature Medicine
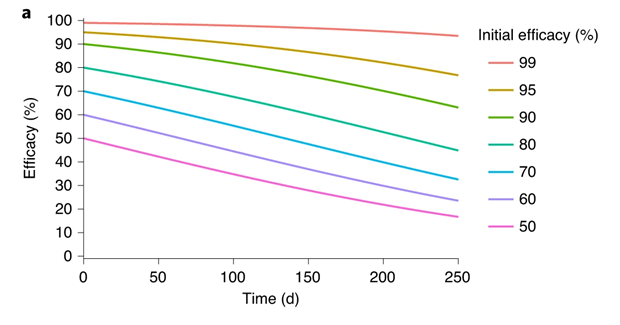
Estudo avaliou a segurança, tolerabilidade e imunogenicidade da vacina CoronaVac, contendo SARS-CoV-2 inativado, em crianças e adolescentes de 3-17 anos de idade. Foi realizado um ensaio clínico de fase 1/2, randomizado, duplo-cego e controlado por placebo em crianças e adolescentes saudáveis de 3 a 17 anos de idade em Zanhuang (Hebei, China). A vacina (em 0,5 ml de hidróxido de alumínio adjuvante) ou placebo (apenas adjuvante) foi administrada por injeção intramuscular em duas doses (dia 0 e dia 28). Conduziu-se o ensaio de fase 1 em 71 participantes com aumento da dose em dois blocos (1,5 ug ou 3 ug por injeção). Dentro de cada bloco, os participantes foram designados aleatoriamente (3:1) usando a randomização do bloco para receber CoronaVac ou placebo. Na fase 2, os participantes foram designados aleatoriamente (2: 2: 1) usando a randomização em bloco para receber CoronaVac a 1,5 mg ou 3 mg por dose, ou placebo. Este estudo está em andamento e está registrado com ClinicalTrials.gov (NCT04551547). Entre 31 de outubro e 2 de dezembro de 2020, 72 participantes foram inscritos na fase 1, e entre 12 de dezembro e 30 de dezembro de 2020, 480 participantes foram inscritos na fase 2. 500 participantes receberam pelo menos uma dose de vacina ou placebo (n = 71 para a fase 1 e n = 479 para a fase 2). No perfil de segurança combinado de fase 1 e fase 2, reações adversas dentro de 28 dias após a injeção ocorreram em 56 (26%) de 219 participantes no grupo de 1,5 mg, 63 (29%) de 217 no grupo de 3mg e 27 (24%) de 114 no grupo placebo, sem diferença significativa. A maioria das reações adversas foi branda a moderada, sendo que dor no local da injeção foi a reação mais reportada (13%). Na fase 1, a seroconversão após a segunda dose foi observada em 27 de 27 participantes nos grupos de 1,5mg e 26 de 26 participantes no grupo 3 mg. Na fase 2, a seroconversão foi observada em 180 de 186 participantes (96,8%) no grupo de 1,5 mg e 180 de 180 participantes (100,0%) no grupo 3ug. Não houve respostas de anticorpos detectáveis nos grupos de placebo. O estudo concluiu que a vacina CoronaVac foi bem tolerada e induziu fortes respostas de anticorpos neutralizantes em crianças e adolescentes com idades entre 3-17 anos. O estudo forneceu dados sólidos de segurança e imunogenicidade para apoiar o estudo posterior e o uso de CoronaVac em crianças e adolescentes (06/04/2021). Fonte: SSRN (Preprints The Lancet)
17/05/2021
As farmacêuticas Sanofi e GSK anunciaram os resultados positivos do ensaio clínico de Fase 2 da vacina contra a COVID-19 que desenvolveram. Segundo as empresas, a fórmula desencadeou uma significativa produção de anticorpos contra o coronavírus SARS-CoV-2 em todas as idades testadas. Ainda sem publicar os estudos em uma revista científica, as farmacêuticas adiantaram que a vacina contra a COVID-19 induziu fortes taxas de anticorpos neutralizantes em todos os grupos testados com uma única dose. No entanto, a concentração de anticorpos foi maior em pessoas de 18 a 59 anos. Além disso, os pesquisadores citaram que não foram identificadas preocupações de segurança ou de tolerabilidade do imunizante (17/05/2021). Fonte: Sanofi
Especialistas em saúde pública dos EUA devem se reunir para decidir como usar a vacina Pfizer BioNTech em adolescentes depois que a Food and Drug Administration (FDA) concedeu autorização de uso de emergência (EUA) para crianças de 12 a 15 anos. A vacina Pfizer BioNTech, assim como a da Moderna, já tem EUA para administração em maiores de 16 anos. Tanto a Moderna quanto a Johnson & Johnson, que fazem as outras duas vacinas aprovadas nos EUA, estão testando suas vacinas em crianças. Cerca de 1,5 milhão de jovens de 11 a 17 anos tiveram COVID-19 no ano passado e 300 pessoas menores de 18 anos morreram, de acordo com os Centros de Controle e Prevenção de Doenças. Embora os adolescentes geralmente tenham uma doença mais branda do que os adultos, eles podem espalhar a infecção. Cerca de 2.260 crianças foram inscritas em um ensaio clínico randomizado e controlado por placebo nos Estados Unidos, disse o FDA. Os efeitos colaterais foram semelhantes aos observados em adultos - dor no local da injeção, cansaço, dor de cabeça, calafrios, dores musculares, febre e dores nas articulações. A resposta imunológica deles foi pelo menos tão boa quanto a dos participantes com idade entre 16 e 25 anos (11/05/2021). Fonte: BMJ
Assim que as vacinas e terapias entraram na clínica, as variantes virais começaram a se acumular, o que levantou questões importantes sobre o que pode estar por vir enquanto o sistema imunológico luta contra esse inimigo em evolução. Em contraste com a rápida evolução de outros vírus de RNA, o SARS-CoV-2 tem baixa variabilidade genômica devido à sua função de revisão. Portanto, para tentar controlar a pandemia, os pesquisadores correram para fazer vacinas e anticorpos monoclonais (mAbs) adaptados à sequência viral inicialmente identificada em Wuhan, China. Vacinas e mAbs desenvolvidos para combater o SARS-CoV-2 têm como alvo a proteína spike, que dá ao vírus sua silhueta em forma de coroa (‘corona’). A proteína spike liga-se ao receptor ECA2 nas células humanas no início da infecção. Existem dois "supersítios" antigênicos distintos na proteína spike - o domínio de ligação ao receptor (RBD) e o domínio N-terminal (NTD) - que são o alvo da maioria dos anticorpos neutralizantes. Os anticorpos direcionados contra o RBD são responsáveis por 90% da atividade neutralizante encontrada no soro de pacientes convalescentes que se recuperaram de COVID-19, e os anticorpos direcionados contra o RBD são 10 a 100 vezes mais potentes do que os anticorpos que reconhecem o NTD (10/05/2021). Fonte: Nature
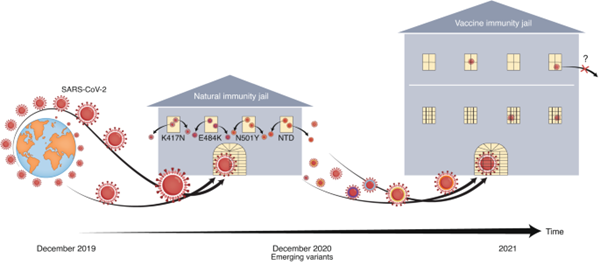
A maioria das vacinas contra o SARS-CoV-2 em uso ou em desenvolvimento avançado é baseada na proteína spike viral (S) como seu imunógeno. A proteína S está presente em vírions como trímeros de pré-fusão em que o domínio de ligação ao receptor (RBD) é estocasticamente aberto ou fechado. Neste estudo, pesquisadores avaliaram os resultados da imunização em um modelo de camundongo usando um trímero de proteína S estabilizado no estado fechado para evitar a exposição total do local de ligação do receptor e, portanto, a interação com o receptor. Comparou-se esta com outras construções de proteína S modificadas, incluindo representantes usados nas vacinas atuais. Observaram que todas as proteínas S triméricas induziram uma resposta de células T e respostas de anticorpos de longa duração e fortemente neutralizantes contra o SARS-CoV-2 e variantes de interesse B.1.248 e B.1.351. Notavelmente, as propriedades de ligação a proteínas de soros induzidas pela proteína S fechada diferiram daquelas induzidas por construções de proteína S padrão. As proteínas S fechadas induziram respostas neutralizantes mais potentes do que o esperado, com base no grau em que inibem as interações entre o RBD e a ECA2. Estas observações sugerem que as proteínas S fechadas recrutam respostas imunológicas diferentes, mas igualmente potentes, do que as abertas, e que isso provavelmente inclui anticorpos neutralizantes contra epítopos conformacionais presentes na conformação fechada. Junto com sua estabilidade aprimorada e propriedades de armazenamento, em conclusão, os pesquisadores sugerem que as proteínas S fechadas podem ser um componente valioso de vacinas refinadas de próxima geração (07/05/2021). Fonte: Journal of Virology
As vacinas contra SARS-CoV-2 para administração intramuscular destinadas a produzir respostas imunes humorais e mediadas por células, prevenindo a viremia e a síndrome COVID-19, têm um alto grau de eficácia em humanos (70-95%) dependendo do tipo de vacina. No entanto, pouca proteção é fornecida contra a replicação viral e disseminação nas vias aéreas superiores devido à falta de uma resposta imune local sIgA, indicando um risco de transmissão do vírus de indivíduos vacinados. Uma série de novas vacinas nasais COVID-19 estão em desenvolvimento e os resultados pré-clínicos em primatas não humanos mostraram uma prevenção promissora de replicação e eliminação de vírus devido à indução da resposta imune da mucosa (sIgA) nas vias respiratórias superiores e inferiores também como respostas imunes sistêmicas e humorais robustas. Um primer IM seguido por uma vacinação de reforço IN provavelmente resultaria em uma resposta imunológica mais completa, incluindo prevenção (ou forte redução) na replicação viral nas vias respiratórias superiores e inferiores. Este artigo apresenta um resumo dos principais estudos de vacinas, destacando a utilidade e importância da pesquisa de vacinas nasais (06/05/2021). Fonte: International Journal of Pharmaceutics
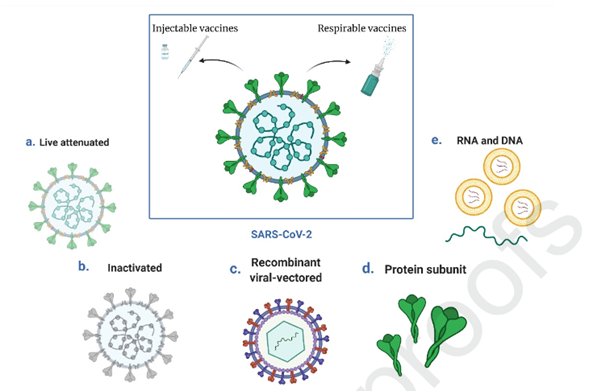
Este artigo de revisão examina as vacinas contra COVID-19 e o esforço de pesquisa relacionado, tanto tradicional quanto futuro, para ilustrar as vantagens e desvantagens de suas tecnologias, para denotar o uso de adjuvantes e sistemas de entrega em sua aplicação, e para fornecer uma perspectiva sobre sua direção futura. O estudo também analisou 114 patentes relacionadas a vacinas de COVID-19 no conteúdo CAS até final de fevereiro de 2021. A maioria dessas patentes (92) foram depositadas por organizações na China e apenas despositadas no Escritório de Patentes chinês. Havia 10 e 6 patentes de organizações na Rússia e nos Estados Unidos, respectivamente. Os demais incluem Índia (3), Cingapura (1), Coreia do Sul (1) e Estônia (1). Os autores afirmam que a previsão de que mais patentes nesta área estarão disponíveis no futuro (29/03/2021). Fonte: ACS Central Science
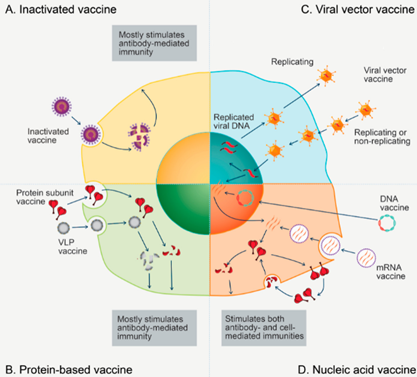
14/05/2021
O estudo Com-COV compara os esquemas de dosagem mista de vacinas Pfizer / Oxford-AstraZeneca e mostra aumento na frequência de sintomas leves a moderados naqueles que recebem esquema de dosagem mista. As reações adversas foram de curta duração, sem outras preocupações de segurança. O impacto de esquemas mistos na imunogenicidade ainda é desconhecido (12/05/2021). Fonte: The Lancet e University Oxford
A Anvisa aprovou os testes de fase 3 da vacina indiana Covaxin (BBV152) contra a COVID-19. A vacina será testada em 4,5 mil pessoas no país, nos estados de São Paulo (3 mil voluntários), Rio de Janeiro, Bahia e Mato Grosso (500 voluntários cada). De acordo com a Anvisa, a solicitação do estudo foi feita pela empresa Precisa Farmacêutica, parceira brasileira da fabricante da vacina – a empresa de biotecnologia Bharat Biotech. Os voluntários deverão ter, no mínimo, 18 anos de idade. A vacina será aplicada em duas doses, com intervalo de 28 dias. A Covaxin apresentou eficácia geral de 78% nos casos sintomáticos e de 100% em casos graves, segundo dados divulgados pela Bharat Biotech e pelo Conselho de Pesquisa Médica da Índia (ICMR). Os dados fazem parte da segunda análise provisória de testes clínicos de fase 3. A primeira análise provisória foi feita em março deste ano e apresentou eficácia de 81%. Os resultados de segurança e eficácia da análise final estarão disponíveis em junho (13/05/2021). Fonte: G1
Estudo sugere que adiamento da segunda dose da vacina Pfizer – BioNTech para COVID-19 poderia aumentar as respostas de anticorpos em pessoas com mais de 80 anos. Os pesquisadores analisaram 175 indivíduos com mais de 80 anos, alguns dos quais estavam sujeitos à controversa decisão do Reino Unido no final de 2020 de aumentar a lacuna entre doses de 11–12 semanas para dar a mais pessoas proteção parcial de uma dose de vacina. Os níveis máximos de anticorpos foram 3,5 vezes mais elevados nas pessoas que esperaram 12 semanas pela dose de reforço do que nas pessoas que esperaram apenas 3 semanas. Os resultados são tranquilizadores, mas são específicos para a vacina Pfizer, e a sabedoria de adiar a segunda dose depende de quais variantes podem estar circulando (13/05/2021). Fonte: Nature
20 funcionários de uma instituição de assistência social foram voluntários para do estudo sobre o nível de imunidade contra o SARS-COV-2 após a segunda dose da vacina de mRNA da Pfizer-BioNTech. Os voluntários foram examinados quanto à presença de anticorpos contra peptídeos de SARS-COV-2 e alguns de MERS-CoV, SARS-CoV1, HCov229E e HCoVNL63. A avaliação clínica revelou que seis pessoas tiveram COVID-19 no passado. Verificou-se ainda que: (i) Seis pessoas afirmaram a presença de efeitos indesejáveis da vacinação, que foram mais frequentes naqueles com história de COVID-19; (ii) Todos os indivíduos, independentemente da história pregressa de COVID-19, responderam igualmente bem em IgG, mas aqueles que tiveram a doença tenderam a se sair melhor na classe de IgA; (iii) Todos aqueles que tiveram a doença tinham anticorpos IgG contra antígenos do nucleocapsídeo, mas também 5 de 14 que não tiveram a doença; (iv) Os anticorpos anti S2 estavam presentes nos pacientes com COVID-19 no passado, mas também foram encontrados naqueles que não tinham a doença; (v) Todas as pessoas vacinadas foram altamente positivas no IGRA e o nível de IFN gama liberado foi correlacionado com o número de linfócitos HLADR positivos no sangue. Os pesquisadores concluíram que a resposta à vacina de mRNA da glicoproteína S de SARS-COV-2 foi inequivocamente positiva em todos os indivíduos com um nível elevado de anticorpos IgG RBD e geração abundante de IFN gama em resposta aos peptidos S1. Os indivíduos com história pregressa positiva de COVID-19 responderam bem na classe IgA e frequntemente apresentaram anticorpos N e S2. Portanto, a presença de anticorpos N e S2 pode indicar exposição prévia ao SARS-CoV2 (11/05/2021). Fonte: Vaccines
Pesquisadores da Universidade do Alabama em Birmingham relatam evidências pré-clínicas da potência de um candidato à vacina COVID-19 de dose única - AdCOVID – na forma de spray nasal, que foi criado pela Altimmune Inc. O AdCOVID está atualmente em um teste clínico fase 1 para testar a segurança e a imunogenicidade nas pessoas, e a Altimmune espera relatar dados mais robustos em junho. No presente estudo, camundongos K18-hACE2 transgênicos, que são altamente permissivos para a replicação SARS-CoV-2, foram vacinados com uma única dose intranasal de AdCOVID e desafiados um mês depois com o vírus SARS-CoV-2 vivo. Quando os camundongos foram avaliados para o vírus infeccioso SARS-CoV-2, nenhum vírus infeccioso pôde ser detectado nos pulmões de camundongos vacinados, representando uma redução superior a 1 milhão de vezes do vírus infeccioso em comparação com os controles não vacinados. A demonstração de imunidade esterilizadora é consistente com a estimulação da imunidade local e sistêmica pelo AdCOVID, incluindo altos títulos de anticorpo neutralizante no soro, respostas de células T e, talvez o mais importante, IgA mucosal no trato respiratório (11/05/2021). Fonte: MedicalXpress.
Pesquisadores da farmacêutica Moderna apresentam a avaliação preliminar de um estudo clínico sobre o uso do protótipo de mRNA-1273 ou vacinas de mRNA de COVID-19 modificadas, destinadas a variantes emergentes de SARS-CoV-2 como vacinas de reforço em participantes previamente vacinados cerca de 6 meses antes com duas doses da vacina protótipo, mRNA-1273. As vacinas modificadas incluem um mRNA-1273.351 monovalente que codifica para a proteína S encontrada na variante B.1.351 e mRNA-1273.211 multivalente compreendendo uma mistura 1:1 de mRNA-1273 e mRNA-1273.351. Como vacinações de reforço únicas de 50 µg, tanto o mRNA-1273 quanto o mRNA-1273.351 tinham perfis de segurança aceitáveis e eram imunogênicos. Os títulos de neutralização de anticorpos contra variantes B.1.351 e P.1 medidos por ensaios de neutralização de pseudovírus SARS-CoV-2 (PsVN) antes das vacinações de reforço, aproximadamente 6 a 8 meses após a série primária, eram baixos ou abaixo do limite de quantificação do ensaio, embora os títulos médios geométricos em relação à cepa do tipo selvagem tenham permanecido acima dos níveis provavelmente protetores. Duas semanas após as vacinações de reforço, os títulos contra a cepa original de tipo selvagem e variantes B.1.351 e P.1 aumentaram para níveis semelhantes ou superiores aos títulos de pico após as vacinações da série primária. Embora tanto o mRNA-1273 quanto o mRNA-1273.351 aumentassem a neutralização da cepa original de tipo selvagem e as variantes B.1.351 e P.1, o mRNA-1273.351 parecia ser mais eficaz no aumento da neutralização do vírus B.1.351 versus um reforço com mRNA-1273. O ensaio da vacina está em andamento e o reforço dos participantes do ensaio clínico com o mRNA multivalente-1273.211 está atualmente sendo avaliado (06/05/2021). Fonte: MedRxiv
Neste estudo, pesquisadores geraram o vírus Vaccinia recombinante expressando a proteína spike de comprimento total de SARS-CoV-2 (VacV-S) para avaliar a resposta imune celular e humoral montada contra este antígeno viral em camundongos. As células T CD8 + e CD4 + específicas para a proteína spike de SARS-CoV-2 sofreram expansão e contração robustas e persistiram por pelo menos 40 dias após uma única imunização com VacV-S. A vacinação também causou o rápido surgimento de anticorpos neutralizantes de IgG específicos da spike. Curiosamente, ambas as respostas imunes celular e humoral direcionaram fortemente o domínio S1 de spike após a imunização com VacV-S. No geral, esses achados demonstram que uma abordagem de imunização usando VacV ou versões atenuadas de VacV expressando a proteína spike de SARS-CoV-2 selvagem de comprimento total pode ser usada para o desenvolvimento de vacina adicional para prevenir a disseminação da COVID-19 (10/05/2021). Fonte: The Journal of Immunology
12/05/2021
Estudo teve como objetivo calcular a taxa de soroconversão da vacina CoronaVac em profissionais de saúde (PS) 40 dias após a administração. Amostras de soro de 133 profissionais de saúde do sul do Brasil foram coletadas um dia antes (dia 0) e 10, 20 e 40 dias após a administração da primeira dose da vacina. A imunoglobulina G (IgG) foi quantificada usando imunoensaios para anticorpos anti-proteína N (Abbott, Sligo, Irlanda) e para anticorpos anti-proteína S1. A soroconversão no dia 40 (20 dias após a segunda dose) ocorreu em 129 (97%) PS para a proteína S1 e em 69 (87%) PS para a proteína N. Ausência de anticorpos IgG (por ambas as metodologias), ocorreu em dois (1,5%) PS em administração semestral de rituximabe, e também em outros dois (1,5%) PS sem motivo aparente. Estudo mostrou que CoronaVac tem uma alta taxa de soroconversão quando avaliado em uma população de profissionais de saúde (30/04/2021). Fonte: The Lancet preprint
Um estudo conduzido pelo Ministério da Saúde da Indonésia concluiu que a CoronaVac, vacina contra a COVID-19 desenvolvida pelo laboratório chinês Sinovac, foi 98% eficaz na prevenção da morte e 96% na prevenção da hospitalização entre um grupo de profissionais da saúde. O estudo preliminar analisou dados de 128.290 profissionais de saúde que receberam a vacina entre janeiro e março deste ano, em Jacarta, capital do país. Para obter a efetividade estimada, a pesquisa comparou pessoas vacinadas com pessoas não vacinadas. A idade média dos participantes é 31 anos. O estudo descobriu ainda que o imunizante também previne a infecção sintomática em 94% do grupo (12/05/2021). Fonte: G1
Estudo avaliou as concentrações de anticorpos SARS-CoV-2 em pacientes positivos para SARS-CoV-2 (N = 272) e indivíduos vacinados com a vacina BNT162b2 m-RNA COVID-19 (N=1.256). Para cada participante, os dados sociodemográficos, os registros de vacinação COVID-19, as análises sorológicas e o status de infecção do SARS-CoV-2 foram coletados. Foram detectados anticorpos IgM e IgG contra antígenos S1 / S2 de SARS-CoV-2. 99,8% dos indivíduos vacinados mostraram uma soropositividade para anti-SARS-COV-2 IgG e mais de 80% dos indivíduos vacinados tinham concentrações de IgG> 200 UA / mL. Indivíduos com SARS-CoV-2 tinham concentrações de IgG <100 UA / mL e essas concentrações foram significativamente mais baixas do que em indivíduos vacinados (p <0,01). A diferença observada foi confirmada por análises multivariadas, sugerindo que a vacinação confere maiores concentrações de IgG do que a infecção natural. Dos resultados a imunização está associada a uma diminuição estatisticamente significativa na probabilidade de ter altos títulos de anticorpos. Os pesquisadores citam que serão necessários mais estudos para avaliar o papel da idade e dos dias após a imunização na persistência dos anticorpos vacinais e na proteção contra a doença (30/04/2021). Fonte: The Lancet preprint
Estudo apresenta um caso de um homem de 66 anos que recebeu radioterapia de consolidação local no pulmão direito e mediastino para câncer de pulmão de células não pequenas oligometastático (NSCLC) após resposta parcial à quimioimunoterapia inicial. Ele continuou com a imunoterapia de manutenção e ficou assintomático por oito meses após completar a terapia de radiação. Ele então desenvolveu sintomas consistentes com pneumonia dentro de três a cinco dias após sua primeira administração da vacina contra a doença coronavírus 2019 (COVID-19). Ele relatou que esses sintomas se intensificaram significativamente dentro de três a cinco dias após receber sua segunda dose da vacina. O período clínico e as evidências radiográficas levantaram suspeitas de pneumonia por radiação (RRP). Pacientes submetidos à imunoterapia de manutenção após irradiação prévia podem apresentar risco aumentado desse fenômeno, que pode ser desencadeado pela administração da vacina COVID-19 (05/04/2021). Fonte: Cureus
Estudo busca verificar a eficácia da vacina BNT162b2 na prevenção da disseminação de COVID-19 e mortes em lares de idosos (NH). Os pesquisadores usaram regressões de efeitos mistos binomiais negativos inflacionados de zero para modelar as associações de tempo desde a clínica da vacina terminando na semana de 27 de dezembro de 2020 (coorte 1), 3 de janeiro de 2021 (coorte 2) ou 10 de janeiro de 2021 (coorte 3) controlando para taxa de condado de COVID-19, tamanho do leito, localização urbana, censo racial e étnico, número de enfermeiras, residentes e funcionários registrados com casos e mortes de COVID-19. Dos resultados, a vacina BNT162b2 está associada à diminuição da disseminação do SARS ‐ CoV ‐ 2 em residentes e funcionários, bem como à diminuição das mortes entre os residentes (06/05/2021). Fonte: Journal American Geriatrics Society
Pesquisadores relatam a atividade protetora de uma vacina vetorizada de adenovírus de chimpanzé à base de proteína S administrada por via intranasal (ChAd-SARS-CoV-2-S) em animais, que avançou para testes em humanos e avalia a durabilidade, dose-resposta e atividade de proteção cruzada em camundongos. Uma única dose intranasal de ChAd-SARS-CoV-2-S induziu alta resposta de anticorpos neutralizantes e Fc efetores no soro e células plasmáticas de longa vida secretoras de IgG e IgA específicas contra a proteina S na medula óssea. A proteção contra SARS-CoV-2 selvagem foi observada em um período de 200 dias. Às 6 semanas ou 9 meses após a vacinação, os anticorpos séricos neutralizaram as cepas SARS-CoV-2 com proteínas S B.1.351 e B.1.1.28 e conferiram proteção quase completa nas vias respiratórias superiores e inferiores após o desafio. Assim, em camundongos, a imunização intranasal com ChAd-SARS-CoV-2-S fornece proteção durável contra cepas SARS-CoV-2 selvagem e emergentes (09/05/2021). Fonte: bioRxiv
Estudo demostra que a imunização de macacos com uma vacina polivalente contendo um domínio multimérico de ligação ao receptor de SARS-CoV-2 (RBD) com adjuvante 3M-052/Alum provocou respostas de anticorpos cruzados (cross-nAb) contra batCoVs, SARS-CoV-1, SARS-CoV-2 e variantes do SARS-CoV-2: B.1.1.7, P.1 e B.1.351. Os cientistas utilizaram duas técnicas, em uma delas, retiraram fragmentos da proteína spike de todas as variantes de vírus alvejadas pela vacina e os acoplaram a uma partícula nanoscópica, à base da proteína ferritina. Em outra técnica, construíram uma vacina de mRNA. A vacinação com nanopartículas resultou em altos títulos de anticorpos neutralizantes de SARS-CoV-2 e proteção contra SARS-CoV-2 em tratos respiratórios superiores e inferiores de macacos. Autores ressaltaram que o mRNA codificando com a proteína S transmembrana estabilizado ou RBD monomérico também induziu resposta cross-nAbs contra SARS-CoV-1 e batCoV, embora em títulos inferiores. Esses resultados demonstram que as vacinas mRNA atuais podem fornecer alguma proteção contra futuros surtos de betaCoV zoonóticos, e fornecem uma plataforma para o desenvolvimento adicional de vacinas pan-betaCoV (10/05/2021). Fonte: Nature
10/05/2021
Estudo com a população do Qatar, vacinada com a BNT162b2 (Pfizer–BioNTech), que teve sua vacinação em massa iniciada em 21 de dezembro de 2020. O sequenciamento do genoma viral conduzido de 23 de fevereiro a 18 de março indicou que 50,0% dos casos de COVID-19 no Qatar foram causados por B.1.351 e 44,5% foram causados por B.1.1.7. A eficácia estimada da vacina contra qualquer infecção documentada com a variante B.1.1.7 foi de 89,5% em 14 ou mais dias após a segunda dose. A eficácia contra qualquer infecção documentada com a variante B.1.351 foi de 75,0%. A eficácia da vacina contra doença grave, crítica ou fatal devido à infecção com qualquer SARS-CoV-2 (com as variantes B.1.1.7 e B.1.351 sendo predominantes no Qatar) foi muito alta, em 97,4%. A eficácia da vacina também foi avaliada com o uso de um desenho de estudo de coorte, comparando a incidência de infecção entre as pessoas vacinadas com a incidência na coorte nacional de pessoas que eram negativas para anticorpos. A eficácia foi estimada em 87,0% contra a variante B.1.1.7 e 72,1% contra a variante B.1.351, achados que confirmam os resultados relatados acima (05/05/2021). Fonte: N. Eng. J. Med.
Estudo avaliou o papel potencial da vacina contra influenza na redução da taxa de hospitalização e morte em pacientes com COVID-19. De fevereiro de 2020 a maio de 2020, 3.872 habitantes da província de Brindisi (sul da Itália) foram submetidos ao teste de PCR SARS-CoV-2 e 664 (8,7%) apresentaram resultados positivos. Uma análise multivariada mostrou que entre os pacientes com COVID-19 nem a hospitalização nem a morte foram significativamente associadas à vacinação contra influenza. O estudo não mostrou associação entre a vacina contra influenza e complicações da COVID-19. Entretanto, os pesquisadores destacam a importância de se vacinar contra a inflenza (08/04/2021). Fonte: Vaccines
07/05/2021
OMS aprova nesta sexta-feira (07/05/2021) o uso emergencial da vacina da Sinopharm. É o quinto imunizante a ser incluído em uma lista da entidade desde o início da pandemia. Uma aprovação pela agência de Saúde da ONU abre caminho para que a vacina possa ser distribuída pelo Covax Facility. A vacina da Sinopharm é do tipo inativada, e recomendada para adultos com 18 anos ou mais, em um cronograma de duas doses com um espaçamento de três a quatro semanas. A eficácia da vacina para a doença sintomática e hospitalização foi estimada em 79% (07/05/2021). Fonte: OMS
Estudo analisou os dados do ministério da saúde de Israel e demonstrou que a vacina da Pfizer tem 95% de efetividade contra a COVID-19. As duas doses da vacina também se mostraram eficazes no combate a infecção do vírus, reduzindo em 95,3% o número de novos casos de COVID-19, e em 96,7% o risco de morte. As hospitalizações tiveram redução de 97,2% em casos gerais e de 97,5% em casos graves. A eficácia da vacina foi calculada com base da taxa de reinfecção, hospitalizações e mortes nos indivíduos que haviam recebido a segunda dose da vacina há, pelo menos, sete dias e os resultados foram comparados com a taxa de pessoas não vacinadas. O imunizante se mostrou 100% eficaz na prevenção de mortes ocasionadas pela doença na faixa etária de 16 a 44 anos. Nesse grupo, a vacina também reduziu as hospitalizações em 98,1% e diminuiu os casos de infecção em 96,1% (05/05/2021). Fonte: The Lancet
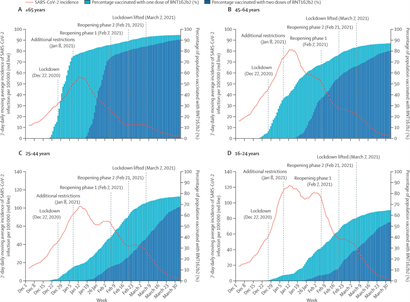
A Agência Europeia de Medicamentos (EMA, na sigla em inglês) anunciou, nesta terça-feira (4), que deu início a uma revisão contínua da vacina CoronaVac contra a Covid-19, desenvolvida pela farmacêutica chinesa Sinovac. Esse é o primeiro passo para um pedido de autorização formal de comercialização na União Europeia. A EMA avaliará os dados para decidir se os benefícios da vacina superam os riscos. A CoronaVac já foi autorizada para uso no Brasil, China, Indonésia e Turquia. Outras três vacinas estão sendo submetidas a uma análise contínua pela agência: CureVac, Novavax e Sputnik V. Até agora, foram aprovadas no bloco europeu as vacinas da Pfizer, Moderna, Oxford/AstraZeneca e Johnson (04/05/2021). Fonte: G1 e EMA
A Rússia anunciou na quinta-feira (6/5) o registro de uma nova versão da vacina Sputnik de uma dose só em vez de duas. O anúncio foi feito pelo Fundo Russo de Investimento Direto (RDIF, na sigla em inglês), que é administrado pelo governo russo e financiou a criação do imunizante; pelo Instituto Gamaleya. O RDIF explicou que a nova vacina, batizada de Sputnik Light, usa apenas a primeira dose da Sputnik V, a original. Os testes mostraram que ela teve uma eficácia de 79,4%, calculada com base em dados de russos que foram vacinados com a primeira dose da Sputnik V e não receberam a segunda por algum motivo, entre 5 de dezembro de 2020 e 15 de abril de 2021. O fundo soberano russo disse no novo anúncio que a Sputnik Light gerou anticorpos em 96,9% dos participantes do estudo, e, em 91,67%, também produziu os anticorpos neutralizantes (06/05/2021). Fonte: G1
Nesta revisão, pesquisadores resumiram e analisaram os dados de eficácia, imunogenicidade e segurança de relatórios clínicos sobre diferentes vacinas COVID-19. Discutiram as várias diretrizes estabelecidas para o desenvolvimento de vacinas e a importância dos padrões biológicos para comparar o desempenho das vacinas. Por fim, destacaram os principais desafios, as possíveis estratégias para enfrentá-los e as melhorias esperadas na próxima geração de vacinas COVID-19 (12/04/2021). Fonte: Frontiers in Immunology
Recentemente, os níveis de título de anticorpos foram acompanhados em 33 adultos que receberam a vacina de mRNA-1273 por 6 meses. Com eficácia estimada de dose única de 92,1%. Pesquisadores combinaram esse conhecimento com os níveis de anticorpos correspondentes para modelar e estimar a durabilidade de longo prazo da vacina de mRNA-1273. Além disso, integraram estudos sobre diferenças na neutralização de anticorpos para variantes do SARS-CoV-2 para entender como as variantes podem afetar a durabilidade da vacina. Os dias estimados após a primeira injeção para que os anticorpos de ligação caiam abaixo dos níveis daqueles a partir do dia 15 é de 411 dias. Os dias estimados após a primeira injeção para cair abaixo do limite inferior de detecção de 20 GMTs é de 327 dias para a neutralização de pseudovírus e 461 dias para a neutralização de vírus vivos. O modelo aponta a neutralização de pseudovírus contra a variante B.1.351 caindo abaixo de 20 GMT no dia 100; variante P.1 no dia 202, variante B.1.429 no dia 258; e variante B.1.1.7 no dia 309. Em conclusão, os pesquisadores afirmam que acreditam que a vacina de duas doses de mRNA-1273 pode fornecer mais de um ano de proteção contra COVID-19 da variante D614G inicial. Portanto, deve-se considerar uma injeção de reforço um ano após a primeira série de vacinas. Se houver um aumento observado nas variantes com maior resistência, como B.1.351 e P.1, uma vacina de reforço contra as variantes mais recentes deve ser considerada para aumentar a proteção contra as variantes resistentes (04/05/2021) Pre print. Fonte: MedRxiv
Autores relatam o uso de um novo método (SolaVAX) para a produção de uma vacina inativada candidata e o teste dessa candidata em um modelo animal hamster para sua capacidade de prevenir a infecção após desafio com o vírus SARS-CoV-2. Os estudos empregados neste trabalho incluíram uma avaliação dos níveis de anticorpos neutralizante produzidos após-vacinação, níveis de subtipos de anticorpos específicos para RBD e proteína S que foram gerados, avaliação do espalhamento viral pós-desafio, citometria de fluxo e sequenciamento de células únicas em frações celulares e avaliação histopatológica de tecidos pós-desafio. Os resultados desta avaliação preliminar fornecem uma visão das respostas imunológicas que ocorrem como resultado da vacinação com a candidata à vacina proposta e do impacto que as formulações adjuvantes, especificamente desenvolvidas para promover respostas imunes do tipo Th1, têm sobre a eficácia da vacina e a proteção contra infecções após desafio com SARS-CoV-2 in vivo. Esses dados podem ter utilidade no desenvolvimento de candidatas a vacinas eficazes de forma ampla. Além disso, os resultados desta avaliação preliminar sugerem que a preparação de vacinas de virus inteiros para COVID-19 usando este método fotoquímico específico pode ter utilidade potencial na preparação de um desses candidatos à vacina (01/04/2021). Fonte: Vaccines
05/05/2021
Artigo apresenta os resultados provisórios de segurança e imunogenicidade do primeiro estudo em humanos, de fase 1/2 da vacina CoV2 preS dTM com duas formulações adjuvantes diferentes. CoV2 preS dTM é uma vacina estabilizada de proteína S de fusão produzida em um sistema de expressão de baculovírus que está sendo desenvolvido contra SARS-CoV-2. 441 indivíduos (299 com idades entre 18 e 49 anos e 142 ≥ 50 anos) foram aleatoriamente atribuídos a um dos 11 grupos de tratamento. A neutralização dos anticorpos foi analisada em 326 (74%) de 441 participantes (235 [79%] de 299 de 18 a 49 anos e 91 [64%] de 142 anos ≥50 anos). Não houve eventos adversos imediatos não solicitados relacionados à vacina, eventos adversos graves, eventos adversos medicamente atendidos classificados como eventos graves ou adversos de interesse especial. Os autores destacam será necessária uma melhora adicional da formulação de antígenos da vacina pré-S para identificar a dose ideal da vacina antes da avaliação em ensaios de fase 3 de maior escala (19/04/2021). Fonte: The Lancet Inf. Disease
Dados do Conselho Federal de Enfermagem (Cofen) revelaram que o Brasil teve, no mês de abril, uma queda de 71% no número de enfermeiros mortos pela COVID-19 em comparação a março. Para o Comitê Gestor da Crise (CGC) do órgão, a redução é fruto dos efeitos da vacinação após uma alta nos óbitos durante a segunda onda da doença no país. Desde o início da pandemia, foram registradas 776 mortes entre enfermeiros, técnicos e auxiliares de enfermagem ocasionadas pelo novo coronavírus. Os maiores índices estão nas regiões Sudeste (28,2%) e Norte (27,2%). Em abril, foram 24 óbitos no país, segundo dados divulgados pelo Cofen, o que representa cerca de 71% a menos que o alto número constatado em março (82 mortes). A significativa diminuição é um reflexo da tendência em todas as regiões do país, com mais destaque para o Sudeste, que registrou apenas uma morte entre profissionais da enfermagem no último mês. Foram 7 óbitos no Norte; 3, no Nordeste; 5, no Centro-Oeste; e 8, no Sul. Segundo especialistas, a queda revela a importância da vacinação e traz esperança aos brasileiros (04/05/2021). Fonte: Galileu
Estudo enfoca os métodos in silico que usam abordagens imunoinformáticas para construir uma vacina de subunidade baseada em epítopo para SARS-CoV-2 que é usada para produzir várias respostas imunes positivas dentro da célula hospedeira. Várias células B, células Tc e células Th contendo diferentes epítopos são consideradas para a inibição da proteína S de SARS-CoV-2. Seguindo diferentes abordagens, eventualmente, a estrutura da vacina proposta consiste em Tc, células Th e células B unidas por diferentes ligantes. Tendo atualmente epítopos de células B, bem como feitos de IFN-y, confirmam a resposta imune humoral e mediada por células desenvolvida pela vacina proposta. Um servidor online, o PSIPRED, foi usado para desenvolver o modelo de vacina. 15 epítopos antigênicos foram escolhidos da proteína S para desenvolver uma vacina eficaz. Essa vacina era antiviral, não alérgica e menos tóxica. A sequência da estrutura da vacina foi então validada por diferentes métodos computacionais como Molecular Docking, RMSD, RMSF e Molecular Dynamic Simulation. A ferramenta de adaptação Java Codon, também conhecida como JCat, é usada para otimização máxima da expressão da vacina com vetor (21/04/2021). Fonte: ChemRxiv
03/05/2021
Nesta revisão, discutiu-se os princípios gerais do projeto de vacina de mRNA e os mecanismos de trabalho das vacinas, e fornecem um resumo atualizado de ensaios pré-clínicos e clínicos em sete vacinas candidatas a mRNA anti-COVID-19, com o foco nas duas vacinas de mRNA já licenciadas para vacinação. Também destacam as principais estratégias na concepção de vacinas de mRNA para maximizar a expressão de imunógenos e evitar a resposta imune inata intrínseca (10/04/2021). Fonte: International Journal of Biological Sciences
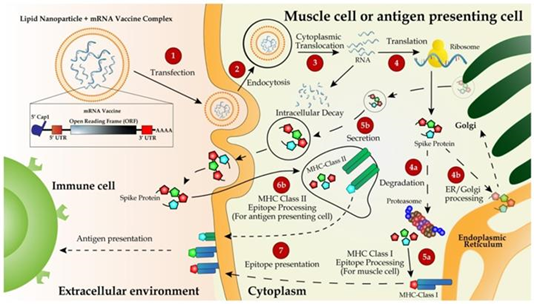

Estudos avaliam os dados sobre as respostas imunes induzidas pela vacina de mRNA frente as células B de memória específicas de anticorpos e antígenos ao longo do tempo em 33 indivíduos naïve para SARS-CoV-2 e 11 indivíduos recuperados para SARS-CoV-2. Indivíduos naïve de SARS-CoV-2 necessitaram de ambas as doses de vacina para aumentos ótimos de anticorpos, particularmente para títulos neutralizantes contra a variante B.1.351. As células B de memória específicas para a proteína spike de domínio de ligação ao receptor de spike (RBD) também foram eficientemente iniciadas pela vacinação de mRNA e detectáveis em todos os indivíduos naïve para SARS-CoV-2 após a segunda dose de vacina, embora a resposta das células B de memória tenha diminuído ligeiramente com a idade. Em indivíduos recuperados com SARS-CoV-2, as respostas dos anticorpos e das células B de memória foram significativamente aumentadas após a primeira dose da vacina; no entanto, não houve aumento nos anticorpos circulantes, títulos neutralizantes ou células B de memória específicas do antígeno após a segunda dose. Este reforço robusto após a primeira dose de vacina correlacionou-se fortemente com os níveis de células B de memória pré-existentes em indivíduos recuperados, identificando um papel fundamental para as células B de memória na montagem de respostas de memória aos antígenos SARS-CoV-2. Juntos, os dados demonstraram priming sorológico e celular robusto por vacinas de mRNA e revelaram respostas distintas com base na exposição anterior de SARS-CoV-2, em que indivíduos recuperados de COVID-19 podem requerer apenas uma dose única de vacina para atingir o pico de anticorpos e respostas de células B de memória (15/04/2021). Fonte: Science

Pesquisadores descrevem os resultados de duas vacinações de um voluntário saudável autoexperimentado com peptídeos derivados de SARS-CoV-2 realizadas em março e abril de 2020, respectivamente. O primeiro conjunto de peptídeos continha oito peptídeos previstos para se ligar às moléculas HLA do indivíduo. O segundo conjunto consistia em dez peptídeos previstos para se ligarem a vários alotipos HLA-DR. A formulação da vacina continha o novo agonista TLR 1/2 XS15 e foi administrada como uma emulsão em Montanide como uma única injeção subcutânea. Células mononucleares de sangue periférico isoladas de sangue coletado antes e depois das vacinações foram avaliadas usando ensaios de Interferon-γ ELISpot e coloração de citocina intracelular. Os pesquisadores detectaram respostas de células T CD4 induzidas por vacina contra seis de 11 peptídeos previstos para se ligar a HLA-DR após 19 dias, após a vacinação, para um peptídeo já no dia 12 (24/04/2021). Fonte:Vaccines
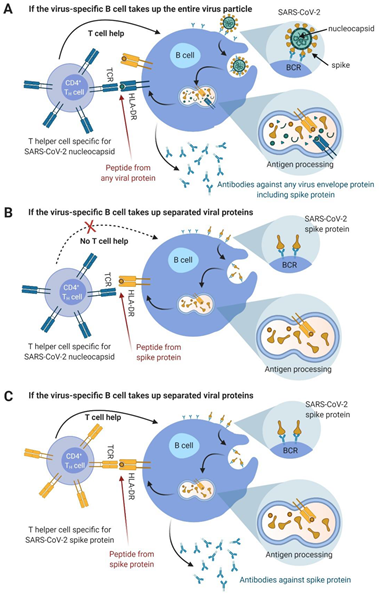
Pesquisadores avaliaram se houve impacto das imunizações na mortalidade de indivíduos com mais de 80 anos no Brasil. A mortalidade proporcional em idades de 80+ e 90+ anos em relação às mortes em todas as idades foi calculada, e as taxas de mortalidade foram comparadas com indivíduos com idade 0-79 anos. Como a variante P.1 se espalhou por todo o Brasil, o número total de mortes aumentou ao longo do tempo, começando na semana epidemiológica 9 de 2021. A proporção de todas as mortes ocorrendo nas idades de 80+ anos foi superior a 25% nas semanas 1-6 e diminuiu rapidamente para 13,1% nas semanas 13-14. As taxas de mortalidade foram mais de 13 vezes maiores no grupo de 80+ anos em comparação com as de 0-79 anos até a semana 6, e diminuíram para 6,9 vezes nas semanas 13-14. A vacina Coronavac foi responsável por 77,3% e a vacina AstraZeneca por 15,9% de todas as doses administradas. A cobertura vacinal (primeira dose) aumentou rapidamente entre indivíduos com mais de 80 anos, atingindo 49,1% nas semanas 5-6 e mais de 90% após a semana 9. O rápido aumento da cobertura vacinal entre idosos brasileiros foi associado a um declínio importante na mortalidade relativa em comparação com indivíduos mais jovens, em um ambiente onde a variante P.1 predomina. Se as taxas de mortalidade entre os idosos permanecessem proporcionais ao que foi observado até a semana 6, seriam esperadas 13.824 mortes adicionais até a semana 14 (30/04/2021). Fonte: MedRxiv
Estudo compara a eficácia protetora de duas vacinas de subunidade com adjuvante com proteína spike S1: uma vacina intramuscular (IM) iniciada / reforçada e uma vacina da mucosa intensificada por IM / intranasal (IN), em macacos rhesus. A vacina apenas de alúmen IM induziu ligação robusta e anticorpo neutralizante e imunidade celular persistente sistemicamente e mucosalmente, enquanto o reforço de IN com nanopartículas incluindo IL-15 e agonistas de TLR eliciou respostas de células T e anticorpos mais fracas, mas IgA e IFNa diméricos mais elevados. No entanto, após o desafio de SARS-CoV-2, nenhum dos grupos apresentou RNA subgenômico detectável nas vias respiratórias superiores ou inferiores versus controles naïve, indicando proteção total contra a replicação viral. Embora os mecanismos de proteção da mucosa e sistêmicos possam diferir, os resultados demonstram que ambas as vacinas podem proteger contra a exposição respiratória à SARS-CoV-2. A vacina da mucosa foi segura após múltiplas doses e eliminou o vírus de entrada de forma mais eficiente na cavidade nasal e, portanto, pode atuar como um potente reforço complementar para vacinas sistêmicas convencionais para fornecer melhor proteção geral (28/04/2021). Fonte: JCI insight
30/04/2021
Professor do Instituto de Ciências Biomédicas da USP e pesquisadora da UFRGS oferecem uma interpretação sobre o estudo publicado como preprint sobre segurança e potencial de estimular resposta imunológica pela CoronaVac, realizado no Chile. Segundo os pesquisadores, é normal e esperado que vacinas baseadas em vírus inativados, como a CoronaVac, estimulem quantidades menores de anticorpos do que vacinas que não utilizam o vírus inteiro, pois utilizam estratégias diferentes. As vacinas de vetor viral (como a Covishield, desenvolvida pela parceria entre a AstraZeneca com a Universidade de Oxford) priorizam estimular uma resposta potente de anticorpos para a proteína S, e para isso usam na sua formulação apenas essa proteína do vírus para treinar o sistema imunológico. A CoronaVac, em contrapartida, busca estimular resposta imunológica contra todas as partes do vírus, e para isso troca potência por abrangência. Assim, a CoronaVac busca gerar resposta imunológica para outras proteínas do vírus, incluindo a indução de células do sistema imunológico (os linfócitos). Alguns estudos recentes sugerem que os linfócitos são importantes para conter o agravamento da doença, portanto, o dado mais importante do estudo chileno, segundo os pesquisadores, é exatamente a detecção da resposta de linfócitos induzidos pela CoronaVac. Os pesquisadores concluem que esse dado indica que a vacina é capaz de treinar o sistema imunológico para agir contra todas as partes do vírus, não apenas contra a proteína S, com a presença dos linfócitos para compor o arsenal da resposta contra a infecção viral. Desta forma, provavelmente a CoronaVac é menos suscetível às mutações que o vírus faz na proteína S (22/04/2021). Fonte: Jornal da USP
O presidente da Agência Nacional de Vigilância Sanitária (Anvisa) fez um pronunciamento por meio das redes sociais do órgão questionando críticas feitas pelos laboratórios e instituições responsáveis pelo desenvolvimento da vacina Sputnik V. Durante o pronunciamento, técnicos acrescentaram que a detecção de adenovírus replicante ocorreu no produto acabado, e não em fases intermediárias da fabricação. O índice de presença teria sido 300 vezes superior ao maior limite permitido pela FDA americana. Segundo a Anvisa, “se não houver mudanças na vacina, não há como autorizar seu uso no Brasil”. O gerente-geral da Anvisa alertou que, uma vez no organismo humano, o adenovírus replicante poderia causar viroses e se acumular em tecidos específicos do corpo, como nos rins (29/04/2021). Fonte: Agência Brasil
As vacinas contra a COVID-19 proporcionaram a oportunidade de retardar a propagação do vírus. Agora os cientistas estão estudando a eficácia das vacinas na contenção da transmissão. Novos dados do Centro de Controle e Prevenção de Doenças dos Estados Unidos (CDC) revelam que infecções por COVID-19 podem ocorrer em vacinados, mas parecem ser excepcionalmente raras. Em 14 de abril, o CDC recebeu relatos de que cerca de 5,8 mil pessoas vacinadas com as duas doses foram infectadas pelo SARS-CoV-2. Quase metade dessas infecções (45%) ocorreram em pessoas com idades acima de 60 anos. 7% das pessoas com infecções que quebraram a barreira da vacina — infecções que ocorrem após a imunização completa — foram internadas e 1% morreu. Quatro meses depois que a FDA autorizou as primeiras vacinas contra a COVID-19, o CDC obteve dados suficientes para sugerir que as vacinas reduzem substancialmente o contágio — e, portanto, reduzem a possibilidade de uma pessoa vacinada contaminar outras pessoas (29/04/2021). Fonte: National Geographic
Pesquisa avalia a segurança e eficácia de uma vacina dois-em-um de replicon e VLP de minispike para COVID-19 em camundongos após uma única imunização. A proteína (S) do SARS-CoV-2 é o principal alvo dos atuais candidatos à vacina para COVID-19, mas pode induzir anticorpos não neutralizantes, o que pode causar complicações induzidas pela vacinação. Os autores desenvolveram uma plataforma segura de vacina utilizando replicon de rabdovírus para apresentação aprimorada do domínio de ligação de receptores (RBD). Foi desenhado então uma minispike quimérica que compreende o RBD globular ligado a uma sequência transmembrana de uma glycoproteína (G) derivada do vírus da raiva (RABV). O replicon codificando a minispike não só permitiu a expressão do antígeno na superfície celular, mas também a incorporação no envelope de partículas não infecciosas secretadas, combinando assim a expressão clássica de antígeno orientado por vetores e a apresentação de partículas semelhantes ao vírus particulado (VLP). Uma única dose foi capaz de estimular a produção de anticorpos neutralizantes e de proteger camundongos frente ao desafio com o SARS-CoV-2 (21/04/2021). Fonte: PLOS Pathogens
28/04/2021
Artigo apresenta os resultados de segurança e imunogenicidade de uma vacina SARS-CoV-2 inativada em 191 adultos chineses de 18 a 59 anos em teste clinico de fase 1 randomizado, duplo-cego e controlado (CTR20200943 e NCT04412538). A soroconversão foi associada à regulação síncroca de anticorpos contra a proteína S, proteína N e uma resposta citotóxica de linfócito T (CTL). Não foram observadas citocinas e células imunes relacionadas à imunopatologia. A análise de transcriptoma revelou a diversidade genética das respostas imunes induzidas pela vacina (09/04/2021). Fonte: Vaccine

Toda a população adulta da cidade de Botucatu, no interior paulista, será vacinada em breve contra a COVID-19. Segundo o Ministério da Saúde, a previsão é que os 106 mil residentes com mais de 18 anos sejam imunizados com a vacina desenvolvida pelo laboratório AstraZeneca. A imunização faz parte de uma ação em parceria com a Universidade de Oxford, laboratório AstraZeneca, Fundação Oswaldo Cruz (Fiocruz), Fundação Gates, Universidade Estadual Paulista (Unesp) e prefeitura de Botucatu. Além da vacinação, será feita a testagem de todos os casos suspeitos de COVID-19. Também será desenvolvido o sequenciamento genético dos vírus de todos que forem positivos. Assim, o estudo, com estimativa para durar oito meses, deverá avaliar a efetividade da vacina contra as diferentes variantes do novo coronavírus. O trabalho também vai comparar os resultados da vacinação em massa contra o novo coronavírus (28/04/2021). Fonte: Agência Brasil
Estudo da Agência de Saúde Pública da Inglaterra (PHE) descobriu que as pessoas que receberam a primeira dose das vacinas da Pfizer/BioNTech ou de Oxford/AstraZeneca, e que foram infectadas pelo menos três semanas depois, tinham entre 38% e 49% menos probabilidade de transmitir o coronavírus para pessoas que vivem em suas casas, em comparação com aqueles que não foram vacinados. A pesquisa analisou mais de 57 mil pessoas que viviam em 24 mil famílias que tinham contato com uma pessoa vacinada. Este grupo foi comparado com quase 1 milhão de contatos de pessoas que não haviam sido vacinadas contra a doença (28/04/2021). Fonte: GOV.UK
Nanopartículas à base de lipídios têm desempenhado um papel fundamental no sucesso das vacinas COVID-19 e muitos outros nanomedicamentos, como Doxil® e Onpattro®, e, portanto, foram consideradas como pioneiros em sistemas de distribuição de fármacos em nanoescala. Nesta revisão, pesquisadores destacam o progresso no desenvolvimento dessas nanopartículas lipídicas para diversas aplicações, incluindo a nanomedicina para vacinas COVID-19. As nanopartículas à base de lipídios discutidas nesta revisão são lipossomas, niossomas, transfersomes, nanopartículas de lipídios sólidos e carreadores de lipídios nanoestruturados. Foram destacadas as inovações que obtiveram aprovação regulatória ou que estão em testes clínicos. Também discutiu-se as propriedades físico-químicas necessárias para aplicações específicas, destacou-se as diferenças nos requisitos para a entrega de diferentes cargas e apresentou-se os desafios atuais que precisam de mais desenvolvimento. Esta revisão serve como uma diretriz útil para projetar novas nanopartículas lipídicas para vacinas preventivas e terapêuticas, incluindo imunoterapias (08/04/2021). Fonte: Vaccines
26/04/2021
A vacina Ad26.COV2.S é um vetor recombinante de adenovírus humano tipo 26, que codifica a proteína S de SARS-CoV-2 em uma conformação estabilizada por pré-fusão. O estudo de fase 3 internacional, randomizado, duplo-cego, controlado por placebo (ENSEMBLE ClinicalTrials.gov, NCT04505722) incluiu 19.630 participantes negativos para SARS-CoV-2 que receberam a vacina Ad26.COV2.S e 19.691 que receberam placebo. A vacina Ad26.COV2.S protegeu contra COVID-19 moderado a grave em pelo menos 14 dias após a administração (116 casos no grupo da vacina vs. 348 no grupo do placebo; eficácia de 66,9%) e pelo menos 28 dias após a administração (66 vs. 193 casos; eficácia de 66,1%). A eficácia da vacina foi maior contra COVID-19 grave (76,7% para início em ≥14 dias e 85,4% para início em ≥28 dias). Apesar de 86 de 91 casos (94,5%) na África do Sul com o vírus sequenciado com a variante 20H/501Y.V2, a eficácia da vacina foi de 52,0% e 64,0% contra COVID-19 moderado a grave com início em pelo menos 14 dias e em pelo menos 28 dias após a administração, respectivamente, e eficácia contra COVID-19 grave foi de 73,1% e 81,7%, respectivamente. A incidência de eventos adversos graves foi equilibrada entre os dois grupos. Três mortes ocorreram no grupo da vacina (nenhuma foi relacionada à COVID-19) e 16 no grupo do placebo (5 foram relacionadas à COVID-19) (21/04/2021). Fonte: New England Journal of Medicine.
Estudos utilizando dados do mundo real sobre a resposta de anticorpos pós-vacinação na população em geral são limitados. 45.965 adultos no Inquérito Nacional de Infecção COVID-19 do Reino Unido que receberam vacinas Pfizer-BioNTech ou Oxford-AstraZeneca tiveram 111.360 medições de IgG anti-spike. Sem infecção anterior, as taxas de soroconversão e os níveis quantitativos de anticorpos após a dose única foram menores em indivíduos mais velhos, especialmente >60 anos. Duas doses alcançaram altas respostas em todas as idades, particularmente aumentando a soroconversão em pessoas mais velhas, para níveis semelhantes aos alcançados após a infecção anterior seguida por uma única dose. Os níveis de anticorpos aumentaram mais lentamente e para níveis mais baixos com Oxford-AstraZeneca versus Pfizer-BioNTech, mas diminuíram após uma única dose de Pfizer-BioNTech (23/04/2021) preprint. Fonte: medRxiv
Estudo de coorte prospectivo buscou avaliar a eficácia da vacinação COVID-19 na prevenção da infecção por SARS-CoV-2 na comunidade do Reino Unido. Foram incluídos 373.402 participantes com idade ≥16 anos contribuindo com 1.610.562 resultados de RT-PCR de esfregaços de nariz e garganta entre 1º de dezembro de 2020 e 3 de abril de 2021. As chances de nova infecção por SARS-CoV-2 foram reduzidas em 65% naqueles ≥21 dias desde a primeira vacinação sem segunda dose versus indivíduos não vacinados sem evidência de infecção anterior (RT- PCR ou anticorpo). Nos vacinados, a maior redução nas chances foi observada após a segunda dose (70%). Não houve evidência de que esses benefícios variaram entre as vacinas Oxford-AstraZeneca e Pfizer-BioNTech. A vacinação com uma única dose de vacinas Oxford-AstraZeneca ou Pfizer-BioNTech, ou duas doses de Pfizer-BioNTech, reduziu significativamente as novas infecções por SARS-CoV-2 neste estudo de vigilância comunitária. Maiores reduções nas infecções sintomáticas e/ou infecções com uma carga viral mais alta refletetiram nas taxas reduzidas de hospitalizações/mortes, mas os pesquisadores destacam um potencial de transmissão contínua limitada de infecções assintomáticas em indivíduos vacinados (23/04/2021). Fonte: medRxiv
Estudo investigou a associação entre a implantação em massa das primeiras doses das vacinas contra COVID-19 BNT162b2 mRNA (Pfizer–BioNTech) e ChAdOx1 nCoV-19 (Oxford–AstraZeneca) e as internações hospitalares para COVID-19 na Escócia. Foi realizado um estudo prospectivo de coorte usando a Avaliação Pandêmica Precoce e Vigilância Aprimorada do COVID-19 - EAVE II - banco de dados que compreende vacinação, atenção primária, teste de RT-PCR e registros de internação hospitalar para 5,4 milhões de pessoas na Escócia (cerca de 99% da população). Deste total, 20% foi vacinado. A primeira dose da vacina BNT162b2 mRNA foi associada a um efeito vacinal de 91% para redução da internação hospitalar 28-34 dias após a vacinação. O efeito vacinal no mesmo intervalo de tempo para a vacina ChAdOx1 foi de 88%. Uma das limitações do estudo incluem que a vacina ChAdOx1 seja predominantemente usada em idosos e disponível apenas a partir de 4 de janeiro de 2021, dando menos tempo para acompanhamento (23/04/2021). Fonte: The Lancet
Artigo apresenta os resultados de um teste clínico multicêntrico fase 3 realizado no Chile com profissionais de saúde com idade igual ou maior que 18 anos que foram aleatoriamente designados para receber duas doses de CoronaVac ou placebo separados por duas semanas (0-14). Foram analisados os resultados obtidos para um subconjunto de 434 participantes, em relação a imunidade mediada por anticorpos e células. A taxa de soroconversão para IgG anti-S1-RBD específico foi de 47,8% para o grupo de 18 a 59 anos de idade 14 dias após a imunização (p.i.) e 95,6% 28 e 42 dias p.i. Para o grupo ≥60 anos, a taxa de soroconversão foi de 18,1%, 100% e 87,5% aos 14, 28 e 42 dias, respectivamente. A imunização com CoronaVac em adultos de 18 anos ou mais na população chilena é segura e induz a produção específica de IgG contra o S1-RBD com capacidade neutralizante, bem como a ativação de células T secretando IFN-γ, mediante reconhecimento de antígenos SARS-CoV-2 (01/04/2021). Fonte: medRXiv
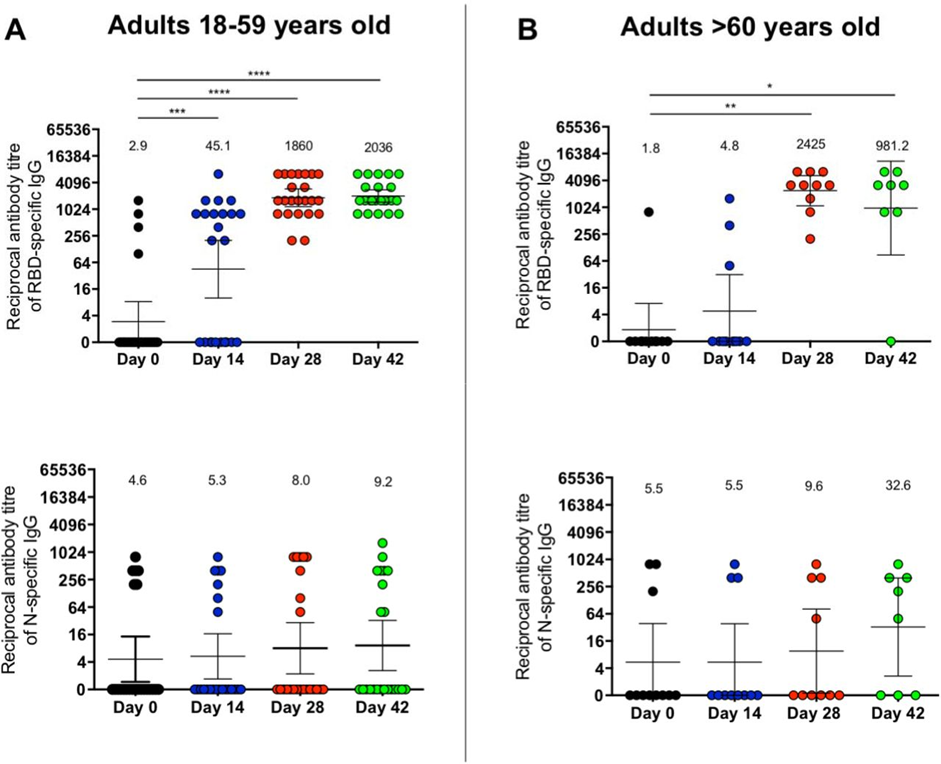
22/04/2021
Estudo Com-Cov lançado em fevereiro de 2021 com os participantes recebendo doses alternadas das vacinas Oxford AstraZeneca e Pfizer vem sendo realizado e a ele foi adicionado seis braços ao estudo que recrutou 1.050 voluntários adultos com mais de 50 anos que receberam sua primeira dose de vacinação como parte do lançamento nacional nas últimas oito a 12 semanas. Os novos braços correspondem: Dose da vacina da Pfizer, seguida pela dose da vacina da Pfizer, com 12 semanas de intervalo; Dose da vacina Pfizer, seguida pela dose da vacina Moderna, com 12 semanas de intervalo; Dose da vacina Pfizer, seguida pela dose da vacina Novavax, com 12 semanas de intervalo; Dose da vacina AstraZeneca, seguida pela dose da vacina AstraZeneca, com 12 semanas de intervalo; Dose da vacina AstraZeneca, seguida pela dose da vacina Moderna, com 12 semanas de intervalo; e Dose da vacina AstraZeneca, seguida pela dose da vacina Novavax, com 12 semanas de intervalo (13/04/2021). Fonte: The BMJ
O Centro Nacional de Pesquisa de Epidemiologia e Microbiologia Gamaleya do Ministério da Saúde da Federação Russa e o Fundo Russo de Investimento Direto (RDIF, fundo soberano da Rússia) anunciaram que a vacina Sputnik V, baseada em vetor viral, demonstrou eficácia de 97,6%, com base na análise de dados sobre a taxa de infecção de SARS-CoV-2 entre os vacinados na Rússia. De acordo com os dados de 3,8 milhões de russos vacinados com ambos os componentes do Sputnik V de 5 de dezembro de 2020 a 31 de março de 2021, como parte do programa de vacinação civil em massa, a taxa de infecção a partir do 35º dia a contar da data da primeira dose foi de apenas 0,027%. Ao mesmo tempo, a incidência entre a população adulta não vacinada foi de 1,1% por um período comparável a partir do 35º dia após o lançamento da vacinação em massa na Rússia. Os dados e cálculos da eficácia da vacina serão publicados em maio (19/04/2021). Fonte: Sputnik V.
A EMA (European Medicines Agency) confirma que o risco-benefício geral da vacina da Janssen contra COVID-19 permanece positivo. Em reunião de 20 de abril de 2021, o comitê de segurança da EMA concluiu que um aviso sobre coágulos sanguíneos incomuns com plaquetas baixas deve ser adicionado às informações do produto e concluiu que esses eventos devem ser listados como efeitos colaterais muito raros da vacina. Para chegar à sua conclusão, o Comitê levou em consideração todas as evidências atualmente disponíveis, incluindo oito relatórios dos Estados Unidos de casos graves de coágulos sanguíneos, um dos quais teve um desfecho fatal. Em 13 de abril de 2021, mais de 7 milhões de pessoas haviam recebido a vacina de Janssen nos Estados Unidos. Todos os casos ocorreram em pessoas com menos de 60 anos de idade nas três semanas após a vacinação, a maioria em mulheres. Com base nas evidências atualmente disponíveis, os fatores de risco específicos não foram confirmados (20/04/2021). Fonte: EMA.
Pesquisadores investigaram se a imunização materna resulta na secreção de anticorpos para SARS-CoV-2 no leite materno e avaliou quaisquer possíveis eventos adversos entre as mulheres e seus bebês. Foi realizado um estudo prospectivo de coorte de uma amostra de mulheres em aleitamento materno (exclusivas ou parciais) pertencentes a grupos prioritários de vacinação que optaram por ser vacinadas. Todos as 84 participantes receberam 2 doses da vacina Pfizer-BioNTech com 21 dias de intervalo. Amostras de leite materno foram coletadas antes da administração da vacina e, em seguida, uma vez por semana durante 6 semanas, começando na semana 2 após a primeira dose. Nenhuma mãe ou bebê experimentou qualquer evento adverso grave durante o período de estudo. Estudo encontrou secreção robusta de anticorpos IgA e IgG específicos SARS-CoV-2 no leite materno por 6 semanas após a vacinação. Os anticorpos encontrados no leite materno dessas mulheres apresentaram fortes efeitos neutralizantes, sugerindo um potencial efeito protetor contra a infecção no bebê (12/04/2021). Fonte: JAMA
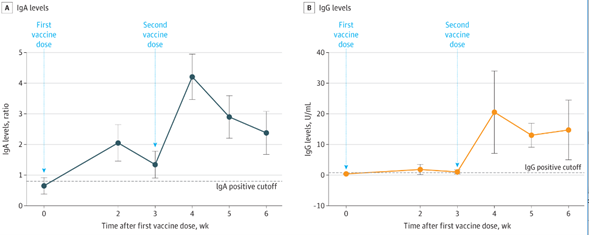
Estudo demonstra que uma variante do vírus SARS-CoV-2 detectada na África do Sul pode escapar de anticorpos provocados pela vacina Sputnik V contra COVID-19. Pesquisadores obtiveram amostras de soro carregado de anticorpos de 12 pessoas vacinadas com Sputnik V e testaram o soro contra vírus projetados para simular as versões da proteína S encontradas em certas variantes SARS-CoV-2. Oito das 12 amostras não inibiram vírus contendo a proteína S de B.1.351, a variante identificada na África do Sul. Mas as amostras neutralizaram efetivamente vírus contendo a proteína S da variante B.1.1.7, que foi detectada na Grã-Bretanha (03/04/2021). Fonte: medRXiv

Métodos in silico de bioinformática, vaccinogenômica, imunoinformática, biologia estrutural e simulações moleculares podem ser usados para um projeto de vacina mais rápido e preciso. Este artigo destaca duas estratégias principais de imunoinformática que são usadas na concepção de novas vacinas e terapêuticas: vacinologia reversa e vacinologia estrutural (14/04/2021). Fonte: Journal Medical Virology
A imunogenicidade e a segurança da vacina Covaxin foram determinadas em duas concentrações de antígeno (3μg e 6μg), com dois adjuvantes diferentes (Alúmen ou Alúmen quimiossorvido com agonista TLR7/8), em camundongos, ratos e coelhos. Os resultados mostraram que as formulações da vacina BBV152 geraram títulos de ligação ao antígeno e anticorpos neutralizantes (NAb) significativamente altos, em ambas as concentrações, em todas as três espécies com excelentes perfis de segurança. Embora os títulos de anticorpos neutralizantes não sejam estatisticamente diferentes entre a concentração de antígeno (3 μg e 6 μg) ou a natureza do adjuvante, todas as formulações testadas exibiram excelente imunogenicidade. Esses resultados apoiaram o desenvolvimento de ensaios clínicos de fase 1 / 2 desta vacina que atualmente está na fase 3 dos testes clínicos (23/04/2021). Fonte: iScience
Um estudo do governo chileno demonstrou que a vacina da Sinovac Biotech Ltd. (CoronaVac) é 67% eficaz na prevenção de infecções sintomáticas do COVID-19 e afasta 80% das mortes da doença. Segundo o relatório, a vacina CoronaVac foi 85% eficaz contra as internações e 89% na prevenção de entrada de pessoas em unidades de terapia intensiva. Esta é a primeira evidência que mostra o quanto a vacina CoronaVac pode proteger contra COVID-19 depois de ter sido amplamente usado em uma população. O estudo do Ministério da Saúde do Chile acompanhou 10,5 milhões de cidadãos matriculados no sistema público de saúde do país e os números de eficácia foram obtidos 14 dias após a segunda dose da vacina. Após apenas uma dose, a vacina previne cerca de 16% das infecções sintomáticas, 35% das internações e 40% dos óbitos (16/04/2021). Fonte: Bloomberg
Pesquisadores publicaram os resultados do ensaio clínico duplo-cego, randomizado, multicêntrico de fase 2 sobre a imunogenicidade e segurança da vacina BBV152 (Covaxin) em adultos e adolescentes saudáveis (com idades entre 12-65 anos). O estudo ocorreu em nove hospitais na Índia com a candidatura de 921 voluntários, dos quais 380 foram selecionados para o estudo. Os participantes foram designados aleatoriamente (1:1) para receber 3 μg com Algel-IMDG ou 6 μg com Algel-IMDG. Duas doses intramusculares de vacina foram administradas no dia 0 e no dia 28. Os títulos de anticorpos neutralizantes de tipo selvagem de SARS-CoV-2, as taxas de seroconversão em 4 semanas após a segunda dose e a segurança foram avaliados. Os títulos de anticorpos neutralizantes foram semelhantes aos de um painel de amostras de soro de convalescença. Todas as respostas de citocinas induzidas para BBV152 foram enviesadas para células Th1. A vacina foi bem tolerada em ambos os grupos, sem eventos adversos graves. Com base nas respostas mediadas por células superiores no ensaio de fase 1, a formulação de 6 μg com Algel-IMDG foi selecionada para o ensaio de eficácia de fase 3, que inclui 25.800 voluntários (08/03/2021). Fonte: The Lancet
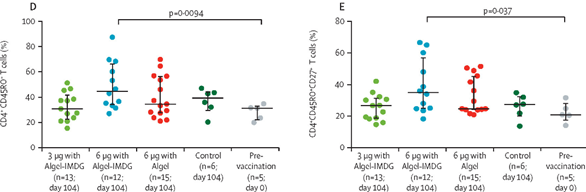
A Covaxin, vacina contra a COVID-19 produzida na Índia, apresentou eficácia geral de 78% nos casos sintomáticos e de 100% em casos graves. O anúncio foi feito nesta quarta-feira (21) pela fabricante Bharat Biotech, empresa de biotecnologia indiana, e pelo Conselho de Pesquisa Médica da Índia (ICMR). Os dados fazem parte da segunda análise provisória de testes clínicos de fase 3. A primeira análise provisória foi feita em março deste ano e apresentou eficácia de 81%. Os resultados de segurança e eficácia da análise final estarão disponíveis em junho (21/04/2021). Fonte: G1
19/04/2021
Três profissionais de saúde receberam 30 μg da vacina BNT162b2 mRNA contra a COVID -19 da Pfizer, seguido por uma segunda dose idêntica, 21 dias depois. O sangue venoso foi coletado no início e em intervalos seriados, até 63 dias após. Todos os indivíduos eram soronegativos para SARS-CoV-2 no início do estudo. Os níveis de IgG total anti-RBD, anti-S1 / S2 e anti-RBD IgG aumentaram entre 91 e 368 vezes até 21 dias após a primeira dose da vacina, atingindo então um platô. Os níveis aumentaram ainda mais após a segunda dose, com pico no dia 35, mas então diminuindo ligeiramente e se estabilizando ∼50 dias após a primeira dose da vacina. Os níveis de IgA anti-S1 aumentaram entre 7 e 11 dias após a primeira dose, diminuíram ligeiramente antes da segunda dose, após o que os níveis aumentaram ∼24 vezes em relação ao valor basal. A cinética anti-RBD e anti-N / S1 IgM foi semelhante à do anti-S1 IgA, embora exibindo aumentos substancialmente mais fracos e picos modestos, apenas 4 a 7 vezes maior do que a linha de base. Foi observada inter-correlação altamente significativa entre Ig total anti-RBD, anti-S1 / S2 e anti-RBD IgG (todos r = 0,99), enquanto outros anticorpos anti-SARS-CoV-2 exibiram correlações mais baixas, embora ainda significativas. A concentração de proteína S no soro foi indetectável em todos os momentos. O estudo conclui que a vacinação com mRNA do BNT162b2 gera uma resposta imune humoral robusta, especialmente envolvendo IgG e IgA anti-SARS-Cov-2, ampliada pela segunda dose da vacina (12/04/2021) (Preprint). Fonte: Clinical Chemistry and Laboratory Medicine
Pesquisadores relatam os resultados em cinco pacientes que apresentaram trombose venosa e trombocitopenia 7 a 10 dias após o recebimento da primeira dose da vacina de vetor adenoviral ChAdOx1 nCoV-19 contra a COVID-19. Os pacientes eram profissionais de saúde com idade entre 32 e 54 anos. Todos os pacientes tinham níveis elevados de anticorpos para os complexos do fator 4-poliânion das plaquetas; no entanto, eles não haviam tido nenhuma exposição anterior à heparina. Como os cinco casos ocorreram em uma população de mais de 130.000 pessoas vacinadas, os pesquisadores propõem que eles representam uma variante rara da trombocitopenia espontânea induzida por heparina relacionada à vacina, à qual referiram como trombocitopenia trombótica imunológica induzida por vacina (09/04/2021). Fonte: The New England Journal of Medicine
Artigo relata que infecções COVID-19 caíram 60% na Inglaterra nos últimos dois meses. Os pesquisadores do Imperial College London sugerem que as infecções estão agora levando a menos internações e óbitos, o que provavelmente reflete o impacto do programa de vacinação. O estudo analisa os resultados dos testes de swab domiciliar realizados por 140.844 pessoas de 11 a 30 de março. Destes, 227 foram positivos, dando prevalência ponderada de infecção de 0,20%. Na rodada anterior do estudo, realizada de 4 a 23 de fevereiro, a prevalência nacional foi de 0,49%. A prevalência de infecção na Inglaterra está agora em um nível visto pela última vez no início de setembro de 2020 e se aproximando do nível no final do primeiro bloqueio na Inglaterra em maio de 2020. As crianças em idade escolar primária apresentaram o maior número de infecções (0,41%), enquanto as pessoas com mais de 65 anos tiveram a menor taxa (0,09%). Essas tendências provavelmente devem-se à reabertura das escolas em 8 de março de 2021 e ao programa de vacinação COVID-19 que se concentrou inicialmente em idosos e mais vulneráveis. O estudo também constatou que as pessoas que viviam nos bairros menos carentes apresentaram menor prevalência de positividade de swabs (0,13%), em comparação com 0,33% nos bairros mais carentes (08/04/2021). Fonte: BMJ
Pesquisadores do Instituto Nacional de Ciência e Tecnologia em Vacinas (INCTV) da Universidade Federal de Minas Gerais (UFMG) testam a potencial vacina do tipo quimera proteica contra a COVID-19. A expectativa é que até 40 mil voluntários participem dos testes clínicos. A pesquisa da potencial vacina contra a COVID-19 da UFMG está em testes pré-clínicos em animais, mas já apresentou bons resultados com grupos de camundongos e hamsters. Caso os testes avancem conforme o esperado, os pesquisadores esperam iniciar a pesquisa com humanos ainda em 2021 e estimam ter a fórmula pronta para o uso em 2022. Atualmente, o grupo de pesquisadores investiga a eficácia e segurança do imunizante do tipo quimera proteica em primatas não-humanos (macacos). Para as fases 1 e 2 do estudo clínico da vacina do tipo quimera proteica contra a COVID-19, a UFMG estima que será necessário o investimento de R$ 30 milhões dos cofres públicos (19/04/2021). Fonte: Canaltech
A Agência Nacional de Vigilância Sanitária (Anvisa) informou nesta segunda-feira (19) que aprovou, na última sexta-feira (16), um novo ensaio clínico de vacina contra a COVID-19. A vacina candidata terá duas doses com intervalo de 22 dias entre elas. O desenvolvimento clínico está sendo patrocinado pela empresa Sichuan Clover Biopharmaceuticals, sediada na China. O ensaio clínico aprovado é controlado por placebo, para avaliar a eficácia, imunogenicidade e segurança da vacina, em participantes a partir de 18 anos de idade. Nesta fase, devem ser incluídos até 22 mil voluntários distribuídos entre países da América Latina, além da África do Sul, Bélgica, China, Espanha, Polônia e Reino Unido. No Brasil, serão 12,1 mil voluntários, distribuídos nos estados do Rio Grande do Sul, Rio Grande do Norte e Rio de Janeiro (19/04/2021). Fonte: Agencia Brasil
As duas vacinas BBIBP-CorV e ZF2001 que vêm sendo desenvolvidas na China foram aprovadas para autorização de comercialização condicional. A BBIBP-CorV é uma vacina de vírus inativado e ZF2001 é uma vacina de proteína de domínio de ligação a receptor dimérico recombinante (RBD) atualmente em ensaios clínicos de fase 3 e aprovada para uso de emergência na China e no Uzbequistão. Ambas as vacinas mostraram boa imunogenicidade nos ensaios de fase 1 e 2 (13/04/2021). Fonte: The Lancet
16/04/2021
Pesquisadora revela que o EpiVacCorona, autorizado pela Rússia em outubro de 2020, começou a emergir da sombra do Sputnik V, trazendo polêmica. Desenvolvida pelo VECTOR, o Centro Estadual de Pesquisa de Virologia e Biotecnologia russo, a vacina é a chave para os planos do país para combater a pandemia. A Rússia começou a oferecer a vacina a um pequeno número de pessoas no ano passado e almeja uma campanha nacional maior. Mas apenas no final de março a VECTOR publicou alguns dados clínicos sobre o EpiVacCorona, que consiste principalmente em vários bits de proteína, ou peptídeos, do coronavírus pandêmico, e ainda não há evidências de que a vacina realmente protege as pessoas da COVID-19. Além disso, os participantes dos primeiros testes da vacina dizem que se testaram para os anticorpos que a vacina deve produzir e não encontraram nenhum (09/04/2021). Fonte: Science
Pesquisadores discutem as evidências que continuam a se acumular de que um distúrbio de coagulação incomum, observado em dezenas de receptores europeus decorrente da vacina da AstraZeneca contra a COVID-19, é um efeito colateral real e importante, embora raro. O Canadá e a Alemanha se juntaram à Islândia, Suécia, Finlândia e França na recomendação contra o uso da vacina em pessoas mais jovens, que parecem estar em maior risco para o problema de coagulação e são menos propensas a desenvolver COVID-19 grave. No mês passado, muitos países suspenderam seu uso após relatos iniciais de problemas de coagulação em receptores, que causaram pelo menos 15 mortes na Europa. Alguns pesquisadores rejeitaram os casos como níveis normais de coágulos sanguíneos. Entretanto, o potencial efeito colateral, foi discutido por especialistas da EMA, em 29 de março, mas a agência não divulgou nenhuma atualização pública imediata. A combinação altamente incomum de sintomas - coágulos sanguíneos disseminados e baixa contagem de plaquetas, às vezes associada a sangramento - foi relatada até agora em pelo menos sete países. Sociedades médicas em todo o mundo alertaram os membros para ficarem atentos ao distúrbio de coagulação em pessoas que receberam a vacina e relatá-lo (02/04/2021). Fonte: Science
Vários casos de eventos trombóticos incomuns e trombocitopenia desenvolveram-se após a vacinação com o vetor adenoviral recombinante que codifica o antígeno da proteína spike do SARS-CoV-2 (ChAdOx1 nCov-19, AstraZeneca). Neste estudo, pesquisadores avaliaram as características clínicas e laboratoriais de 11 pacientes na Alemanha e na Áustria nos quais a trombose ou trombocitopenia se iniciaram de 5 a 16 dias após a vacinação com ChAdOx1 nCov-19. Os eventos trombóticos incluíram trombose venosa cerebral (em 9 pacientes), trombose da veia esplâncnica (em 3 pacientes), embolia pulmonar (em 3 pacientes) e outros tipos de trombos (em 4 pacientes). 5 de 10 pacientes tiveram mais de um evento trombótico e um paciente (Paciente 11) apresentou hemorragia cerebral fatal. Os pesquisadores também encontraram evidências de coagulação intravascular disseminada em 5 dos pacientes com base na combinação de níveis de dímero-d muito elevados (> 10,0 mg por litro) e uma ou mais anormalidades na razão normalizada internacional, tempo de tromboplastina parcial ou fibrinogênio. A ativação plaquetária foi inibida por altos níveis de heparina, anticorpo monoclonal bloqueador do receptor Fc e imunoglobulina (10 mg por mililitro). Estudos adicionais com PF4 ou PF4–heparina e anticorpos purificados por afinidade com heparina em 2 pacientes confirmaram a ativação plaquetária dependente de PF4. O estudo conclui que a vacinação com ChAdOx1 nCov-19 pode resultar no raro desenvolvimento de trombocitopenia trombótica imune mediada por anticorpos ativadores de plaquetas contra PF4, que clinicamente mimetiza a trombocitopenia autoimune induzida por heparina. Saber se esses anticorpos são autoanticorpos contra PF4 induzidos por fortes o estímulo inflamatório da vacinação ou os anticorpos induzidos pela vacina que apresentam reação cruzada com o PF4 e as plaquetas requer um estudo mais aprofundado (09/04/2021). Fonte: The New England Journal of Medicine
Pesquisadores da Universidade de Oxford relataram que o risco da rara coagulação do sangue conhecida como trombose venosa cerebral (TVC) após a infecção por COVID-19 é cerca de 100 vezes maior do que o normal, várias vezes maior do que após a vacinação ou após a influenza. Os autores do estudo contaram o número de casos de TVC diagnosticados nas duas semanas após o diagnóstico de COVID-19, ou após a primeira dose de uma vacina. Em seguida, os comparou com as incidências calculadas de TVC após a gripe e o nível de fundo na população em geral. Eles relatam que a TVC é mais comum após COVID-19 do que em qualquer um dos grupos de comparação, com 30% desses casos ocorrendo na faixa dos 30 anos. Em comparação com as vacinas COVID-19 atuais, esse risco é entre 8-10 vezes maior e, em comparação com a linha de base, aproximadamente 100 vezes maior. Neste estudo com mais de 500.000 pacientes COVID-19, TVC ocorreu em 39 em um milhão de pacientes. Em mais de 480.000 pessoas que receberam uma vacina de mRNA COVID-19 (Pfizer ou Moderna), TVC ocorreu em 4 em um milhão. Foi relatado que a TVC ocorre em cerca de 5 em um milhão de pessoas após a primeira dose da vacina AZ-Oxford COVID-19. Em comparação com as vacinas de mRNA, o risco de um TVC de COVID-19 é cerca de 10 vezes maior. Em comparação com a vacina AZ-Oxford, o risco de TVC de COVID-19 é cerca de 8 vezes maior (15/04/2021). Fonte: University Oxford e OSF
Estudo sugere que a variante do coronavírus descoberta pela primeira vez na África do Sul é capaz de escapar de parte da proteção da vacina Pfizer-BioNTech. O estudo comparou quase 400 pessoas que haviam testado positivo para COVID-19, 14 dias ou mais após receberem uma ou duas doses da vacina, contra o mesmo número de pacientes não vacinados contra a doença e verificou que a variante sul-africana, B.1.351, foi encontrada em cerca de 1% de todos os casos de COVID-19 entre as pessoas estudadas. No entanto, entre os pacientes que receberam duas doses da vacina, a taxa de prevalência da variante foi oito vezes maior do que entre os não vacinados - 5,4% contra 0,7%, sugerindo que a vacina é menos eficaz contra a variante sul-africana, em comparação com o coronavírus original e uma variante identificada pela primeira vez na Grã-Bretanha que passou a compreender quase todos os casos de COVID-19 em Israel (09/04/2021). Fonte: medRxiv

A UFMG iniciou dia 13/04/2021 os testes em primatas de vacina contra o SARS-CoV-2 que está sendo desenvolvida pelo CT-Vacinas em parceria com a Fundação Oswaldo Cruz (Fiocruz), com financiamento do Ministério da Ciência, Tecnologia e Inovações (MCTI). Trata-se de um imunizante, batizado provisoriamente de Spintec, cuja plataforma tecnológica consiste na combinação de duas proteínas, entre elas a proteína S, que é utilizada pelo SARS-CoV-2 para invadir as células humanas. O composto formado pelas proteínas combinadas, também chamado de "quimera", é injetado no organismo e induz à resposta imune. De acordo com os pesquisadores do CT-Vacinas, a Spintec, entre as vacinas em desenvolvimento na UFMG, foi a que apresentou os melhores resultados nos testes pré-clínicos em camundongos. Por isso, teve a autorização para os testes com os primatas. “Os camundongos imunizados ficaram 100% protegidos, ou seja, nenhum veio a óbito ou adoeceu. Isso é o sinal da eficiência da vacina que esperam confirmar com os testes com os primatas”, segundo o pesquisador líder do projeto na UFMG (14/04/2021). Fonte: UFMG
A vacina BNT162b2 mRNA COVID-19 (Pfizer-BioNTech) está sendo utilizada internacionalmente para vacinação em massa de COVID-19. As evidências de proteção de dose única contra doenças sintomáticas encorajaram alguns países a optar por doses de reforço retardadas de BNT162b2, mas o efeito desta estratégia nas taxas de infecção assintomática por SARS-CoV-2 permanece desconhecido. Estudo avaliou o efeito da vacinação de primeira dose com BNT162b2 nas taxas de positividade do teste e encontraram uma redução de quatro vezes na infecção assintomática entre os profissionais de saúde ≥12 dias pós-vacinação. Esses dados fornecem evidências reais de proteção de curto prazo contra a infecção assintomática por SARS-CoV-2 após uma única dose da vacina BNT162b2, sugerindo que a vacinação em massa de primeira dose reduzirá a transmissão de SARS-CoV-2, bem como a carga da COVID-19 (08/04/2021). Fonte: eLife
14/04/2021
Com base em eventos adversos de ensaios clínicos de fase 3, a paralisia de Bell aparece como uma reação adversa atípica e rara das vacinas de RNA mensageiro (mRNA) COVID-19, levando à sua menção em seu resumo das características do produto. Embora a frequência da paralisia de Bell no grupo da vacina tenha sido considerada consistente com a taxa esperada na população em geral, seu desequilíbrio entre os grupos é intrigante. Dos 8 casos de paralisia de Bell, 7 ocorreram no grupo da vacina, enquanto apenas 1 ocorreu no grupo do placebo. Um caso em um participante que recebeu a vacina foi considerado grave. Todos os casos ocorreram logo após a injeção (ou seja, de 3 a 48 dias após a segunda dose). A paralisia de Bell foi resolvida em 2 casos e continuava ou estava sendo resolvida em 6 casos no corte de dados (02/04/2021). Fonte: Therapies
12/04/2021
Um ensaio clínico de fase 3 conduzido em profissionais de saúde no Brasil demonstrou que a vacina CoronaVac inativada tem um bom perfil de segurança e é eficaz contra qualquer infecção sintomática por SARS-CoV-2 e altamente protetora contra COVID-19 moderada a grave. O estudo clínico randomizado, duplo-cego, controlado por placebo com a vacina CoronaVac (estudo PROFISCOV) foi conduzido entre profissionais de saúde saudáveis em 16 centros no Brasil (ClinicalTrials.gov, NCT04456595). Os participantes receberam duas doses de vacina (3 μg em 0,5 mL) ou placebo nos dias 0 e 14. O desfecho primário de eficácia foi o número de casos de COVID-19 sintomáticos confirmados por RT-PCR 14 dias após a segunda dose da vacina. A prevenção da gravidade da doença foi o principal desfecho de eficácia secundária, e a incidência de eventos adversos até sete dias após a imunização foi o principal desfecho de segurança. 9.823 participantes receberam as duas doses e foram acompanhados por pelo menos 14 dias e, portanto, alcançaram a análise final de eficácia. Foram registrados 253 casos confirmados de COVID-19 na coorte: 85 casos (11,0/100 pessoas-ano) entre 4.953 participantes no grupo da vacina e 168 casos (22,3/100 pessoas-ano) entre 4.870 participantes no grupo placebo. A eficácia primária contra COVID-19 sintomática foi de 50,7%. A eficácia secundária contra casos que requerem assistência (pontuação ≥3) e casos moderados e graves (pontuação ≥4) foram de 83,7% e de 100%, respectivamente. Todos os 6 casos de COVID-19 grave ocorreram no grupo placebo. A incidência de reações adversas, principalmente dor no local de administração, foi maior no grupo da vacina (77,1%) do que no grupo placebo (66,4%). Houve 67 eventos adversos graves relatados por 64 participantes e todos foram determinados como não relacionados à vacinação, incluindo dois casos fatais. Em um subconjunto de participantes, os ensaios de anticorpos neutralizantes mostraram soroconversão semelhante e títulos médios geométricos contra variantes B.1.128, P.1 e P.2 (11/04/2021). Fonte: SSRN (preprint)
A administração de pelo menos uma dose de CoronaVac mostrou eficácia contra a infecção sintomática de SARS-CoV-2 no cenário de transmissão epidêmica P.1, ressaltando a necessidade de aumentar os esforços de vacinação em resposta à disseminação desta variante no Brasil e no mundo. O estudo realizado em Manaus com profissionais de saúde demonstrou que pelo menos uma dose de CoronaVac foi associada a uma redução de 0,50 vezes (eficácia da vacina ajustada, 49,6%) nas chances de infecção sintomática por SARS-CoV-2 durante o período de 14 dias ou mais após receber a primeira dose. A eficácia estimada de pelo menos uma dose da vacina contra qualquer infecção por SARS-CoV-2 foi de 35,1% no mesmo período (07/04/2021). Fonte: MedRxiv (preprint)
A Agência Europeia de Medicamentos está analisando quatro casos de pessoas que desenvolveram coágulos sanguíneos após receberem a vacina contra COVID-19 da Johnson & Johnson (J&J). Um caso ocorreu durante os ensaios clínicos e três já durante a vacinação nos Estados unidos, sendo um deles, fatal. Os casos serão investigados, mas não está claro se existe associação entre os eventos e a vacinação. A Agência também está investigando um efeito raro de sangramento que pode estar associado à vacina da AstraZeneca. Ambas as vacinas empregam tecnologia de vetor viral (09/04/2021). Fonte: Health Policy Watch
O ensaio clínico do grupo Com-Cov da Universidade de Oxford está estudando o uso de diferentes combinações de vacinas para COVID-19 aprovadas para a primeira e a segunda doses de imunização. Este estudo está sendo conduzido pelo Oxford Vaccine Group e realizado por uma rede de locais de teste em todo o Reino Unido. O estudo é financiado pela Vaccine Task Force e pelo National Institute for Health Research (NIHR). O objetivo deste ensaio é ver como o sistema imunológico das pessoas responde quando são iniciadas com um tipo de vacina e, em seguida, reforçadas com outro e ver quão boa é a resposta quando a segunda dose é separada da primeira dose por diferentes períodos de Tempo. No momento, as duas vacinas neste estudo são AstraZeneca (ChadOx1 nCoV-19) e Pfizer BioNTech (BNT162b2) (abril 2021). Fonte: COM-COV website
Revisão demonstra como está se dando o desenvolvimento de vacinas COVID-19 e destaca a eficácia e as reações de vacinação das vacinas autorizadas. Os mecanismos, armazenamento e especificação de dosagem de vacinas candidatas em estágio avançado de desenvolvimento também são revisados criticamente, juntamente com considerações para possíveis desafios. Embora o desenvolvimento de uma vacina esteja com progresso promissor, a população mundial terá que continuar a se adaptar ao “novo normal” e praticar distanciamento social e medidas de higiene, pelo menos até que vacinas eficazes estejam disponíveis para o público em geral (05/04/2021). Fonte: Vaccines

A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou dia 08/04 um novo ensaio clínico de vacina contra a COVID-19. O desenvolvimento do imunizante está sendo patrocinado pela empresa canadense biofarmacêutica Medicago R&D Inc, e pela empresa farmacêutica britânica GlaxoSmithKline (GSK). A vacina candidata usa tecnologia de partícula semelhante ao coronavírus (CoVLP). É composta da proteína S expressa em forma de partículas parecidas com vírus (VLPs), coadministradas com um adjuvante, em duas doses com intervalo de 21 dias entre as doses. O ensaio clínico aprovado é de fase 2/3, randomizado, cego para observador, controlado por placebo, para avaliar a segurança, eficácia e imunogenicidade da vacina, em adultos com 18 anos de idade ou mais (08/04/2021). Fonte: Agência Brasil
07/04/2021
Estudo verificou que indivíduos com infecção prévia de SARS‐CoV‐ 2 e uma única dose de vacina de mRNA seria imunologicamente equivalente a um esquema vacinal completo em indivíduos virgens. Nesse estudo profissionais de saúde (184) com infecção anterior de SARS ‐ CoV ‐ 2 foram amostrados antes da segunda dose da vacina e entre 7 e 10 dias após a segunda dose, assim como os individuos virgens de SARS‐CoV‐2. Os anticorpos contra SARS ‐ CoV ‐ 2 foram medidos usando o imunoensaio Elecsys® Anti ‐ SARS ‐ CoV ‐ 2 S. Dos resultados, verificou-se que os indivíduos infectados naturalmente com SARS‐CoV‐2 e com uma única dose de vacina de mRNA foi suficiente para atingir a imunidade (31/03/2021). Fonte: Journal Medical Virology
Artigo apresenta uma abordagem vacinômica para a nova vacina de múltiplos epítopos contra coronavírus-2 de síndrome respiratória aguda grave (SARS-CoV-2). A vacina proposta é composta por 526 aminoácidos e demonstrou ser antigênica no servidor Vaxigen (0,6194) e não alérgica no servidor Allertop. A solubilidade da construção da vacina era maior do que a solubilidade média fornecida pelo sol de proteína e servidores SOLpro. A engenharia de dissulfeto foi realizada para reduzir as regiões de alta mobilidade na vacina para aumentar a estabilidade. A ancoragem da construção da vacina com TLR4 demonstrou energia de ligação eficiente. A simulação imune forneceu resultados significativamente altos dos níveis de imunoglobulinas, células T auxiliares, células T citotóxicas e INF-γ. Após a clonagem, a proteína da vacina foi transcrita reversamente na sequência de DNA e clonada no vetor pET28a (+) para garantir a potência de tradução e a expressão microbiana. Os pesquisadores concluem que uma construção de vacina única a partir da proteína spike (S) e da poliproteína orf1ab contra os linfócitos B e T foi gerada com proteção potencial contra a pandemia. O presente estudo pode auxiliar no desenvolvimento de um protocolo terapêutico adequado para combater a infecção por SARSCoV-2 (25/03/2021). Fonte: BMC Immunology

A erradicação de doenças infecciosas foi alcançada apenas uma vez na história, em 1980, com a varíola. Desde 1988, esforços significativos foram feitos para eliminar os vírus da poliomielite, mas a erradicação ainda está fora de alcance. O surgimento da pandemia de SARS-CoV-2 destacou a capacidade de responder rápida e resolutamente a um surto potencial. Este vírus foi sintetizado mais rápido do que qualquer outro no passado e está resultando em vacinas antes que a maioria dos candidatos atenuados cheguem aos testes clínicos. O presente artigo de revisão mostra como a biologia sintética tem a oportunidade de demonstrar seu verdadeiro potencial e pode se firmar no mundo das vacinas (28/03/2021). Fonte: Vaccine
Um estudo feito com mais de 67 mil profissionais de saúde de Manaus aponta que a vacina CoronaVac tem 50% de eficácia contra P.1, variante brasileira do coronavírus identificada pela primeira vez na capital do Amazonas. De acordo com os dados preliminares, a efetividade foi confirmada 14 dias após a primeira dose. O estudo é realizado pelo grupo Vebra COVID-19, que envolve pesquisadores de instituições nacionais e internacionais e servidores da secretaria de saúde do estado do Amazonas e de São Paulo e das secretarias da saúde nos municípios de Manaus e São Paulo. Os dados relativos à efetividade completa, com as duas doses, ainda estão sendo coletados (07/04/2021). Fonte: G1
Artigo descreve anticorpos de ligação e neutralização provocados pela vacinação com mRNA1273 em 33 participantes adultos saudáveis acompanhados desde os testes de fase 1 em andamento, estratificados de acordo com a idade, aos 180 dias após a segunda dose de 100 μg (dia 209). Os resultados demonstraram que os anticorpos que foram provocados pela vacina mRNA-1273 persistiram durante 6 meses após a segunda dose, conforme detectado por três ensaios sorológicos distintos (06/04/2021). Fonte: NEJM
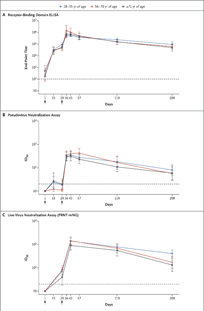
05/04/2021
Uma nova vacina para COVID-19 que está entrando em testes clínicos no Brasil, México, Tailândia e Vietnã, chamada NVD-HXP-S, é a primeira em ensaios clínicos a usar um novo desenho molecular que se espera criar anticorpos mais potentes do que a da atual geração de vacinas. Os desenvolvedores usaram técnicas padrão para fazer uma vacina MERS, mas acabaram com muitos picos pós-fusão e descobriram uma maneira de manter a proteína bloqueada em uma forma de pré-fusão semelhante à tulipa. Os pesquisadores transformaram dois dos mais de 1.000 blocos de construção da proteína em um composto chamado prolina. O pico resultante - chamado de 2P, para as duas novas moléculas de prolina que continha - tinha muito mais probabilidade de assumir a forma desejada de tulipa. Os pesquisadores injetaram os picos de 2P em camundongos e descobriram que os animais podiam facilmente combater infecções do coronavírus MERS. A potência da vacina trouxe um benefício extra: os pesquisadores precisaram de menos vírus para uma dose eficaz. Um único ovo pode render de cinco a 10 doses de NDV-HXP-S, em comparação com uma ou duas doses de vacinas contra a gripe (05/04/2021). Fonte: The New York Times
Pesquisadores debatem os estudos de infecção humana controlada (CHI), em que os participantes recebem uma vacina de teste e são inoculados 2–4 semanas depois com o patógeno de interesse pela via de administração mais fisiologicamente relevante. Segundo os pesquisadores, esses experimentos exigem apenas alguns meses para serem concluídos e o número de participantes inscritos é geralmente mais na casa das dezenas do que nos milhares necessários para os ensaios clínicos randomizados de fase 3 (RCTs). Estudos mostram que o papel das vacinas na limitação da circulação do vírus SARS-CoV-2 selvagem está em discussão. Esta pode ser uma das razões para considerar o CHI. Os modelos de CHI apresentam riscos inerentes: os participantes podem desenvolver doença grave ou complicações após infecção deliberada; o isolamento prolongado pode impactar negativamente seu bem-estar; a cepa experimental do vírus pode causar um surto na comunidade. No entanto, com estratégias de mitigação de risco adequadas, os riscos podem ser minimizados, começando com uma dose muito baixa e em população mais jovem. Entretanto, embora o risco na faixa etária mais baixa seja baixo, ele não é inexistente porque ainda não existe um tratamento de resgate contra a COVID-19. Ações para o desenvolvimento de um modelo CHI contra SARS-CoV-2 representariam um esforço amplo e sustentado de pesquisa para compreender a biologia do coronavírus e mitigar as pandemias atuais e potencialmente também futuras. Há também um impulso da sociedade civil; mais de 38.000 pessoas sinalizaram sua disposição de participar de estudos de CHI com a 1Day Sooner, uma organização sem fins lucrativos que defende esses voluntários (12/03/2021). Fonte: Frontiers in Immunology
31/03/2021
Um ensaio clínico vacina Pfizer-BioNTech demonstrou que a vacina pode ser considerada muito protetora em adolescentes. O estudo não encontrou infecções entre crianças vacinadas de 12 a 15 anos, além de não haver efeitos colaterais graves identificados. O ensaio envolveu 2.260 adolescentes de 12 a 15 anos de idade nos Estados Unidos. No ensaio, 18 casos de COVID-19 foram observados no grupo de placebo (n = 1.129) contra nenhum no grupo vacinado (n = 1.131). A vacinação com BNT162b2 desencadeou altos títulos de anticorpos neutralizantes de SARS-CoV-2, demonstrando forte imunogenicidade em um subconjunto de adolescentes um mês após a segunda dose (31/03/2021). Fonte: Pfizer
Embora os jovens sejam menos propensos a adoecer gravemente, médicos e cientistas concordam que vaciná-los é crucial para sua própria proteção e a da população em geral. E como as empresas já possuem dados sólidos de testes com adultos, estão realizando estudos menores em crianças que se concentram na segurança e nas respostas imunológicas às vacinas COVID-19. A Pfizer e a BioNTech concluíram o recrutamento de mais de 2.200 voluntários com idades entre 12 e 15 anos, e a Moderna está finalizando o recrutamento de 3.000 voluntários planejados com a mesma idade mínima. Ambas as vacinas são baseadas na codificação do RNA mensageiro para a proteína spike do coronavírus, que estimula a produção de anticorpos protetores. Outras três vacinas, que usam um vírus inofensivo para entregar um gene para a mesma proteína, também estão tomando medidas em direção à autorização pediátrica. Em 12 de fevereiro, a AstraZeneca e a Universidade de Oxford anunciaram que começariam a testar sua vacina em 300 crianças do Reino Unido com idades entre 6 e 17 anos. A Johnson & Johnson, diz que está se movendo para testes em jovens, e a Sinovac Biotech está testando seu produto em crianças na China com idades entre 3 e 17 anos. Nesse ínterim, pediatras, pais e outras pessoas têm que esperar. A Pfizer, por exemplo, espera abrir um julgamento em crianças de 5 a 11 anos dentro de alguns meses, e em menores de 5 anos ainda este ano. (26/02/2021). Fonte: Science
A Diretoria Colegiada da Anvisa (Dicol) concedeu autorização temporária para uso emergencial da vacina Janssen COVID19 Vaccine (Ad26.COV2-S, recombinante), desenvolvida pela Janssen, braço farmacêutico da Johnson & Johnson. A solicitação de uso emergencial foi feita pela empresa no dia 24 de março. A Anvisa concluiu, após a análise dos estudos apresentados, que a vacina protege contra a forma grave da doença e é eficaz para prevenção da COVID-19 em pacientes adultos. A vacina da Janssen é baseada em vetores de adenovírus sorotipo 26 (Ad26). É indicada para pessoas acima de 18 anos. O imunizante é aplicado em dose única de 0,5ml e demonstrou, nos testes apresentados, 66,9% de eficácia para casos leves e moderados e 76,7% de eficácia para casos graves, após 14 dias da aplicação. O prazo de validade é de três meses quando armazenado na temperatura entre 2°C a 8°C. Após aberto, o frasco pode ser utilizado em até seis horas (31/03/2021). Fonte: Anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) concedeu certificado de boas práticas a três fábricas envolvidas na produção da vacina contra a Covid-19 da Janssen, subsidiária da Johnson & Johnson, e a uma unidade fabril que participará da produção no Brasil da vacina russa Sputnik V. Segundo a Anvisa, receberam os certificados de boas práticas três empresas envolvidas nas etapas de insumo farmacêutico ativo, formulação e envase da vacina da Janssen. Já no caso da Sputnik V, foi certificada a fábrica localizada em Guarulhos (SP), pertencente ao Grupo União Química, que será responsável pelos processos de formulação, esterilização e envase do insumo farmacêutico ativo da vacina, que será fabricado em Brasília. Segundo a Anvisa, a União Química ainda não pediu a inspeção da fábrica que fará o IFA da vacina, pois ainda está em processo de transferência de tecnologia (30/03/2021). Fonte: O Globo
As vacinas para COVID-19 de diferentes plataformas diferem em eficácia, duração da proteção e efeitos colaterais. Para maximizar os benefícios da vacinação, estudo investigou a utilidade de empregar uma estratégia heteróloga de iniciação/reforço na qual foram testadas diferentes combinações dos quatro tipos de vacinas candidatas para COVID-19 em um modelo de camundongo. Os resultados mostraram que a imunização sequencial com vacina vetorizada de adenovírus seguida por administração de vacina inativada; de subunidade recombinante ou mRNA, aumentou especificamente os níveis de anticorpos neutralizantes e promoveu a modulação das respostas de anticorpos a anticorpos predominantemente neutralizantes. Além disso, um regime de iniciação/reforço heterólogo com uma vacina de vetor de adenovírus também melhorou as respostas de células T polarizadas por Th1. As vacinas testadas foram vacina de vetor viral (Ad5-nCoV: Cansino) (rAd), vacina inativada (BBIBP-CorV: Sinopharm) (INA), Vacina RBD recombinante (ZF2001: Zhifei) (rRBD), e vacina de mRNA (ARcoVax: Walvax) (mRNA). Os resultados fornecem novas ideias para o desenvolvimento e aplicação de vacinas COVID-19 para controlar a pandemia de SARS-CoV-2 (29/03/2021). Fonte: Emerging Microbes & Infections

Artigo apresenta uma nova formulação de vacina para COVID-19 constituída de uma combinação de proteína e DNA que forneceu proteção total contra SARS-CoV-2 em macacos rhesus. A nova combinação contém DNA que codifica a proteína spike (S) de comprimento total de SARS-CoV-2 além da proteína S1 recombinante. A vacina induziu altos níveis de anticorpos neutralizantes e respostas imunes de células T em modelos de animais pequenos e grandes. Mais significativamente, a co-entrega de componentes de DNA e proteína ao mesmo tempo provocou proteção total contra o desafio intratraqueal de vírus SARS-CoV-2 em macacos rhesus imunizados. Como as vacinas de DNA e de proteína foram provadas seguras em estudos humanos anteriores, e as vacinas de DNA são capazes de induzir o desenvolvimento de células B do centro germinativo, o que é crítico para as respostas das células B de memória de alta afinidade, a abordagem da vacina de co-entrega de DNA e proteína tem grande potencial para servir como uma abordagem segura e eficaz para desenvolver vacinas COVID-19 que fornecem proteção de longo prazo (01/03/2021). Fonte: Emerging Microbes & Infections
Estudo avaliou a imunogenicidade de vacinas de subunidades proteicas S e RBD em regimes homólogos ou heterólogos de iniciação/reforço em camundongos e primatas não humanos. Autores descobriram que S é altamente imunogênica em camundongos, enquanto que a imunogenicidade é comparativamente baixa de RBD e está associada com a limitação do centro germinativo e da atividade das células T foliculares auxiliares. O estímulo de camundongos S-primed com S ou RBD aumenta significativamente os títulos de neutralização, com o foco em RBD levando a uma melhora moderada na neutralização do soro. Em contraste, ambas as vacinas S e RBD são comparativamente imunogênicas em macacos, provocando atividade sorológica de neutralização que geralmente excede os níveis em humanos convalescentes. O estudo confirma as proteínas S recombinantes como candidatas a vacinas promissoras e destacam várias vias para alcançar uma neutralização sorológica potente (03/03/2021). Fonte: Nature
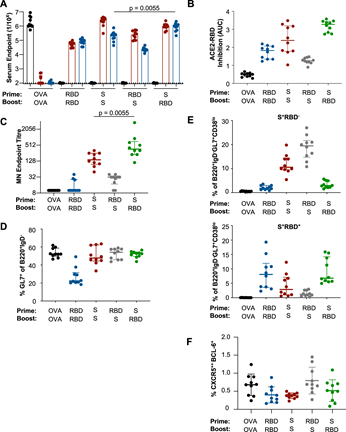
Artigo cita que os efeitos colaterais relatados das vacinas COVID-19 foram em sua maioria leves a moderados e não duraram mais do que alguns dias. Os efeitos colaterais típicos incluem dor no local da injeção, febre, fadiga, dor de cabeça, dor muscular, calafrios e diarreia. As chances de qualquer um desses efeitos colaterais ocorrerem após a vacinação variam de acordo com a vacina específica (31/03/2021). Fonte: OMS
Os autores apresentam um estudo in silico de proteômica subtrativa onde identificam sete proteínas (estruturais e não estruturais) do SARS-CoV-2 que têm um papel na adesão e infecção celular. Os diferentes epítopos foram previstos, e apenas epítopos extracelulares foram selecionados que não têm similaridade e reatividade cruzada com a célula hospedeira. Os epítopos finalizados de todas as proteínas com alergenicidade e toxicidade mínimas foram unidos usando ligantes para projetar diferentes construções de vacina (23/03/2021). Fonte: Biochemistry, Biophysiscs and Molecular Biology
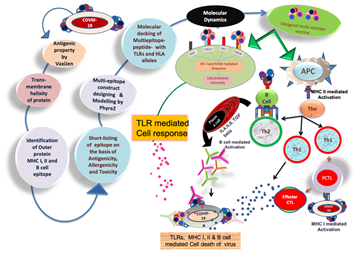
29/03/2021
Estudo avalia a imunogenicidade e reatogenicidade de vacinas que usam RNA mensageiro (mRNA) contra COVID-19 em mulheres grávidas e lactantes em comparação com: (1) controles não-grávidas e (2) infecção natural por COVID-19 na gravidez. 131 candidatas em idade reprodutiva (84 grávidas, 31 lactantes e 16 não grávidas) foram inscritas no estudo de coorte prospectivo. Os títulos de proteína S e RBD de SARS-CoV-2, IgG, IgA e IgM foram quantificados nos soros dos participantes (N = 131) e 96 leite materno (N = 31) no início do estudo, segunda dose da vacina e 2-6 semanas após a segunda vacina. Os títulos do soro do cordão umbilical (N = 10) foram avaliados no momento do parto. Os títulos foram comparados aos de mulheres grávidas com 4-12 semanas de infecção natural (N = 37) por ELISA. O estudo conclui que as vacinas de mRNA contra COVID-19 geraram imunidade humoral robusta em gestantes e lactantes, com imunogenicidade e reatogenicidade semelhante à observada em não gestantes. As respostas imunes induzidas pela vacina foram significativamente maiores do que a resposta à infecção natural. Além do mais, ao testarem amostras de sangue do cordão umbilical e do leite materno, notou-se que houve transferência de anticorpos delas para os recém-nascidos (22/03/2021). Fonte: American Journal of Obstetrics and Gynecology
Pesquisadores discutem sobre as novas variantes do SARS-CoV-2 e suas implicações Clínicas, em relação à saúde pública e vacinas (24/03/2021). Fonte: New Engl. J. Med

Análise feita pelo Centro de Controle e Prevenção de Doenças (CDC) dos EUA aponta que as vacinas da Pfizer e Moderna são altamente eficazes no controle da Covid-19 após 1ª dose e que o risco de infecção caiu 80% após a primeira dose em profissionais da linha de frente. Coortes prospectivas de 3.950 profissionais de saúde, socorristas e outros trabalhadores essenciais e de linha de frente foram submetidos a testes semanais para detecção do SARS-CoV-2 por 13 semanas consecutivas. A eficácia da vacina mRNA em condições de “vida real” após imunização completa (≥14 dias após a segunda dose) foi de 90% contra infecções pelo SARS-CoV-2, independentemente do estado dos sintomas; a eficácia da vacina da imunização parcial (≥14 dias após a primeira dose, mas antes da segunda dose) foi de 80%.Os dados reforçam os resultados apresentados durante os ensaios clínicos (29/03/2021). Fonte: CDC

A análise final de um ensaio clínico de fase III revelou que a vacina produzida pela Oxford University e AstraZeneca foi 79% eficaz na prevenção da COVID-19 sintomática e 100% eficaz na prevenção de doenças graves e internação hospitalar. Entre os 32.449 participantes, randomizados para grupos de vacina e placebo, no ensaio, que foi realizado nos Estados Unidos, Chile e Peru, houve 141 casos sintomáticos de COVID-19. As duas doses da vacina foram administradas com quatro semanas de intervalo. A descoberta de que a vacina tinha 80% de eficácia entre participantes com mais de 65 anos (um quinto do total no ensaio) fornece segurança depois que a Alemanha e alguns outros países europeus não aprovaram a vacina para uso nesta faixa etária, citando uma falta de dados. Cerca de 60% dos participantes com mais de 65 anos tinham comorbidades associadas a um risco elevado de doença COVID-19 grave, como diabetes, obesidade grave ou doença cardíaca. Uma revisão feita pelo conselho de monitoramento de segurança de dados independente do estudo e por um neurologista independente não encontrou risco aumentado de trombose ou eventos caracterizados por trombose entre os 21.583 participantes que receberam pelo menos uma dose da vacina. Também não houve eventos de trombose do seio venoso cerebral, uma condição que recentemente resultou em uma pausa no uso da vacina em alguns países. Muitos países retomaram seu programa de vacinação com a vacina Oxford-AstraZeneca depois que a Agência Europeia de Medicamentos concluiu que seu uso não foi associado a um risco aumentado de coágulos sanguíneos, embora alguns países, incluindo França, Dinamarca, Noruega, Suécia e Finlândia, não tenham retirado todas as suas restrições ao seu uso (22/03/2021). Fonte: BMJ
26/03/2021
O Instituto Butantan anunciou, nesta sexta-feira (26), que está desenvolvendo a Butanvac, nova candidata a vacina contra a COVID-19. A vacina é a primeira, contra qualquer doença, a ser desenvolvida completamente no Brasil. Segundo o diretor do instituto, os testes da vacina no país poderão começar em abril, assim que o instituto tiver a autorização da Anvisa para realização dos ensaios clínicos de fase 1 e 2. A Butanvac vai usar matéria-prima brasileira e será feita com as tecnologias de vírus inativado e de vetor viral. Um outro vírus – o da doença de Newcastle, da família do sarampo – foi modificado geneticamente para "carregar" um pedaço do coronavírus (proteina spike) dentro dele. Esse vírus recombinante é inoculado em ovos embrionados, onde será então replicado. Quando houver vírus em grande quantidade dentro do ovo, esses vírus serão retirados dali, inativados e fragmentados. A partir daí a proteína S é purificada. Esse é o chamado ingrediente farmacêutico ativo (IFA). O vírus de Newcastle não entra na composição da vacina. No dia 15, as primeiras pessoas receberam a vacina em Hanói, no Vietnã. O parceiro brasileiro no país é o Instituto de Vacinas e Biologia Médica vietnamita. O outro parceiro do Brasil é a Organização Farmacêutica Governamental da Tailândia. Lá, os testes em humanos devem ser iniciados em breve (26/03/2021). Fonte: G1
Pesquisadores desenvolveram duas vacinas para COVID-19 baseadas em vetores modificados do vírus da vaccinia Ancara (MVA) expressando toda a proteína S do SARS-CoV-2 (MVA-CoV2-S). A imunogenicidade da vacina foi avaliada em camundongos utilizando imunizações DNA/MVA ou MVA/MVA (prime/boost). Ambas as vacinas induziram respostas robustas, amplas e polifuncionais específicas de células T CD4+ (principalmente Th1) e CD8+, com um fenótipo de memória. As imunizações de DNA/MVA provocaram maiores respostas de células T. Todos os regimes vacinais desencadearam altos títulos de anticorpos IgG específicos para proteína S, bem como para o domínio de ligação ao receptor; a predominância do isótipo IgG2c foi indicativa de Imunidade Th1. Notavelmente, amostras de soro de camundongos vacinados neutralizaram o SARS-CoV-2 em culturas celulares, e as de imunizações de MVA/MVA mostraram maior capacidade de neutralização. Foi identificado que uma ou duas doses de MVA-CoV2-S protegem camundongos K18-hACE2 humanizados de uma dose letal de SARS-CoV-2. Além disso, duas doses de MVA-CoV2-S conferem inibição total da replicação do vírus nos pulmões. Esses resultados demonstram a imunogenicidade robusta e a eficácia total das vacinas para COVID-19 baseadas em MVA em modelos animais e apoiam futuros testes clínicos (10/03/2021). Fonte: J. Virology
Artigo apresenta um sistema de vacina de DNA à base de vetores baculovirais recombinantes contra os coronavírus MERS-CoV e SARS-CoV-2. Um baculovírus recombinante não replicante expressando o gene do envelope de retrovírus endógeno humano (AcHERV) foi construído como um vetor de vacina de DNA para entrega de genes em células humanas. Para a construção da vacina MERS-CoV, a codificação de DNA para a proteina S inteira, subunidade S1 ou domínio de ligação de receptor (RBD) foi inserida no genoma do AcHERV. Para a construção da vacina COVID-19, a codificação de DNA da proteina S inteira, ou S1 ou RBD do SARS-CoV-2 fundido pelo domínio MERS-CoV foi inserido no genoma do AcHERV. As vacinas acherv-DNA induziram alta imunidade humoral e bem como imunidade mediada por células em modelos animais. Em testes de desafio, duas doses de AcHERV-MERS-S1 e AcHERV-COVID19-S mostraram proteção completa contra MERS-CoV e SARS-CoV-2, respectivamente. Em conclusão, foram apresentadas evidências de que o AcHERV pode servir como uma plataforma de vacinas de MERS-CoV, bem como SARS-CoV-2, oferecendo várias vantagens como vetor de entrega de vacinas de DNA, como versatilidade, maior absorção celular e segurança. (19/03/2021). Fonte: NPJ Vaccines
A aprovação de duas vacinas de mRNA como tratamentos profiláticos urgentes contra Covid-19 tornou-se uma alternativa realista aos métodos convencionais de vacinação. No entanto, o mRNA desprotegido é rapidamente degradado pelo corpo e não pode penetrar efetivamente nas células. Vetores capazes de abordar esses problemas enquanto permitem o escape endossomal são, portanto, necessários. Até o momento, os vetores mais amplamente usados para essa finalidade têm sido os vetores à base de lipídios. Assim, neste trabalho, pesquisadores projetaram um vetor inovador denominado LipoParticles (LP), que consiste em nanopartículas de ácido poli (láctico) (PLA) revestidas com uma membrana lipídica DSPC / DOTAP 15/85 mol / mol. Esse método permitiu a adsorção de ácidos nucléicos na superfície do LP (principalmente por meio de interações eletrostáticas por meio da adição do peptídeo LAH4-L1, permitindo a penetração celular e o escape endossomal (12/03/2021). Fonte: Pharmaceuticals

Estudo monitorou a potência de neutralização de soros convalescentes de voluntários pós-vacinação com a Pfizer-BTN162b2 que exibiram neutralização contra as proteínas spike derivadas de SARS-CoV2 de tipo selvagem ou suas variantes UK-B.1.1.7 e SA-B.1.351. No entanto, enquanto os pseudovírus de tipo selvagem e UK-N501Y foram neutralizados de forma semelhante, aqueles que exibem mutações da proteína spike SA-N501Y / K417N / E484K resistem moderadamente à neutralização por soros covalescentes pós–vacinação por Pfizer-BTN162b2 (20/03/2021). Fonte: Cell Host &Microbe
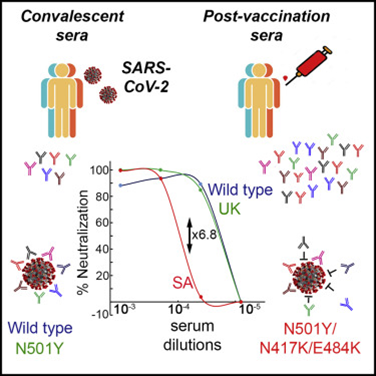
A Anvisa recebeu, nesta sexta-feira (26/3) pedido de uso emergencial da vacina da Sputnik V. O pedido foi feito pelo laboratório União Química, que representa, no Brasil, o Fundo Russo desenvolvedor do imunizante. A solicitação de análise do uso emergencial, protocolada na madrugada de sexta-feira, é um novo pedido. A Anvisa já iniciou a triagem dos documentos presentes no pedido (26/03/2021). Fonte: Anvisa
A Vacina Versamune®-CoV-2FC é um projeto de vacina para COVID-19 que combina a plataforma contra Covid-19 desenvolvida por empresa brasileira Farmarcore em parceria com companhia americana PDS Biotechnology Corporation. A vacina busca uma ativação imune com uma proteína de fusão recombinante (antígeno) desenvolvida pela Farmacore a partir do SARS-CoV-2 reconhecível pelo sistema imunológico. O perfil alvo da vacina é fornecer rápida indução de anticorpos neutralizantes, bem como células-T “killer” e células-T de memória contra o vírus SARS-CoV-2 (27/03/2021). Fonte: G1
24/03/2021
Medicago, uma empresa biofarmacêutica, e a farmacêutica GlaxoSmithKline (GSK) anunciaram o início dos testes clínicos de Fase 3 da vacina derivada de planta em combinação com o adjuvante pandêmico da GSK, como parte da Fase 2 / 3 estudo. A vacina candidata usa tecnologia de partícula semelhante ao coronavírus (CoVLP) e é composta da proteína S expressa em forma partículas semelhantes a vírus (VLPs) co-administradas com adjuvante pandêmico de GSK são administradas duas doses de 3,75 microgramas de CoVLP com 21 dias de intervalo (16/03/2021). Fonte: Medicago
Estudo de coorte retrospectivo demonstrou que a vacinação parcial com a vacina Pfizer-BioNTech COVID-19 foi associada a uma redução significativa no risco de infecção por SARS-CoV-2 entre residentes do centro de enfermagem especializada. Os resultados, juntamente com os achados de um estudo anterior entre populações de adultos mais velhos comparáveis em Israel que relataram proteção mais robusta após a segunda dose, sugerem que a vacinação completa de 2 doses é uma estratégia importante para prevenir COVID-19 nesta população afetada. Um estudo mais aprofundado desta população deve continuar à medida que tamanhos maiores de amostra se tornam disponíveis (19/03/2021). Fonte: Centers for Diasese Control and Prevention
A variante de preocupação VOC B.1.351 foi descoberta pela primeira vez na África do Sul no final de 2020, e causa preocupação global devido à má neutralização com propensão a evitar a imunidade pré-existente das cepas ancestrais. Pesquisadores testaram a eficácia de uma vacina de mRNA que codifica a proteína spike (CVnCoV) contra a cepa ancestral BavPat1 e o novo VOC B.1.351 em um modelo de rato transgênico K18-hACE2. Camundongos naive e camundongos imunizados com preparação de SARS-CoV-2 inativada por formalina foram utilizados como controles. Os camundongos imunizados por mRNA desenvolveram anticorpos específicos para RBD SARS-CoV-2 com títulos elevados, bem como altos títulos de neutralização contra a cepa ancestral BavPat1. Os títulos de neutralização contra o VOC B.1.351 foram facilmente detectáveis, mas significativamente reduzidos em comparação com o BavPat1. A vacina CVnCoV protegeu completamente os animais contra doenças e mortalidade causadas por qualquer cepa viral. Além disso, o SARS-CoV-2 não foi detectado em swabs orais, pulmão ou cérebro nesses grupos. Apenas a proteção parcial foi observada em camundongos que receberam a preparação do vírus inativado por formalina. Apesar de menores titulações de anticorpos neutralizantes em comparação com a cepa ancestral BavPat1, o CVnCoV mostra proteção completa contra doenças contra o novo VOC B.1.351 neste estudo (22/03/2021). Fonte: bioRxiv
Artigo descreve o EG-COVID, que é uma nova candidata a vacina de mRNA que codifica a proteína spike (S) de SARS-CoV-2 com substituição 2P-3Q na variante europeia baseada em liposoma. Foi desenvolvida a plataforma de vacinas mRNA que podem ser liofilizadas usando tecnologia baseada em liposoma. A injeção intramuscular do EG-COVID provocou uma resposta imune humoral e celular robusta ao SARS-CoV-2. Além disso, o soro obtido de camundongos inibiu com sucesso a infecção viral por SARS-CoV-2 em células Vero. Autores sugerem que, por ser uma vacina de mRNA liofilizada, EG-COVID é conveniente para o transporte e armazenamento, melhorando significativamente a acessibilidade às vacinas (22/03/2021). Fonte: bioRxiv
22/03/2021
Dados de testes clínicos de fase III da vacina de Oxford/AstraZeneca realizados dos EUA, Chile e Peru mostraram que a vacina é segura e altamente eficaz. O ensaio demonstrou que a vacina evitou completamente os piores resultados da COVID-19. Nenhum voluntário no estudo relatou problemas de segurança graves. Mais de 32.000 indivíduos participaram do ensaio, o maior até agora para a vacina AstraZeneca. Com base nesses resultados, a vacina foi 79% eficaz na prevenção de infecções sintomáticas e 100% eficaz na prevenção de doença severa e hospitalização. A vacina também ofereceu uma forte proteção para os idosos, que não haviam sido tão bem representados em estudos anteriores. Entre os participantes da análise aproximadamente 79% eram brancos/caucasianos, 8% negros/afro-americanos, 4% nativos americanos e 4% asiáticos e 22% dos participantes eram hispânicos. Aproximadamente 20% dos participantes tinham 65 anos ou mais e aproximadamente 60% tinham comorbidades associadas a um risco aumentado de progressão de COVID-19 grave, como diabetes, obesidade grave ou doença cardíaca. (22/03/2021). Fonte: AstraZeneca
Neste estudo, foi desenvolvida uma nova candidata à vacina de DNA contra SARS-CoV-2 codificando uma proteína quimérica do domínio de ligação ao receptor (RBD) da proteína S do SARS-CoV-2 fundida a uma sequência de 33 bps (11 aa) da região pré-S1 do vírus da hepatite B (HBV) com uma mutação W4P (W4P-RBD) na região n-terminal tendo sido avaliada a sua imunogenicidade. Experimentos de transfecção in vitro em múltiplas linhagens celulares demonstraram que a proteína W4P-RBD vs. wild-type (W-RBD) levou a uma produção aprimorada de IL-6 e TNFα nos níveis de transcrição e tradução, sugerindo o potencial adjuvante das sequências pré-S1 do terminal N para vacinas de DNA contra SARS-CoV-2. O W4P-RBD também levou a uma maior produção de IgG e IgA, que podem neutralizar e bloquear a infecção pelo SARS-CoV-2 tanto no soro quanto no fluido de lavagem broncoalveolar (BAL) do pulmão em camundongos vacinados. Além disso, o W4P-RBD levou a uma resposta imune celular mediada por células T sob a estimulação da proteína S1. Em resumo, o W4P-RBD gerou respostas imunes humorais e mediadas por células robustas contra SARS-CoV-2 em camundongos vacinados, destacando sua viabilidade como uma nova vacina de DNA para proteger contra a infecção pelo SARS-CoV-2 (26/02/2021). Fonte: Front. Immunol.
Em entrevista (Audio) realizada em 16 de março de 2021 os editores da NEJM discutem os resultados in vitro e clínicos da vacinação contra o SARS-CoV-2 em relação à eficácia frente às diferentes variantes do vírus (18/03/2021). Fonte: N. Engl. J. med.
19/03/2021
Estudo utilizou a tecnologia Trimer-Tag, para produzir tanto o S-Trimero selvagem (wild-type - WT) quanto o mutante (MT) para estudos de vacinas para COVID-19. As estruturas crio-EM dos S-Trimeros WT e MT, determinadas em 3,2 Å e 2,6 Å, respectivamente, revelaram que ambos os antígenos adotam uma conformação bem fechada e suas estruturas são essencialmente idênticas às da proteína S WT. A conformação bem fechada é estabilizada por ácido graxo e polisorbato 80 nos domínios de ligação do receptor (RBDs) e nos domínios N terminais (NTDs), respectivamente. Além disso, foi identificado uma importante mudança de pH no S-Trimero WT que mostra uma mudança conformacional dramática e explica sua maior estabilidade em pH mais baixo. Esses resultados validam a Trimer-Tag como uma tecnologia de plataforma na produção de S-Trimeros estáveis WT como candidato à vacina de subunidade para COVID-19 (10/03/2021). Fonte: J. Virology
O estudo envolveu cerca de 2.000 voluntários com idades entre 18 e 64 anos, que tiveram resultado negativo para HIV e foram designadas aleatoriamente para receber a vacina ChAdOx1 ou um placebo. A vacina, segundo os pesquisadores, parecia oferecer apenas 21,9% de proteção geral contra o desenvolvimento de COVID-19 leve ou moderado, e apenas 10,4% contra os casos causados pela variante B.1.351. Não houve casos de COVID-19 grave ou hospitalização em nenhum dos grupos, e o pequeno tamanho do ensaio significa que os pesquisadores podem concluir apenas que a vacina não teve uma eficácia acima de 60% contra B.1.351 (17/03/2021)(16/03/2021). Fonte: Nature e The New England Journal of Medicine
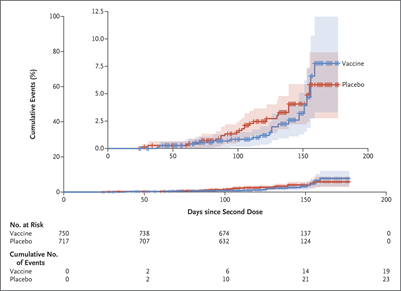
Estudo de imunogenicidade da primeira dose da vacina de mRNA SARS-CoV-2 entre receptores de transplante de órgão sólido mostrou que a maioria dos participantes não apresentou respostas de anticorpos anti-proteína S detectáveis. No entanto, os participantes mais jovens que incluia 436 voluntários, aqueles que não receberam imunossupressão de manutenção de antimetabólito e aqueles que receberam mRNA-1273 foram mais propensos a desenvolver respostas de anticorpos. Estes resultados contrastam com a robusta imunogenicidade precoce observada em ensaios de vacina de mRNA, incluindo 100% de soroconversão anti-spike no dia 15 após a vacinação com mRNA-12735 e no dia 21 após a vacinação com BNT162b2 (15/03/2021). Fonte: Jama
A autorização pelo FDA de uso de emergência de três vacinas nos EUA, todas as quais mostraram eficácia superior a 85% contra O SARS-CoV-2. A compilação imediata de dados in vitro que demonstram uma redução de até 10 vezes na atividade do anticorpo de neutralização (NAb) em amostras vacinadas contra o pseudovírus da proteína spike mutante, que é considerada uma métrica importante de imunidade adquirida. Embora os relatórios de redução de NAb sejam alarmantes em magnitude, a prova da eficácia da vacina só pode ser medida definitivamente desafiando os indivíduos vacinados com infecção (12/03/2021). Fonte: Science
Estudo avaliou a neutralização de uma série de pseudotipos de espículas mutadas com base na divergência de SARS-CoV e, em seguida, compararam a neutralização do pseudotipo de espículas B.1.1.7 e mutações individuais. A neutralização do anticorpo monoclonal específico para a proteína S é reduzida drasticamente; em contraste, os anticorpos policlonais de indivíduos infectados no início de 2020 permanecem ativos contra a maioria dos pseudotipos de proteínas S mutadas, mas a potência é reduzida em uma minoria das amostras. Este trabalho destaca que as mudanças na proteína S de SARS-CoV-2 podem alterar a sensibilidade da neutralização e destaca a necessidade de monitoramento efetivo em tempo real de mutações emergentes e seu efeito na eficácia da vacina (06/03/2021). Fonte: Cell Reports
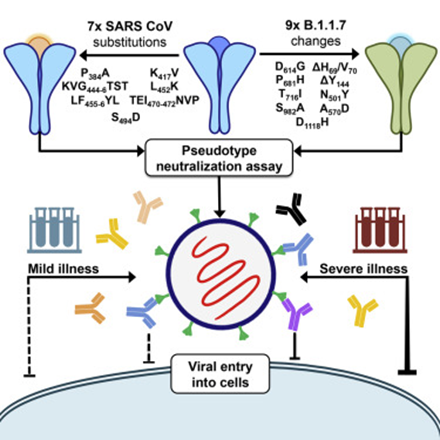
Embora altamente eficazes em prevenir a contaminação pelo SARS-CoV-2 original, as vacinas desenvolvidas pelas empresas de biotecnologia Pfizer/BioNTech e Moderna, ambas nos Estados Unidos, podem ser menos potentes no combate às novas variantes do coronavírus. É o que aponta um novo estudo liderado pelo Instituto Ragon do Hospital Geral de Massachusetts, do Instituto de Tecnologia de Massachusetts (MIT), e da Universidade Harvard. Para fazer os testes, foram usadas 10 versões sintéticas do SARS-CoV-2, que representavam as cepas do vírus espalhadas mundo afora. Cinco desses pseudovírus, por exemplo, apresentavam mutações no domínio de ligação ao receptor (RBD) da proteína spike – usada pelo novo coronavírus para infectar as células –, observadas na variante sul-africana B.1.351: K417N, E484K e N501Y. Quando os cientistas colocaram o soro dos participantes em contato com os pseudovírus, perceberam que a eficácia dos dois imunizantes foi significativamente reduzida. As três novas cepas descritas pela primeira vez na África do Sul eram entre 20 e 40 vezes mais resistentes à neutralização. E as duas cepas do Brasil e Japão eram de cinco a sete vezes mais resistentes, em comparação ao SARS-CoV-2 original (15/03/2021). Fonte: Galileu
17/03/2021
Neste artigo há uma revisão dos principais elementos que devem ser considerados para levar uma nova vacina do laboratório até o licenciamento na era moderna. Este artigo discute as respostas imunes do hospedeiro que envolve as vacinas; como se dão os estudos in vivo e in vitro; o projeto de vacinas; as diferentes modalidades de vacina que foram licenciadas ou estão em teste em humanos; e apresentam uma visão geral dos princípios básicos das aprovações de vacinas para COVID-19 (11/03/2021). Fonte: Clinical Pharmacology & Therapeutics
15/03/2021
Alemanha, França e Itália suspenderam temporariamente o uso da vacina COVID-19 da AstraZeneca na segunda-feira (15/03), juntando-se a uma lista crescente de nações que interromperam o uso da vacina nos últimos dias devido a preocupações de que ela pudesse estar ligada a coágulos sanguíneos. As principais agências de saúde pública, incluindo a Organização Mundial da Saúde, afirmam que milhões de pessoas receberam a vacina sem apresentar problemas de coagulação do sangue e alertam que os especialistas não encontraram uma relação causal entre a vacina e as condições. A empresa também defendeu a vacina como segura, em meio à enxurrada de suspensões. Tedros Adhanom Ghebreyesus, diretor-geral da W.H.O., acrescentou que as revisões dos efeitos colaterais das vacinas não são incomuns (15/03/2021). Fonte: The New York Times
Análise do laboratório Butantan realizada em parceria com a USP em que pesquisadores inocularam as variantes P.1. e P.2. em uma cultura celular que continha o soro de pessoas imunizadas com a Coronavac. Segundo os pesquisadores, os resultados foram satisfatórios (11/03/2021). Fonte: FAPESP
Pesquisadores discutem as vacinas COVID-19 de próxima geração: as vacinas de proteínas. Relatam que já está sendo testada em humanos uma vacina de subunidade da proteína spike trimérica estabilizada (SCB-2019). Essa vacina difere das já aprovadas por usar um trímero de proteína estabilizado como antígeno. Os pesquisadores usaram Trimer-Tag, uma proteína derivada do terminal C do procolágeno tipo I humano, que preserva a conformação trimérica da proteína spike SARS-CoV-2 e não foi usada anteriormente em ensaios clínicos (29/01/2021). Fonte: The Lancet
Estudo discute o futuro dos testes clínicos com novas vacinas candidatas para prevenir a COVID-19. Os candidatos à vacina contra o COVID-19 foram desenvolvidos a uma velocidade sem precedentes, com mais de 200 candidatos à vacina atualmente sob investigação. Desses, 20 candidatos ingressaram na fase clínica 3 para avaliar a eficácia, e três foram aprovados pela Agência Europeia de Medicamentos. No entanto, a medição da eficácia da vacina é desafiadora, pois os ensaios de eficácia precisam incluir grandes coortes incluindo placebo. No futuro, isso será ainda mais desafiador, pois outros candidatos à vacina receberão aprovação, um número crescente de indivíduos receberá vacinas e a incidência poderá diminuir. Para avaliar candidatos a vacinas novas e de segunda geração, ensaios randomizados controlados por placebo podem não ser mais apropriados. Correlações de proteção (CoP) podem ser uma ferramenta importante para avaliar novos candidatos à vacina, mas o COP induzido por vacinas não foi claramente definido para as vacinas para o SARS-CoV-2. Nesta revisão, são discutidas a imunogenicidade contra a infecção natural pelo SARS-CoV-2, as respostas imunes induzidas por vacinas e marcadores imunológicos que podem estar ligados à proteção. Ao discutir a imunogenicidade e a eficácia das vacinas precursoras, pretende-se dar uma visão geral abrangente das possíveis medidas de eficácia e CoP (10/03/2021). Fonte: Vaccines
Artigo apresenta os resultados da resposta de anticorpos após a vacinação com vacinas de mRNA em indivíduos que já haviam sido diagnosticados com COVID-19. Foi verificado que a amostragem após a primeira dose indica que a maioria dos participantes que não haviam tido COVID-19 apresentaram respostas variáveis e relativamente baixas de IgG para o SARS-CoV-2 dentro de 9 a 12 dias após a vacinação. Em contraste, os participantes com anticorpos SARS-CoV-2 na linha de base antes da primeira injeção de vacina rapidamente desenvolveram, títulos de anticorpos uniformes e elevados poucos dias após a vacinação. Os anticorpos de indivíduos com imunidade pré-existente eram de 10 a 45 vezes mais altos que os dos indivíduos sem imunidade pré-existente após a primeira dose da vacina. Os resultados foram similares para as vacinas da Pfizer e da Moderna. Apesar de verificado que uma única dose da vacina mRNA provocou respostas imunes rápidas em participantes soropositivos, com títulos de anticorpos pós-vacina que eram semelhantes ou excedidos em participantes seronegativos que receberam duas doses da vacina, a possibilidade de uma única dose de vacina mRNA fornecer proteção eficaz em pessoas soropositivas ainda requer investigação (10/03/2021). Fonte: The New Engl. J. Med
12/03/2021
A Anvisa aprova registro da vacina da Fiocruz/AstraZeneca contra o coronavírus. Segundo a Agência, foram concedidos dois registros diferentes para a vacina: um em nome da AstraZeneca e outro da Fiocruz. Desta forma, duas empresas podem adotar estratégias diferentes de distribuição e comercialização do produto. Mais conhecido como vacina de Oxford, o imunizante foi registrado na Anvisa com os nomes de "Vacina Covid19 Recombinante Fiocruz" e "Vacina Covid19 Recombinante. O pedido de registro da vacina da Fiocruz/AstraZeneca foi feito no dia 29/01. (12/03/2021). Fonte: Anvisa
As novas vacinas contra SARS-CoV-2 são novas em termos de especificidade, ampla disseminação pela população global e a inclusão de plataformas de mRNA recém-licenciadas. Neste artigo, pesquisadores discutem como as vacinas aprovadas ativam a imunidade inata para promover a memória imunológica durável e consideram as implicações futuras da proteção das populações com essas vacinas (05/03/2021). Fonte: Nature Reviews Immunology
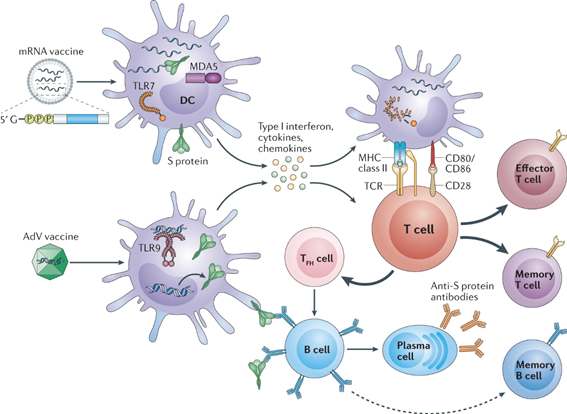
Neste estudo, pesquisadores geraram uma vacina de subunidade baseada no domínio de ligação ao receptor SARS-CoV-2 recombinante (RBD). Os camundongos foram imunizados por meio de inoculação intranasal, injeção intradérmica com microagulha ou injeção intramuscular, após o que as respostas imunes específicas de RBD foram comparadas. Os resultados mostraram que, quando administrada por via intranasal, a vacina induziu uma imunidade humoral sistêmica robusta com altos títulos de anticorpos IgG e anticorpos neutralizantes, bem como uma imunidade na mucosa significativa. Além disso, as respostas de células T antígeno-específicas também foram analisadas. Estes resultados indicaram que a administração intranasal não invasiva deve ser explorada para o futuro desenho da vacina SARS-CoV-2 (05/03/2021). Fonte: Vaccine
Novavax confirma altos níveis de eficácia da vacina NVX-CoV2373 contra cepas COVID-19 originais e variantes no Reino Unido e na África do Sul. Segundo a empresa, foi observada a eficácia final de 96,4% contra doenças leves, moderadas e graves causadas pela cepa original do SARS-CoV-2 em um teste de Fase 3 no Reino Unido. A empresa também anunciou a análise completa de seu teste fase 2b que ocorre na África do Sul que apresentou eficácia de 55,4% em uma região onde a grande maioria das cepas são variantes de escape B1.351. A eficácia contra a cepa variante B.1.1.7 foi de 89,7%. Em ambos os estudos, a NVX-CoV2373 demonstrou 100% de proteção contra doenças graves, incluindo internação e morte. O estudo envolveu mais de 15.000 participantes sendo 27% com idade acima de 65 anos (11/03/2021). Fonte: Novavax.
Em estudos laboratoriais, a variante B.1.351 revelou ser parcialmente resistente a anticorpos neutralizantes induzidos por 2 doses da vacina de RNA mensageiro (mRNA) da Pfizer, a vacina de mRNA Moderna e a vacina de proteína Novavax. Em 2 relatórios, os anticorpos séricos da vacina Pfizer de dose única não conseguiram neutralizar B.1.351. A extensão da resistência a B.1.351 varia entre os estudos, mas em 1 caso é bastante preocupante. Os anticorpos neutralizantes induzidos pela vacina de adenovírus AstraZeneca tiveram atividade muito baixa contra a variante B.1.351 e a vacina foi ineficaz na proteção contra esta cepa - um sério sinal de alerta sobre os problemas que os vírus resistentes podem representar (04/03/2021). Fonte: Jama
Pesquisadores avaliam eficácia das vacinas de RNA mensageiro para o COVID-19 em limitar a disseminação do COVID-19 por pessoas sem sintomas. Os pesquisadores analisaram retrospectivamente uma coorte de 39.000 pacientes submetidos a testes de triagem molecular pré-processual para COVID-19. Mais de 48.000 testes de triagem foram realizados, incluindo 3.000 testes de triagem em pacientes que receberam pelo menos uma dose de uma vacina de mRNA para COVID-19. Esses exames de triagem fizeram parte dos testes de rotina do COVID-19 antes de tratamentos não relacionados ao COVID-19, como cirurgias e outros procedimentos. Os pacientes do grupo vacinado receberam pelo menos uma dose da vacina de mRNA. Os pesquisadores encontraram uma redução de risco de 80% de testes positivos para COVID-19 entre aqueles com duas doses de uma vacina mRNA COVID-19, indicando que este tipo de vacina não só previne a doença como também diminui significativamente a transmissão do vírus (10/03/2021). Fonte: Clinical Infectious Diseases
Estudo indica que as células T, um elemento-chave do sistema imunológico, mantêm a potência contra quatro novas cepas do vírus SARS-CoV-2, incluindo a variante brasileira P.1. Foi realizada uma análise abrangente das respostas de células T CD4+ e CD8+ específicas do SARS-CoV-2 de indivíduos convalescentes da COVID-19 identificando a cepa ancestral, em comparação com as linhagens variantes B.1.1.7, B.1.351, P.1 e CAL.20C, bem como indivíduos que tomaram as vacinas contra a COVID-19 da empresa Moderna (mRNA-1273) ou Pfizer/BioNTech (BNT162b2). Da mesma forma, foi demonstrado que as sequências da grande maioria dos epítopos de células T para o SARS-CoV-2 não são afetados pelas mutações encontradas nas variantes analisadas. No geral, os resultados demonstram que as respostas das células T CD4+ e CD8+ em indivíduos convalescentes da COVID-19 ou que tomaram as vacinas de mRNA para COVID-19 não são substancialmente afetadas por mutações encontradas nas variantes do SARS-CoV-2 (01/03/2021). Fonte: bioRXiv
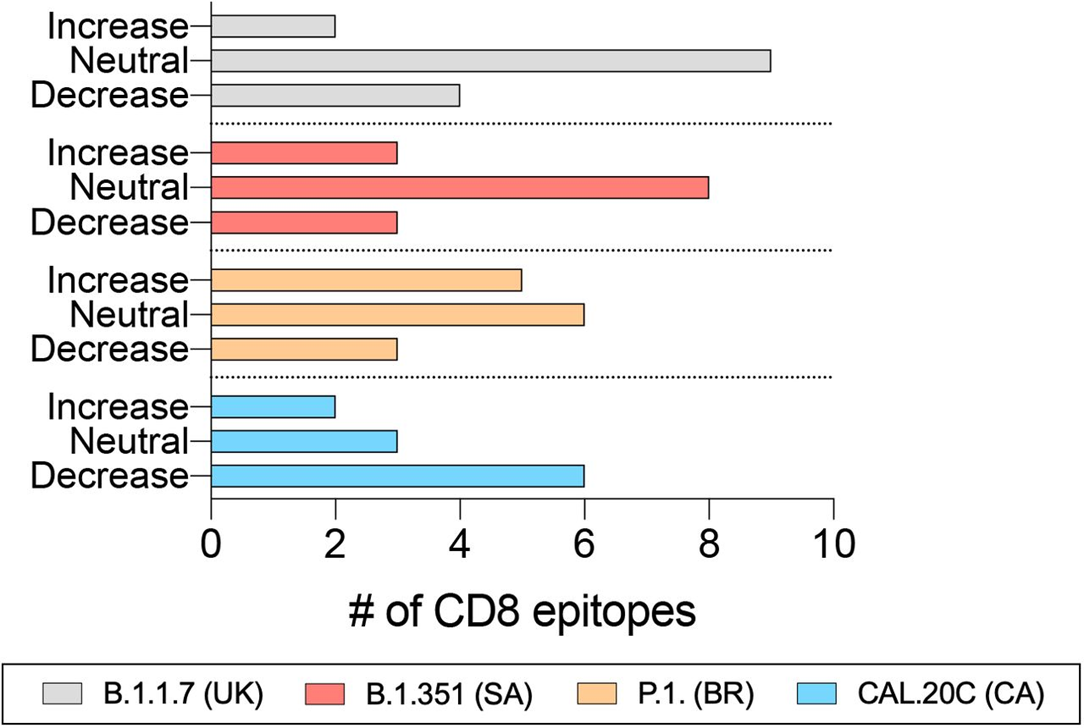
10/03/2021
Estudos mostram eficácia da CoronaVac contra três variantes do vírus SARS-CoV-2. Análises estão sendo feitas pelo Butantan em parceria com a USP. A conclusão de que o imunizante oferece proteção contra novas cepas do vírus SARS-CoV-2 foi obtida a partir de testes envolvendo pessoas vacinadas com a CoronaVac, inclusive na fase 3 dos estudos da vacina no Brasil (seriam 35 as amostras dos voluntários, de acordo com a nota). Os soros das pessoas vacinadas são testados frente a uma cultura de células e, posteriormente, infectadas com as variantes. A neutralização consiste em testar se os anticorpos gerados em decorrência da vacina vão neutralizar o vírus nesse cultivo (10/03/2021) Fonte: O Globo
Pesquisador discute o efeito esperado das vacinas contra a COVID-19. Segundo o artigo, a aplicação em massa de imunizantes permitirá saber se, além de proteger contra a doença, eles também serão capazes de evitar a infecção pelo SARS-CoV-2. O ideal seria que todas as vacinas impedissem a infecção pelo patógeno, mas, na prática, não é o que acontece. Entretanto, mesmo sem bloquear a infecção é possível cortar a transmissão e interromper a pandemia de COVID-19, uma vez que as vacinas existentes podem fazer com que se atinja a imunidade coletiva (situação em que a disseminação do vírus é contida), por haver poucas pessoas suscetíveis a contraí-lo. Especialistas comentam que também seria importante que as vacinas induzissem a produção de anticorpos neutralizantes do tipo IgA, encontrados nas superfícies das mucosas das vias respiratórias, portas de entrada do vírus no organismo, com capacidade de reconhecer o vírus (março/2021). Fonte: Revista Pesquisa FAPESP
A ciência brasileira está empenhada em produzir uma vacina própria para a COVID-19, mas os desafios para atingir esse objetivo são enormes – e não se limitam à obtenção de recursos para apoiar o desenvolvimento dos imunizantes. Artigo apresenta os centros de pesquisa do país que se dedicam ao desenvolvimento de uma vacina contra o novo coronavírus e destaca os desafios por eles enfrentados. Há cerca de 15 projetos de vacinas em andamento no país, sendo que pelo menos quatro deles devem iniciar nos próximos meses a fase de testes clínicos, em humanos. Uma característica comum dessas iniciativas, que ainda carecem de financiamento e precisam vencer uma série de obstáculos de ordem técnica e de produção para se viabilizar, é propor soluções tecnológicas capazes de fazer frente às constantes mutações do vírus. A iniciativa brasileira mais adiantada é coordenada pela Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), a startup paulista de biotecnologia Farmacore e o laboratório norte-americano PDS Biotechnology. Em meados de fevereiro, eles solicitaram à Anvisa autorização para o início do ensaio clínico da vacina Versamune-CoV-2FC. Avançam também outros três projetos, desenvolvidos pelo Instituto do Coração (InCor) da Faculdade de Medicina da USP (FM-USP), em São Paulo; pela Universidade Federal de Minas Gerais (UFMG), Fundação Oswaldo Cruz (Fiocruz), FMRP-USP e Instituto Butantan; e pela Universidade Federal do Rio de Janeiro (UFRJ) (08/03/2021). Fonte: Revista Pesquisa FAPESP
08/03/2021
Artigo demonstra que uma única dose da vacina BNT162b2 ou ChAdOx1 é capaz de reduzir a hospitalização em 80% na população com idade acima de 80 anos de 3 a 4 semanas após a vacinação. Uma única dose da BNT162b2 também foi capaz de reduzir 85% as mortes de indivíduos acima de 70 anos (02/03/2021). Fonte: The BMJ
Reportagem discute a vacina COVID-19 da Johnson & Johnson que foi autorizada pelos órgãos reguladores dos EUA, não requer uma injeção de reforço e pode simplificar a logística da vacinação em massa (01/03/2021). Fonte: Nature
05/03/2021
A empresa indiana Bharat Biotech anunciou nesta quarta-feira (03/03/2021) os resultados clínicos da fase 3 da vacina Covaxin, que demonstraram eficácia interina de 81% contra a COVID-19. Os dados foram coletados após testes em 25.800 participantes que receberam uma dose do imunizante ou placebo. Os estudos foram conduzidos em parceria com o Conselho Indiano de Pesquisa Médica (ICMR) e o Instituto Nacional de Virologia (NIV). Além da eficácia, a Covaxin demonstrou resposta imunológica significativa também contra as variantes do novo coronavírus. No estudo, 36 dos 43 casos foram registrados em participantes que receberam o placebo, em comparação com sete casos em pessoas que receberam a vacina. A Covaxin é usada por meio da aplicação de duas doses, a partir de vírus inativado. A vacina é apresentada em frascos multidoses, e pode ser armazenada em temperaturas que variam de 2ºC a 8ºC, de acordo com a fabricante. O imunizante é um dos dois que foram aprovados para uso emergencial pelo governo indiano (03/03/2021). Fonte: Agência Brasil
Artigo sugere que variante do SARS-CoV-2 B.1.1.7 é suscetível a anticorpos neutralizantes provocados por vacinas baseadas na proteína spike ancestral. A variante identificada pela primeira vez no Reino Unido, B.1.1.7 (também chamada de VUI202012/01), contém oito mutações na proteína spike com potencial para impactar a terapia de anticorpos, eficácia da vacina e risco de reinfecção. No estudo foi utilizado um ensaio de pseudovírus baseado em lentivírus para mostrar que a variante B.1.1.7 permanece sensível à neutralização, embora em níveis moderadamente reduzidos (~2 vezes), por amostras de soro de indivíduos convalescentes e receptores de duas vacinas diferentes baseadas na proteina S ancestral: mRNA-1273 (Moderna) e nanopartículas proteicas NVX-CoV2373 (Novavax). Alguns anticorpos monoclonais para o domínio de ligação ao receptor (RBD) da spike foram menos eficazes contra a variante, enquanto outros não foram afetados em grande parte. Esses achados indicam que o B.1.1.7 não é uma variante de fuga de neutralização que seria uma grande preocupação para as vacinas atuais, ou para um risco aumentado de reinfecção (29/01/2021). Fonte: bioRXiv
Artigo busca explicar como a vacina COVID-19 da Johnson & Johnson usa tecnologia existente que envolve um vírus chamado adenovírus, uma causa comum de infecções respiratórias. O DNA do adenovírus é modificado para produzir uma parte importante da partícula do vírus SARS-CoV-2, para a qual o corpo desenvolve uma resposta imunológica (01/03/2021). Fonte: Jama
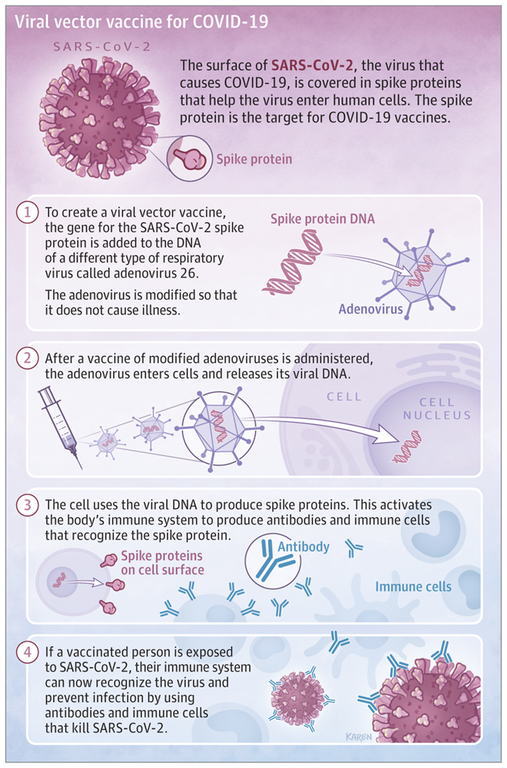
Artigo faz uma revisão das principais características e resultados das vacinas para COVID-19 autorizadas para o uso e outras que já tem dados disponíveis dos ensaios clínicos de nível mais avançado (26/02/2021). Fonte JAMA
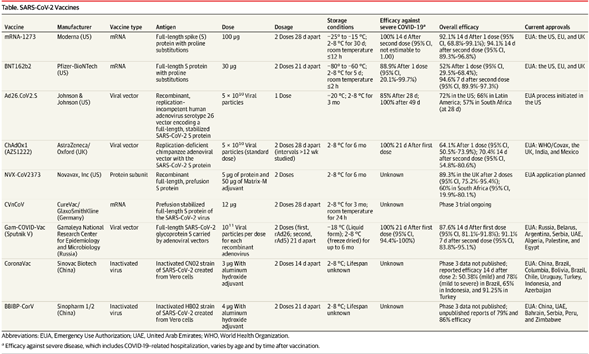
03/03/2021
A Public Health England (PHE) apresentou uma pré-impressão de um estudo que mostra que as vacinas Oxford/AstraZeneca e Pfizer são altamente eficazes na redução de infecções por COVID-19 entre pessoas com 70 anos ou mais. Ambas as vacinas apresentaram cerca de 60% de proteção contra infecção sintomática nessa faixa etária (01/03/2021). Fonte: University Oxford
01/03/2021
Revisão descreve o desenvolvimento de vacinas para a COVID-19 baseadas em vetores virais. Além dos vetores à base de adenovírus, outros vetores virais baseados em vírus da vaccinia, vírus do sarampo, rabdovírus, vírus da gripe e lentivírus foram submetidos ao desenvolvimento de vacinas. Vetores auto-amplificadores do RNA viral têm sido utilizados também para a entrega, à base de nanopartículas lipídicas, de RNA como vacinas para COVID-19. Vários candidatos à vacina à base de adenovírus provocaram fortes respostas imunes em animais imunizados e a proteção contra desafios em camundongos e primatas foi alcançada (19/02/2021). Fonte: Viruses
Artigo apresenta os resultados de ensaio de fase I, randomizado, duplo-cego controlado por placebo na Austrália que avaliou a segurança e imunogenicidade do S-Trímero (SCB-2019), candidato à vacina de subunidade proteica para COVID-19. Foram avaliados 151 voluntários adultos saudáveis em duas faixas etárias: adultos mais jovens (18 a 54 anos) e idosos (55 a 75 anos). Os participantes receberam duas doses de SCB-2019 (3 μg, 9 μg ou 30 μg) ou um placebo (0·9% NaCl) com 21 dias de intervalo. O SCB-2019 foi testado sem adjuvante (proteína S-Trímero sozinha) ou foi conjugada com AS03 ou CpG/Alum. A vacina formulada com adjuvantes AS03 ou CpG/Alum, provocou respostas imunes humorais e celulares robustas contra SARS-CoV-2, com alta atividade de neutralização viral. Ambas as formulações de vacinas adjuvantes foram bem toleradas e são adequadas para o desenvolvimento clínico (26/02/2021). Fonte: The Lancet
Os autores avaliam a queda de mortalidade na população inglesa, na faixa etária de pessoas com mais de 80 anos e apontam uma queda de 62% nós óbitos e fazem uma análise correlacionando com a vacinação (19/02/2021). Fonte: BMJ
O FDA aprovou formalmente neste sábado (27/02/2021) a vacina da Johnson&Johnson contra a Covid-19, corroborando a decisão anunciada por um comitê de especialistas. A vacina da Johnson&Johnson é a primeira entre as aprovadas nos EUA que exige a aplicação de apenas uma dose, em vez de duas. Os primeiros lotes devem chegar ao país nos próximos dias. A vacina é de vetor viral não replicante e seu armazenamento deve ser feito em temperatura entre 2 a 8°C, ou seja, pode ficar guardada em qualquer refrigerador comum. Testes clínicos mostraram que sua eficácia global é de 66% e, nos EUA, de 72%. A duração da imunidade, porém, ainda é desconhecida (27/02/2021). Fonte: O Globo
Com o objetivo de agilizar a vacinação no Brasil, universidades brasileiras e institutos de pesquisas também estão na corrida para o desenvolvimento de um imunizante nacional. Hoje, a UFMG trabalha com sete projetos: cinco no CTVacinas, parceria estabelecida entre a UFMG, o Instituto René Rachou da Fundação Oswaldo Cruz (Fiocruz-Minas) e o Parque Tecnológico de Belo Horizonte (BH-TEC), e duas no Instituto de Ciências Biológicas (ICB). No CTVacinas, são três imunizantes que utilizam plataformas de vetores virais, um baseado em proteína recombinante e outro que utiliza DNA. Já no ICB, uma das vacinas desenvolvidas utiliza RNA, e a outra, bacilos de Calmette-Guérin (BCG). As sete vacinas estão na fase de estudos pré-clínicos, aquela em que os pesquisadores avaliam a sua imunogenicidade, níveis de proteção e segurança do imunizante em animais (01/03/2021). Fonte: UFMJ
26/02/2021
Vacina em spray nasal em desenvolvimento pela USP contra COVID-19 pode estimular forte resposta local. A produção é descomplicada e 100% nacional. Além disso, vacina é extremamente adaptável às diferentes variantes e pode ser guardada em temperatura ambiente. A meta é que a vacina comece a ser testada em humanos ainda este ano (10/02/2021). Fonte: Jornal da USP
As vacinas Pfizer BioNTech e Oxford AstraZeneca levaram a uma queda substancial nos casos graves de COVID-19 que requerem internação hospitalar na Escócia, sugerem os resultados do primeiro estudo a relatar o impacto da estratégia de vacinação do Reino Unido. Os resultados, disponíveis como pré-impressão, mostraram que quatro semanas após as primeiras doses das vacinas Pfizer BioNTech e Oxford AstraZeneca terem sido administradas, o risco de hospitalização de COVID-19 caiu em até 85% e 94% respectivamente (22/02/2021). Fonte: The BMJ
Em carta ao editor, pesquisadores comentam que a eficácia da vacina BNT162b2 (Pfizer – BioNTech) contra a COVID-19 é de 94,8% após duas doses. Mesmo antes da segunda dose, o BNT162b2 é altamente eficaz, com eficácia de 92,6%, semelhante à eficácia da primeira dose de 92,1% relatada para a vacina de mRNA-1273 (Moderna). Segundo os pesquisadores, com essa primeira dose altamente protetora, o escasso suprimento de vacina poderia ser maximizado adiando as segundas doses até que todos os membros do grupo prioritário recebam pelo menos uma dose. Pode haver incerteza sobre a duração da proteção com uma única dose, mas a administração de uma segunda dose dentro de 1 mês após a primeira, conforme recomendado, oferece pouco benefício adicional a curto prazo. Dada a atual escassez de vacina, o adiamento da segunda dose é uma questão de segurança nacional que, se ignorada, certamente resultará em milhares de hospitalizações e mortes relacionadas à COVID-19 que teriam sido evitadas com a primeira dose da vacina (17/02/2021). Fonte: NEJM
Pesquisadores utilizaram de uma plataforma de vacina para gerar a proteína chaperona de choque térmico celular, glicoproteína 96 (gp96), para entregar a proteína S do SARS-CoV-2 (spike) ao sistema imunológico e induzir respostas imunológicas mediadas por células. Mostraram que a plataforma de vacina estimula efetivamente uma resposta imune celular robusta contra a proteína S (26/01/2021). Fonte: Frontiers
24/02/2021
A Agência Nacional de Vigilância Sanitária (Anvisa) concedeu o registro definitivo à vacina contra a COVID-19 desenvolvida pela farmacêutica norte-americana Pfizer em parceria com a empresa de biotecnologia alemã BioNtech. A análise para a liberação do imunizante pela Anvisa levou 17 dias. A vacina é a primeira a obter o registro definitivo no Brasil. O imunizante se chama Cominarty, entretanto, ainda não está disponível no país. De acordo com a Anvisa, o registro “abre caminho para a introdução no mercado de uma vacina com todas as salvaguardas, controles e obrigações resultantes dessa concessão” (23/02/2021). Fonte: Agencia Brasil
Em dezembro de 2020, o governo israelense aprovou a vacina BNT162b2 para a COVID-19 e iniciou uma campanha nacional de imunização priorizando profissionais de saúde, como em outros países. Esta campanha coincidiu com uma terceira onda de COVID-19, com pico de 10.116 novos casos diários em meados de janeiro de 2021. O Sheba Medical Center, o maior hospital de Israel com 9.647 profissionais de saúde, começou a vacinação da equipe em 19 de dezembro de 2020. Todos os profissionais de saúde, excluindo aqueles com infecção anterior por SARS-CoV-2, foram elegíveis para vacinação. Em estudo recente, os pesquisadores examinaram as reduções iniciais nas taxas de infecção por SARS-CoV-2 e COVID-19 nos profissionais de saúde vacinados. Em comparação com uma taxa de COVID-19 sintomática de 5,0 por 10.000 pessoas-dia em profissionais de saúde não vacinados, as taxas de doença foram de 2,8 e 1,2 por 10.000 pessoas-dia nos dias 1-14 e dias 15-28 após o primeira dose da vacina BNT162b2, respectivamente. As reduções ajustadas da taxa de doença COVID-19 foram 47% e 85% para os dias 1-14 e 15-28 dias após a primeira dose, respectivamente. Os dados mostram reduções iniciais substanciais na infecção por SARS-CoV-2 e taxas de COVID-19 sintomáticas após a administração da primeira dose da vacina. Os pesquisadores concluem que as reduções precoces das taxas de COVID-19 fornecem suporte para o adiamento da segunda dose em países que enfrentam escassez de vacinas e recursos escassos, de modo a permitir maior cobertura da população com uma única dose. Um acompanhamento mais longo para avaliar a eficácia em longo prazo de uma única dose é necessário para informar uma segunda política de retardo de dose (18/02/2021). Fonte: The Lancet
Anvisa divulga Painel com o andamento da análise de registro e uso emergencial das vacinas para COVID-19. O painel apresenta a porcentagem relativa ao status de submissão de cada um dos relatórios e informações necessários à análise de autorização, o painel é atualizado periodicamente (23/02/2021). Fonte: Governo Brasileiro
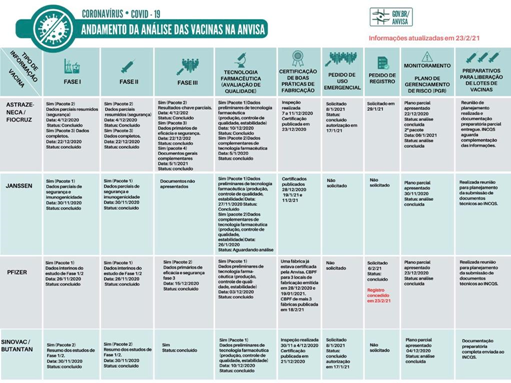
Em breve relato, pesquisadores demonstraram que a resposta de anticorpos à primeira dose de vacina de RNAm em indivíduos com imunidade pré-existente é igual ou ultrapassa os títulos encontrados em indivíduos sem infecção prévia, após a segunda dose da vacina. Também relataram maior reatogenicidade em indivíduos previamente infectados com SARS-CoV-2. O estudo sugere que a administração de uma dose única da vacina a estes indivíduos não impactaria negativamente seus títulos de anticorpos, poupando-os de dores desnecessárias e liberando muitas doses de vacina com urgência (01/02/2021). Fonte: MedRxiv.
A escassez de vacinas contra COVID-19 levou alguns especialistas e países a considerar a adoção de regimes de dosagem não testados. O estudo com 59 voluntários comparou a resposta de anticorpos a uma única dose das vacinas Pfizer-BioNTech ou Moderna em profissionais de saúde (PS) com infecção prévia por COVID-19 em relação à resposta de PS sem COVID-19 prévia. PS com COVID-19 anterior mostraram respostas claras de anticorpos secundários à vacinação aumentando rapidamente em 7 dias e com pico nos dias 10 e 14 pós-vacinação. Em todos os pontos de tempo testados, PS com infecção anterior por COVID-19 mostraram títulos de anticorpos mais altos estatisticamente significativos em comparação com PS sem infecção anterior por COVID-19. Os achados sugerem, preliminarmente, a adoção de estratégia de uma única dose da vacina para pacientes que já tiveram COVID-19 confirmado em laboratório (01/02/2021). Fonte: MedRxiv.
A Agência de Alimentos e Medicamentos (FDA) dos Estados Unidos publicou o documento afirmando que a vacina produzida pela Johnson&Johnson, administrada em dose única, oferece alta proteção contra os casos graves e mortes por COVID-19, inclusive contra a variante sul-africana, além de reduzir a transmissão do vírus nos vacinados (24/02/2021). Fonte: Washington Post
Vice-presidente de Produção e Inovação em Saúde da Fiocruz afirma que em abril deve-se iniciar o processo de nacionalização da vacina produzida pela Fundação. Com produção 100% nacional ainda no primeiro semestre (22/02/2021). Fonte: UOL
22/02/2021
Uma análise agrupada de quatro ensaios clínicos randomizados apresenta o efeito da administração de dose única e a influência da dose de reforço na imunogenicidade e eficácia da vacina ChAdOx1 nCoV-19 (AZD1222). Os pesquisadores relataram uma análise primária completa pré-especificada da eficácia da vacina ChAdOx1 nCoV-19 mais de 14 dias após uma segunda dose, com 332 casos sintomáticos de COVID-19 em uma população de análise de 17.178 participantes do estudo e uma eficácia de 66,7%, confirmando os resultados da análise provisória publicada. Nesta análise atualizada, não houve admissões hospitalares adicionais ou casos de COVID-19 grave no grupo vacinado com ChAdOx1 nCoV-19 após o período inicial de 21 dias após a vacinação, em comparação com 15 no grupo de controle. Em análises exploratórias, uma única dose padrão de ChAdOx1 nCoV-19 teve uma eficácia de 76,0% contra COVID-19 sintomático nos primeiros 90 dias após a vacinação, sem diminuição significativa de proteção durante este período. Não está claro por quanto tempo a proteção pode durar com uma única dose, pois o acompanhamento se limita aos períodos de tempo descritos neste estudo e, por isso, uma segunda dose da vacina é recomendada. Uma segunda dose de ChAdOx1 nCoV-19 induz níveis aumentados de anticorpos neutralizantes e é provavelmente necessário para proteção duradoura. Com as evidências disponíveis até o momento, prevê-se que uma segunda dose ainda seja necessária para potencializar a imunidade de longa duração. Neste estudo, a eficácia da vacina após a segunda dose foi maior naqueles com um intervalo de injeção de reforço mais longo, atingindo 81,3% naqueles com um intervalo de dosagem de 12 semanas ou mais versus 55,1% naqueles com um intervalo menor de 6 semanas. A eficácia da vacina ligeiramente inferior contra COVID-19 sintomático de 66,7% após uma dose de reforço parece contra-intuitiva em comparação com a eficácia de 76% após uma dose única, embora essas diferenças não sejam significativas. Segundo os pesquisadores, os casos incluídos nas estimativas de dose única ocorreram no início do ano diferente daqueles incluídos nas análises pós-segunda dose, e a intensidade da epidemia variou nos diferentes países, tornando as estimativas de dose única e duas doses difíceis de comparar diretamente. Os resultados apresentados neste estudo para a vacina ChAdOx1 nCoV-19 são consistentes com as recomendações de políticas em diferentes países para usar intervalos de dosagem de 4–12 semanas para esta vacina (19/02/2021). Fonte: The Lancet
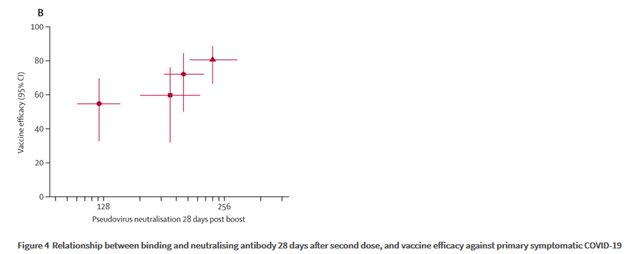
Em artigo, pesquisadores discutem as variantes do SARS-CoV-2 e fim da pandemia da COVID-19. Em conclusão afirmam que o recente surgimento de variantes do SARS-CoV-2, após um período de relativa estabilidade genética viral, é um motivo de preocupação, uma vez que múltiplas novas variantes de escape podem surgir no futuro e levar a uma grave repercussão da epidemia, como visto na África do Sul. O aumento da transmissão viral cria maiores oportunidades para o surgimento de variantes do SARS-CoV-2. Portanto, o fim da pandemia só é possível quando as vacinas eficazes contra as variantes circulantes são distribuídas de forma equitativa em todo o mundo. Conforme os países de alta renda correm para imunizar suas populações em poucos meses, eles se tornam vulneráveis ao SARS-CoV-2, evoluindo em outros países para uma nova linhagem contra a qual as vacinas podem não proteger. A formulação repetida de novas vacinas pode ser necessária para controlar algumas novas variantes do SARS-CoV-2. Com o aumento do número de reprodução básica de variantes mais transmissíveis do SARS-CoV-2, será necessária uma cobertura vacinal mais alta para atingir a imunidade coletiva, e a vacinação de crianças também pode ser necessária para atingir essa cobertura (11/02/2021). Fonte: The Lancet
A Rússia aprovou, neste sábado, uma terceira vacina contra a COVID-19 para uso doméstico, afirmou o primeiro-ministro Mikhail Mishustin na TV estatal, embora os ensaios clínicos em grande escala do imunizante, rotulado CoviVac e produzido pelo Centro Chumakov, ainda não tenham começado. Ao contrário da Sputnik V, que usa um vírus do resfriado inofensivo modificado, a vacina CoviVac é uma vacina feita de um coronavírus que foi inativado ou que perdeu sua capacidade de se replicar. A CoviVac é administrada em duas doses, com 14 dias de intervalo. Ela deve ser transportada e armazenada em temperaturas normais de geladeira, de 2 a 8ºC (20/02/2021). Fonte: O Globo
A Pfizer e a BioNTech anunciaram que espera iniciar estudos da vacina contra a COVID-19 em crianças de cinco a 11 anos nos próximos meses, de acordo com um comunicado à imprensa. As empresas disseram que também têm planos de estudar a vacina em crianças menores de cinco anos ainda neste ano (18/02/2021). CNN Brasil
A Pfizer e a BioNTech iniciaram um estudo internacional com 4 mil voluntários para avaliar a segurança e a eficácia de sua vacina contra a COVID-19 em mulheres grávidas saudáveis (18/02/2021). Fonte: CNN Brasil
O primeiro estudo a descrever os efeitos em comunidades do mundo real da vacina contra o coronavírus Oxford foi relatado em uma publicação pré-impressa, mostrando uma redução clara no risco de hospitalização por COVID-19 entre aqueles que receberam a vacina. Com base em dados de 1,14 milhões de vacinações que foram administradas, cientistas da Universidade de Edimburgo demonstraram que as vacinas BioNtech / Pfizer e Oxford são altamente eficazes e que na quarta semana após receber a dose inicial mostrou reduzir o risco de hospitalização de COVID-19 em até 85% e 94%, respectivamente (22/02/2021). Fonte: University Oxford e Universidade de Edimburgo
Artigo discute a importância do desenho de vacinas baseadas em anticorpos amplamente neutralizantes. Considerando o surgimento de novas variantes, faz-se necessária uma abordagem alternativa para o desenvolvimento de novas vacinas. Uma classe especial de anticorpos protetores denominados anticorpos amplamente neutralizantes (ver ‘Vacinas pan-vírus’) atua contra muitas cepas diferentes de vírus relacionados - por exemplo, HIV, influenza ou coronavírus. Esses anticorpos podem ser usados como medicamentos de primeira linha para prevenir ou tratar vírus de uma determinada família, incluindo novas linhagens ou cepas que ainda não surgiram. Mais importante ainda, eles poderiam ser usados para desenvolver vacinas contra muitos membros de uma determinada família de vírus (08/02/2021). Fonte: Nature
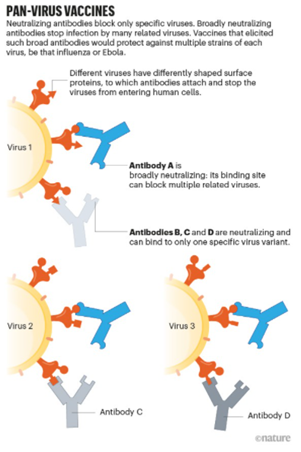
19/02/2021
Revisão discute as características de 26 candidatas a vacinas disponíveis em 2021 e os fatores envolvidos na sua distribuição, frente à premissa de que a vacinação em massa no mundo é condição essencial para interrupção da pandemia da COVID-19. Com o desenvolvimento das vacinas, estratégias devem ser desenvolvidas para que seja garantido que elas sejam produzidas e distribuídas em larga escala a um custo razoável e que estejam disponíveis onde necessárias o quanto antes, tendo em vista o risco de mutações do vírus e eventual perda de eficácia das vacinas. Os autores determinaram quatro dimensões relacionadas entre si para o desafio da vacinação global: desenvolvimento e produção, custo, alocação e distribuição/aplicação local. O artigo traz um quadro com as características distintivas das vacinas e utiliza cores que indicam potencial maior (verde) ou menor (vermelho) da sua contribuição para imunização das populações (12/02/2021). Fonte: The Lancet.
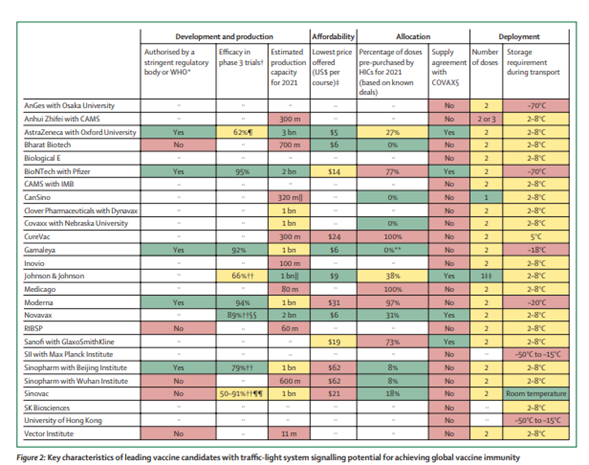
Não há dúvida de que as vacinas atuais contra o SARS-CoV-2 são eficazes e seguras. O risco de reação grave a uma injeção contra a COVID-19 é superado pela proteção que oferece contra o coronavírus mortal. Artigo analisa os aprendizados sobre a frequência e a natureza dos efeitos colaterais à medida que um grande número de pessoas relata suas reações aos médicos e por meio de sistemas de monitoramento de segurança, como aplicativos de smartphones (16/02/2021). Fonte: Nature.
Estudo investiga a capacidade de neutralização de 48 soros de pacientes que receberam a vacina BNT162b2 e mRNA-1273 contra pseudovírus contendo proteínas S derivadas de 10 cepas de SARS-CoV-2. Enquanto para várias cepas foi observada a neutralização cruzada induzida por vacina comparável ao pseudovírus do tipo selvagem, 5 cepas com mutações no domínio de ligação ao receptor, incluindo K417N / T, E484K e N501Y, foram altamente resistentes à neutralização. A neutralização cruzada de variantes B.1.351 foi fraca e comparável a SARS-CoV e WIV1-CoV derivado de morcego, sugerindo que um número relativamente pequeno de mutações pode provocar escape das respostas à vacina. Embora o impacto clínico da resistência à neutralização permaneça incerto, os resultados destacam o potencial para as variantes escaparem da imunidade humoral neutralizante e evidenciam a necessidade de intervenções de proteção ampla contra a pandemia em evolução (18/02/2021). Fonte: MedRxiv.
Desigualdades globais são evidentes desde o início da pandemia COVID-19. UTIs, ventiladores e oxigênio são escassos em todo o continente africano, por exemplo. Mas nos primeiros meses, as medidas básicas de saúde pública necessárias para controlar a propagação do vírus colocaram os países mais ou menos em pé de igualdade, disse John Nkengasong, chefe do Centro Africano para Controle e Prevenção de Doenças. A África resistiu à pandemia relativamente bem, em parte por causa de sua população jovem, mas com o lançamento das vacinas, a vantagem dos países ricos ficou evidente. Muitos países apostaram em várias vacinas e firmaram contratos de doses suficientes para imunizar várias vezes suas populações, restringindo o abastecimento para o resto do mundo. De acordo com a Organização Mundial da Saúde (OMS), três quartos de todas as vacinações até agora aconteceram em 10 países que respondem por 60% do produto interno bruto global; 130 países ainda não administraram uma única dose (17/02/2021). Fonte: Science.
A USP que assumiu o compromisso de desenvolver uma vacina do zero. São sete projetos em andamento nos vários campi da Universidade. A vacina em spray nasal do Instituto do Coração (Incor) da Faculdade de Medicina (FMUSP); a vacina nanoparticulada da Faculdade de Medicina de Ribeirão Preto (FMRP); a vacina vetorizada da Faculdade de Zootecnia e Engenharia de Alimentos (FZEA); as quatro plataformas vacinais em ensaios pré-clínicos do Instituto de Ciências Biomédicas (ICB): a nanovacina, a vacina de subunidades, e as vacinas de DNA e de RNA (17/02/2021). Fonte: Jornal USP
A vacina da Pfizer/BioNTech contra a COVID-19 reduziu em 75% a transmissão do coronavírus SARS-CoV-2 menos de um mês após a aplicação da primeira dose, segundo um estudo preliminar. Os pesquisadores avaliaram 9.109 profissionais de saúde do maior hospital de Israel. Desses, 7.214 já haviam recebido a primeira dose até o dia 24 de janeiro, e 6.037, a segunda dose. No período entre 15 e 28 dias depois da aplicação da primeira dose, houve 26 infecções pelo coronavírus entre os vacinados. Entre os não vacinados, foram 89 – uma redução, depois de ajustes, de 75%. Considerados apenas os casos sintomáticos, houve 11 casos entre os vacinados e 60 entre os não vacinados no mesmo período. A redução ajustada foi de 85%. Os autores concluem que além de diminuir a transmissão do vírus, a vacina também reduziu em 85% os casos sintomáticos da COVID-19. Os pesquisadores destacam que os resultados dão suporte à possibilidade de adiar a segunda dose, em cenário de escassez de vacinas, já que a primeira dose apontou a redução na transmissão do vírus e nos casos de COVID sintomática (18/02/2021). Fonte: The Lancet
Pfizer/BioNTech submeteram novos dados sobre o armazenamento de sua vacina contra Covid-19 à agência de saúde americana, FDA, nesta sexta-feira (19). Segundo as farmacêuticas, o imunizante, antes mantido apenas a temperatura ultrafria de -70º C, agora também pode ser armazenado por até duas semanas entre -15 e -25ºC. Albert Bourla, Presidente e Diretor Executivo da Pfizer, afirmou que a novidade permite que a vacina seja administrada em condições mais flexíveis, uma vez que freezers e refrigeradores farmacêuticos conseguem alcançar temperaturas em torno de -20º C. Além da FDA, as farmacêuticas informaram que os novos dados também serão enviados às agências reguladoras globais nas próximas semanas (19/02/2021). Fonte: G1
O Reino Unido será o primeiro país do mundo a realizar um estudo de desafio humano COVID-19, após a aprovação do órgão de ética de ensaios clínicos do Reino Unido. Até 90 voluntários com idade entre 18 e 30 anos serão expostos ao COVID-19 em um ambiente seguro e controlado para aumentar a compreensão de como o vírus afeta as pessoas. Este estudo inicial também ajudará os médicos a entender como o sistema imunológico reage ao coronavírus e identificar os fatores que influenciam como o vírus é transmitido, incluindo como uma pessoa infectada com o vírus COVID-19 transmite partículas infecciosas do vírus para o meio ambiente. O estudo Human Challenge está sendo realizado por uma parceria entre o Vaccines Taskforce do governo, o Imperial College London, o Royal Free London NHS Foundation Trust e a compania hVIVO, que foi pioneira em modelos de desafio humano viral (17/02/2021). Fonte: Governo UK
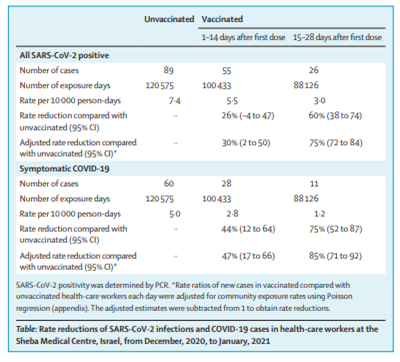
17/02/2021
Agência Reguladora da Europa (EMA) inicia 'revisão contínua' de vacina alemã CureVac contra a COVID-19. Esse é o primeiro passo para um pedido de autorização formal de comercialização na União Europeia. Esse já é o terceiro imunizante sob análise da EMA, ao lado da Johnson & Johnson e Novavax. A agência já aprovou três vacinas para uso emergencial: Pfizer/BioNTech, Moderna e AstraZeneca/Oxford (12/02/2021). Fonte: G1
O Instituto Butantan inicia hoje (17/02) em Serrana, município paulista com 48 mil habitantes, estudo inédito com o objetivo de avaliar o impacto da vacinação no combate à pandemia de COVID-19. Toda a população maior de 18 anos deverá ser vacinada nos próximos dois meses. Os primeiros resultados devem ser conhecidos em maio. A vacina utilizada será Coronavac, desenvolvida pela farmacêutica chinesa Sinovac e produzida no Brasil pelo Instituto Butantan (17/02/2021). Fonte: Agência FAPESP
Profissionais de saúde sul-africanos serão vacinados contra o SARS-CoV2 com a vacina da Johnson & Johnson, em substituição à vacina da AstraZeneca, que se mostrou incapaz de interromper a infecção leve ou moderada contra a variante do vírus B.1351 (501Y.V2), dominante na África do Sul (16/02/2021). Fonte: Healyh Policy Watch
Novos dados estão surgindo, sugerindo que as vacinas de proteína recombinante realmente podem oferecer uma vantagem ou complemento para as vacinas de ácido nucleico ou vetor viral. Neste artigo, pesquisadores resumem as informações públicas atuais sobre a natureza e o status de desenvolvimento de antígenos de subunidades recombinantes e adjuvantes visando infecções por SARS-CoV-2 (07/01/2021). Fonte: Advanced Drug Delivery Reviews

As vacinas de mRNA evoluíram de mera curiosidade para emergir como as primeiras vacinas contra a COVID-19. Avanços recentes no campo da tecnologia de RNA, vacinologia e nanotecnologia geraram interesse na entrega de terapêuticas de mRNA seguras e eficazes. Nesta revisão, os pesquisadores discutem o projeto e a automontagem de vacinas de mRNA. A automontagem, uma organização espontânea de moléculas individuais, permite o design de nanopartículas com propriedades personalizáveis. Este artigo destacou os materiais comumente utilizados para entregar mRNA, suas características físico-químicas e outras considerações relevantes, como otimização de mRNA, vias de administração, destino celular e ativação imune, que são importantes para a vacinação de mRNA bem-sucedida. Também examinou as vacinas de mRNA COVID-19 atualmente em ensaios clínicos. As vacinas de mRNA estão prontas para a clínica, mostrando uma promessa na corrida da vacina COVID-19, e têm expandido os limites da terapia genética (02/01/2021). Fonte: Advanced Drug Delivery Reviews
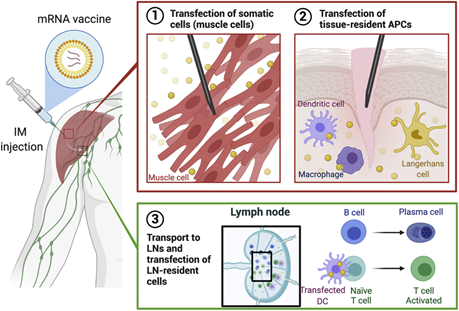
12/02/2021
Em nota, o Instituto Butantan declarou que a vacina lá produzida apresenta melhor desempenho contra as novas cepas do coronavírus na comparação com as vacinas que se utilizam de uma única proteína como antígeno (a chamada proteína S). Testes feitos com as variantes inglesa e sul-africana do novo coronavírus já mostraram um bom desempenho das vacinas com vírus inativado (tecnologia da vacina do Butantan), e análises estão sendo feitas atualmente contra a cepa amazônica (08/02/2021). Fonte: Instituto Butantan.
Estudo apresenta vetores de Vaccinia ankara (MVA) modificados que expressam a proteína S de pré-fusão estabilizada, ancorada na membrana (MVA / S), mas não secretadadas, que induziram fortes respostas de anticorpos neutralizantes contra SARS-CoV-2 em camundongos. Em macacos, a vacinação MVA / S induziu fortes anticorpos neutralizantes e respostas de células T CD8 +, e mostrou proteção contra infecção por SARS-CoV-2 e replicação de vírus no pulmão já no dia 2 após o desafio intranasal ou intratraqueal. A análise de sequenciamento de RNA de célula única a partir de células pulmonares no dia 4 pós-infecção revelou que a vacinação com MVA / S também protegeu macacos da inflamação induzida por infecção e anormalidades de células B, e diminuiu a indução de genes estimulados por interferon. Estes resultados demonstram que a vacinação com MVA / S induz anticorpos neutralizantes e células T CD8 + no sangue e no pulmão e serve como uma vacina candidata potencial contra a SARS-CoV-2 (04/02/2021). Fonte: Immunity

Em carta ao editor, pesquisador afirma que se o desenvolvimento clínico de vacinas candidatas contra a COVID-19 em crianças for conduzido com o objetivo de obter resultados de segurança em longo prazo (≥1 ano), qualquer vacina candidata que cumpra os requisitos da Food and Drug Administration dos EUA para eficácia e os outros critérios pode ser considerada para inclusão em programas obrigatórios de imunização escolar, se considerado apropriado pelas autoridades de saúde, mas isso será improvável antes de 2024 (08/02/2021). Fonte: JAMA Pediatrics
Pesquisadores discutem a vacinação contra a COVID-19 em mulheres grávidas e lactantes. Segundo o artigo, sendo uma plataforma imunogênica, mas não infecciosa e não integrante, as vacinas de mRNA têm benefícios potenciais sobre vacinas de vírus atenuados, vacinas inativadas ou de subunidades e vacinas baseadas em DNA. Não há risco de adquirir infecção pela vacina. Embora nenhum estudo específico tenha avaliado a capacidade da vacina de nanopartículas lipídicas de atingir o feto após a vacinação, é provável que as células musculares locais absorvam as nanopartículas lipídicas e iniciem a transcrição para estimular a resposta imune. Os pesquisadores afirmam que, dada a importância de reduzir o risco de COVID-19 para mulheres grávidas e lactantes e seus recém-nascidos, é essencial determinar o perfil de segurança dessas vacinações em tempo real. Em conclusão destacam que, tendo em vista o que se sabe sobre as vacinas contra a COVID-19, com uma compreensão da importante prática de vacinação na gravidez, o uso de outras vacinas durante a gravidez, a eficácia e segurança das vacinas de mRNA de COVID-19 em populações não grávidas e seu mecanismo de indução de uma resposta imune, os médicos podem delinear o benefício da prevenção de doença COVID-19, bem como o risco indefinido, mas possivelmente limitado para o feto e benefício potencial para o recém-nascido. Como parte da discussão, os médicos devem reconhecer com empatia as evidências disponíveis limitadas, bem como a tensão sobre os benefícios potenciais da vacinação comparados com os riscos potenciais - sejam reais ou teóricos - e estar preparados para dissipar os mitos (08/02/2021). Fonte: JAMA Network
As autoridades de saúde francesas recomendaram nesta sexta-feira, 12, a aplicação de apenas uma dose da vacina contra o coronavírus para pessoas que já foram infectadas com a doença. Com a medida, a França torna-se o primeiro país a fazer tal recomendação. O órgão também recomendou esperar mais de três meses após a doença — dando preferência a seis — antes de injetar a dose única (12/02/2021). Fonte: Veja
10/02/2021
Estudo demostrou que duas vacinas chinesas contra a Covid-19 – a vacina inativada BBIBP-CorV, da Sinopharm, e a vacina de domínio de ligação ao receptor dimérico recombinante (RBD) ZF2001, da Anhui Zhifei Longcom e Academia Chinesa de Ciências Médicas – conseguiram neutralizar a variante 501Y.V2 do vírus, que foi detectada pela primeira vez na África do Sul. Os cientistas usaram soros de 12 participantes dos dois ensaios clínicos. Os resultados sugerem que a variante não escapa da imunidade induzida por vacinas direcionadas à RBD da proteína S (como a ZF2001) ou vírus inteiro inativado (como a BBIBP-CorV), embora com uma taxa um pouco menor de eficácia (02/02/2021). Fonte: BioRXiv
Foram utilizadas análises estatísticas multivariadas para avaliação de óbitos e casos de COVID-19 relativos a outros nove fatores demográficos e socioeconômicos em todos os países e regiões do mundo utilizando dados a partir de 1º de agosto de 2020. Os fatores analisados no estudo incluem o total de óbitos e casos de COVID-19 por milhão de habitantes, produto interno bruto per capita (PIB), densidade populacional, testes de vírus por milhão de habitantes, idade mediana, índice de sequência de resposta do governo, disponibilidade de leitos hospitalares por mil habitantes, taxa de pobreza extrema, taxa de vacinação Bacille Calmette-Guérin (BCG) e taxa de imunização com DTP. O estudo revela que as mortes por COVID-19 por milhão de habitantes em um país se correlaciona de forma mais significativa, inversamente, com a taxa de vacinação BCG do país, e também correlaciona significativamente o PIB per capita de um país e idade mediana. A correlação inversa entre as taxas de vacinação BCG e o caso COVID-19 e óbito manteve-se significativa entre os 61 países com maior idade mediana. Este estudo contribui para um conjunto crescente de evidências que sustentam a noção de que a vacinação com BCG pode ser protetora contra a mortalidade da COVID-19 (25/01/2021). Fonte: Infection
Estudo indica que a vacinação contra a gripe pode ter efeito protetor no curso do COVID-19 na população pediátrica. Pesquisadores analisaram os dados de mais de 900 crianças que testaram positivo para COVID-19 e descobriram que aqueles que receberam a última vacina de gripe estavam menos suscetíveis aos sintomas respiratórios da COVID-19 do que aqueles que não foram vacinados. Fonte: Cureus
08/02/2021
As análises apresentadas no pre print mostram que a vacina ChAdOx1 nCoV-19 teve alta eficácia contra a cepa original do coronavírus na África do Sul. Pesquisadores da University of Witwatersrand e outros na África do Sul e na University of Oxford, UK descobriram que a neutralização viral por soros induzida pela vacina de coronavírus ChAdOx1 nCoV-19 contra a variante de coronavírus B.1.351 foi substancialmente reduzida quando comparada com a cepa original de o coronavírus. O trabalho já está em andamento na Universidade de Oxford e em conjunto com parceiros para produzir uma 2ª geração da vacina que foi adaptada para combater variantes do coronavírus com mutações semelhantes a B.1.351, se necessário (07/02/2021). Fonte: University Oxford
A vacina desenvolvida pelas empresas Pfizer e BioNTech contra a COVID-19 conseguiu neutralizar, em laboratório, três variantes do coronavírus. As variantes testadas aparecem na África do Sul e no Reino Unido e têm mutações que ocorrem em uma variante brasileira. Os pesquisadores testaram o soro de 20 participantes dos ensaios clínicos da vacina contra as variantes do vírus. Os voluntários já haviam recebido as duas doses da vacina e já tinham criado anticorpos contra o coronavírus. As três variantes neutralizadas tinham a mutação N501Y, que foi associada a uma maior capacidade de transmissão do coronavírus. Uma das variantes neutralizadas, que aparece apenas na África do Sul, teve, além da N501Y, a mutação E484K, associada a um possível enfraquecimento da ação dos anticorpos humanos contra o vírus. Tanto a N501Y quanto a E484K aparecem em uma variante identificada no Brasil – primeiro no Amazonas e, depois, em outros estados. O poder de neutralização dos anticorpos contra a variante sul-africana que tinha a mutação E484K foi ligeiramente menor do que em relação às outras variantes. Por causa disso, os autores concluíram que é necessário monitorar de forma contínua a eficácia das vacinas contra a COVID contra novas variantes do coronavírus(08/02/2021). Fonte: Nature Medicine

A UFMG e o governo de Minas Gerais contarão com apoio do Ministério da Ciência, Tecnologia e Inovações para o desenvolvimento de vacinas no estado, a parceria que deve promover incremento nas pesquisas realizadas pelo Centro de Tecnologia em Vacinas (CT-Vacinas) da UFMG e instituições vinculadas ao governo do estado. O objetivo do esforço conjunto é viabilizar o desenvolvimento de imunizantes nacionais, o que reduzirá a dependência do Brasil em relação a vacinas e insumos produzidos no exterior (06/02/2021). Fonte: UFMG
O comitê de medicamentos humanos da EMA deu início a uma revisão contínua da vacina NVX-CoV2373 que está sendo desenvolvida pela Novavax CZ AS. A vacina é baseada em proteínas de uma versão desenvolvida em laboratório da proteína spike (S) encontrada na superfície do coronavírus SARS-CoV-2. Também contém um 'adjuvante', uma substância que ajuda a fortalecer as respostas imunológicas à vacina (03/02/2021). Fonte: EMA
Estudo descreve três vacinas de adenovírus de chimpanzé recombinante (AdC7) que expressam a proteína S do SARS-CoV-2, domínio de ligação ao receptor (RBD) ou RBD de repetição em tandem dimérico (RBD-tr2). Foi demonstrado que a vacinação por via intramuscular ou intranasal era altamente imunogênica em camundongos para eliciar respostas imunes humorais e celulares (baseadas em Th1). AdC7-RBD-tr2 mostrou respostas de anticorpos mais altas em comparação com AdC7-S e AdC7-RBD. A administração intranasal de AdC7-RBD-tr2 induziu adicionalmente imunidade da mucosa com atividade neutralizante no fluido de lavagem broncoalveolar. A administração de dose única ou de duas doses na mucosa de AdC7-RBD-tr2 protegeu camundongos contra o desafio de SARS-CoV-2, com RNA subgenômico indetectável no pulmão e lesão pulmonar aliviada. Estes resultados apóiam AdC7-RBD-tr2 como um candidato promissor à vacina COVID-19 (08/02/2021). Fonte: bioRXiv
Estudo analisou os resultados positivos do teste SARS-CoV-2 após a inoculação com a vacina de mRNA BNT162b2, e descobriu que a carga viral é reduzida em 4 vezes para infecções que ocorrem 12-28 dias após a primeira dose da vacina. Essas cargas virais reduzidas sugerem uma menor infecciosidade, contribuindo ainda mais para o impacto da vacina na disseminação do vírus (08/02/2021). Fonte: medRXiv

Estudo avaliou se os soros e os anticorpos monoclonais de doadores convalescentes, antes e após uma única imunização com as vacinas de mRNA Pfizer ou Moderna, neutralizam a cepa Wuhan-Hu-1 e uma variante, B.1.351 da África do Sul. Os soros de pré-vacinação neutralizaram fracamente Wuhan-Hu-1 e neutralizaram B.1.351 esporadicamente. A imunização com qualquer das vacinas gerou respostas anamnésticas de células B e T CD4 + e um aumento de 1000 vezes nos títulos de anticorpos neutralizantes contra ambas as cepas e SARS-CoV-2. A neutralização foi provavelmente devido aos anticorpos anti-RBD e anti-S2. Este estudo destaca a importância da vacinação de indivíduos não infectados bem como daqueles previamente infectados, uma vez que a resposta imune induzida neutralizará cepas virais distintas (08/02/2021). Fonte: medRXiv
Pesquisadores revisam as novas estratégias para vacinação para a COVID-19 com direcionamento ao domínio de ligação ao receptor da proteína spike de SARS-CoV-2 (RBD) (26/11/2020). Fonte: Cellular & Molecular Immunology (Nature)

05/02/2021
Estudo com 499 participantes que desenvolveram infecção por COVID-19. 1524 swabs de nariz / garganta positivos para NAAT foram coletados desses participantes durante o ensaio. Destes, 323 zaragatoas de 256 participantes foram sequenciados com sucesso. Receptores ChAdOx1 nCoV-19 tinham uma carga viral significativamente mais baixa, representada pelo valor Ct de PCR mínimo (p <0,0001) e eram NAAT positivos por um período mais curto (p <0,0001) do que os participantes receberam a vacina controle. A atividade de neutralização do vírus por anticorpos induzidos pela vacina foi 9 vezes menor contra a variante B.1.1.7 do que contra uma linhagem não B.1.1.7 canônica. A eficácia de ChAdOx1 nCoV-19 contra a variante B.1.1.7 de SARS-CoV-2 é semelhante à eficácia da vacina contra outras linhagens. Além disso, a vacinação com ChAdOx1 nCoV-19 resulta em uma redução na duração da eliminação e da carga viral, o que pode se traduzir em um impacto concreto na transmissão da doença (04/02/2021). Fonte: Preprints The Lancet
A farmacêutica Moderna cita que os anticorpos acionados por sua vacina parecem ser um pouco menos potentes contra a nova variante, chamada B.1.351, do que aquela para a qual a vacina foi desenvolvida. Portanto, os pesquisadores talvez tenham ficado ainda mais aliviados ao saber que a empresa vai começar a desenvolver doses de reforço adaptados para B.1.351 e outras variantes (29/01/2021). Fonte: Science
Estudo relata o desenvolvimento pré-clínico de duas vacinas candidatas BNT162b, que contêm nanopartículas de lipídeos (LNP) formuladas com mRNA modificado com nucleosídeos que codificam imunógenos derivados de glicoproteína S de SARS-CoV-2. BNT162b1 codifica um domínio de ligação ao receptor trimerizado, segregado, solúvel (RBD-foldon). O BNT162b2 codifica a glicoproteína S transmembrana de comprimento total, bloqueada em sua conformação de pré-fusão (P2S). Os RBDs com amarras flexíveis do RBD-foldon ligam ECA2 com alta avidez. Aproximadamente 20% dos trímeros P2S estão no estado dois-RBD 'para baixo,' um-RBD 'para cima'. Em camundongos, uma dose intramuscular de qualquer um dos candidatos induz uma resposta de anticorpos dependente da dose com altos títulos de inibição de entrada de vírus e fortes respostas de células T TH1 CD4 + e IFNγ + CD8 +. A vacinação inicial / reforço de macacos rhesus com candidatos BNT162b elicita títulos médios geométricos neutralizantes de SARS-CoV-2 de 8,2 a 18,2 vezes mais que de um painel de soro humano convalescente de SARS-CoV-2. Os candidatos à vacina protegem macacos do desafio de SARS-CoV-2, com o BNT162b2 protegendo o trato respiratório inferior da presença de RNA viral e sem evidência de aumento da doença. (NCT04380701, NCT04368728) (01/02/2021). Fonte: Nature
Autores relatam um ensaio clínico de fase 1, randomizado, duplo-cego, controlado por placebo, em um centro de ensaios clínicos especializado na Austrália do SCB-2019, uma vacina de subunidade de proteica contendo uma forma trimérica estabilizada da proteína S combinada com dois adjuvantes diferentes. Foram recrutados voluntários adultos saudáveis em dois grupos de idade: adultos mais jovens (com idades entre 18-54 anos) e adultos mais velhos (com idades entre 55-75 anos). Os participantes foram alocados aleatoriamente na vacina ou no placebo, usando uma lista preparada pelo financiador do estudo. Os participantes deveriam receber duas doses de SCB-2019 (3 μg, 9 μg ou 30 μg) ou um placebo (0 9% NaCl) com 21 dias de intervalo. O SCB-2019 poderia não ter o adjuvante (proteína S sozinha) ou foi adjuvado com AS03 ou CpG / Alum. O ensaio está registrado com ClinicalTrials gov, NCT04405908. Esta é uma análise provisória e o estudo continua. Entre 19 de junho e 23 de setembro de 2020, 151 voluntários foram inscritos; três pessoas desistiram, 148 participantes tiveram pelo menos 4 semanas de acompanhamento após a segunda dose e foram incluídos nesta análise. A vacina SCB-2019, compreendendo a proteína S formulada com os adjuvantes AS03 ou CpG / Alum, eliciou respostas imunes humorais e celulares robustas contra SARS-CoV-2, com alta atividade de neutralização viral. Ambas as formulações de vacinas com adjuvante foram bem toleradas e adequadas para posterior desenvolvimento clínico (29/01/2021). Fonte: Lancet
03/02/2021
Imunização em massa já aponta queda de infecções e internações por COVID-19 e no total de hospitalizações pela doença na faixa etária acima dos 60 anos em Israel. Menos de 0,1% das pessoas vacinadas contraíram o coronavírus e muito menos adoeceram. Os números do Ministério da Saúde de Israel mostram que apenas 531 maiores de 60 anos dos quase 750 mil vacinados tiveram resultado positivo para coronavírus (0,07% do total) depois de receberem as doses da vacina, mas com sintomas leves. Outras 38 pessoas foram hospitalizadas com sintomas moderados, graves ou críticos da doença — uma proporção ínfima. Os dados do Ministério da Saúde sugerem que as infecções caíram consistentemente 14 dias após o recebimento da primeira injeção. A pesquisa ainda não definiu se a vacina impede completamente as pessoas de transportar e transmitir o vírus. (03/02/2021). Fonte: G1
Pesquisadores da Universidade de Oxford publicaram uma análise de mais dados dos ensaios em andamento da vacina. Neste estudo, eles revelam que a eficácia da vacina é maior em intervalos mais longos de prime-boost, e que uma única dose da vacina é 76% eficaz de 22- até 90 dias após a vacinação. Esta análise de dados relatam que o efeito do intervalo de dosagem sobre a eficácia é pronunciado, com a eficácia da vacina subindo de 54,9% com um intervalo inferior a seis semanas para 82,4% quando espaçado 12 ou mais semanas de diferença, o que apoia a recomendação política feita pela Comissão Mista de Vacinação e Imunização (JCVI) para um intervalo de 12 semanas de prime-boost. Os autores também relatam mais sobre o potencial da vacina para reduzir a transmissão do vírus, com base em cotonetes obtidos de voluntários nos braços do Reino Unido do estudo com uma redução de 67% após a primeira dose da vacina (01/02/2021). Fonte: Preprint da Lancet
Análise provisória do ensaio de fase 3 da vacina heteróloga à base de adenovírus recombinante (rAd) Gam-COVID-Vac (Sputnik V) mostrou 91.6% de eficácia contra COVID-19 e foi bem tolerado em uma grande coorte. O estudo clínico está registrado em ClinicalTrials.gov (NCT04530396). O estudo de fase 3 foi desenvolvido através de ensaio clínico randomizado, duplo-cego, controlado por placebo, em 25 hospitais e policlínicas de Moscou, Rússia. Foram incluídos 21977 participantes com idade mínima de 18 anos, com PCR para SARS-CoV-2 e testes de IgG e IgM negativos. O desfecho primário do estudo, no qual foram incluídos 19866 indivíduos, foi verificar a proporção daqueles que contraíram COVID-19 a partir do dia 21 após a primeira dose. Os participantes foram designados aleatoriamente (3:1) para receber vacina ou placebo com estratificação por faixa etária. A vacina foi administrada por via intramuscular em um regime prime-boost (0,5 mL / dose): intervalo de 21 dias entre a primeira dose (rAd26) e o segunda dose (rAd5). A partir de 21 dias após a primeira dose da vacina, 16 (0,1%) dos 14964 participantes do grupo da vacina e 62 (1,3%) de 4902 participantes no grupo de placebo foram diagnosticados com COVID-19; a eficácia da vacina foi 91.6%. Efeitos adversos graves não foram associados à vacinação (02/02/2021). Fonte: The Lancet.
O laboratório União Química, responsável pela produção da vacina russa Sputnik V (que utiliza tecnologia de vetor viral) em território brasileiro, informou à Anvisa a temperatura indicada para a conservação do imunizante. Em nota, a agência informou que a temperatura é a mesma indicada no estudo publicado na revista científica The Lancet na última terça-feira (02/01/2021), que é de -18°C. Após a divulgação do estudo que apontou eficácia de 91,6% da vacina russa, o laboratório paulista manifestou que pretende submeter os dados à análise da Anvisa para uso emergencial do imunizante. Uma particularidade do imunizante russo é que, ao contrário da vacina da Johnson & Johnson, que utiliza apenas um adenovírus, a Sputnik V utiliza dois, um em cada uma das doses necessárias. O Ad26 na primeira aplicação e o Ad5 na segunda dose (03/02/2021). Fonte: Olhar Digital
Recentemente, uma nova linhagem SARS-CoV-2 chamada B 1.1.7 (variante de preocupação: VOC 202012/01) emergiu no Reino Unido e foi relatada como capaz de se espalhar de forma mais eficiente e rápida do que outras cepas. Esta variante tem um número grande de mutações com alterações de 10 aminoácidos na proteína S, levantando preocupações de que seu reconhecimento por anticorpos neutralizantes possa ser afetado. Os autores testaram pseudovírus contendo a proteína S da cepa de referência Wuhan do SARS-CoV-2 ou a proteína S da linhagem B 1.1.7 com soros de 40 participantes que foram vacinados com a vacina de mRNA para COVID-19, BNT162b2. Os soros imunes tinham títulos neutralizantes ligeiramente reduzidos, mas em geral preservados contra o pseudovírus de linhagem B 1.1.7. Esses dados indicam que a linhagem B.1.1.7 não escapará da proteção mediada pela vacina BNT162b2 (29/01/2021). Fonte: Science
01/02/2021
O surgimento de variantes SARS-CoV-2 com mutações na proteína S, mais recentemente circulando isolados do Reino Unido (B.1.1.7) e da República da África do Sul (B.1.351), levou a uma menor neutralização do soro convalescente por ensaios de neutralização de pseudovírus (PsVN) e resistência a certos anticorpos monoclonais. Pesquisadores construíram pseudovírus contendo as diferentes mutações das variantes da África do sul e Inglaterra, através de VSV e lentivírus expressando variantes da proteína S de 20E (EU1), 20A. EU2, D614G-N439, mink cluster 5, B.1.1.7 e B.1.351 e avaliaram a capacidade neutralizante de soro de seres humanos ou primatas não humanos (NHPs) que receberam mRNA-1273. Não foi detectado impacto significativo na neutralização contra a variante B.1.1.7 em ambos os casos, porém foi verificada a neutralização reduzida em relação às mutações presentes em B.1.351. Os dados demonstram uma neutralização reduzida, mas ainda significativa, em relação à variante B.1.351 após a vacinação mRNA-1273 (25/01/2021). Fonte: bioRxiv
29/01/2021
A Novavax, empresa de biotecnologia que desenvolve vacinas de última geração para doenças infecciosas graves, anunciou que a NVX-CoV2373, sua candidata à vacina COVID-19 baseada em proteínas, atingiu uma eficácia vacinal de 89,3%, em seu teste clínico fase 3 realizado no Reino Unido. O estudo avaliou a eficácia durante um período com alta transmissão e com uma nova variante do vírus do Reino Unido emergindo e circulando amplamente. O NVX-CoV2373 contém a proteína S de pré-fusão feita usando a tecnologia de nanopartículas recombinantes e o adjuvante da empresa, Matrix-M™. A proteína purificada é produzida em células de insetos. A vacina é estável a 2°C a 8°C e é enviada em uma formulação líquida pronta para uso que permite a distribuição usando canais existentes da cadeia de suprimentos de vacinas. O estudo inscreveu mais de 15.000 participantes entre 18 e 84 anos de idade, incluindo 27% acima dos 65 anos. A NVX-CoV2373 é a primeira vacina a demonstrar eficácia frente às variantes do reino unido e da África do Sul durante os testes clínicos (28/01/2021) Fonte: Novavax
A vacina para a COVID-19 desenvolvida pela Janssen Pharmaceuticals, baseada em um vetor viral recombinante que usa um adenovírus humano para expressar a proteína S do SARS-CoV-2 demonstrou ser segura e eficaz na prevenção de COVID-19 moderado e grave em adultos, de acordo com uma análise preliminar dos dados clínicos da Fase 3. A vacina, chamada Ad.26.COV2.S ou JNJ-78436725, requer apenas uma única injeção e pode ser armazenada em uma geladeira por meses. A análise avaliou 468 casos de COVID-19 sintomáticos entre 44.325 voluntários adultos na Argentina, Brasil, Chile, Colômbia, México, Peru, África do Sul e Estados Unidos. A vacina teria sido 66% eficaz na prevenção dos pontos finais combinados do estudo de COVID-19 moderados e graves aos 28 dias após a vacinação entre todos os voluntários, incluindo aqueles infectados com uma variante viral emergente. Geograficamente, o nível de proteção de doenças moderadas e graves variou: 72% nos Estados Unidos; 66% nos países latino-americanos; e 57% na África do Sul, 28 dias após a vacinação. Não foram notificados óbitos relacionados ao COVID-19 no grupo vacinal, enquanto 5 óbitos no grupo placebo foram relacionados ao COVID-19 (28/01/2021). Fonte: NIH
A Agência Europeia de Medicamentos (EMA, na sigla em inglês) recomendou, nesta sexta-feira (29), o uso da vacina de Oxford contra a COVID-19 na União Europeia. O próximo passo antes do início da distribuição e aplicação das doses da vacina para os 27 países do bloco é uma autorização da Comissão Europeia. Duas vacinas já foram aprovadas na União Europeia: a da Pfizer/BioNTech e a da Moderna. O imunizante de Oxford já havia sido aprovado, de forma independente, pela Hungria, que faz parte do bloco (29/01/2021). Fonte: G1
Estudo descreve uma vacina de nanopartículas de proteína contra SARS-CoV-2. A vacina é baseada na exibição do domínio de ligação ao receptor de glicoproteína S de coronavírus (RBD) em uma plataforma de partículas semelhantes a vírus (VLP) sintética, SpyCatcher003-mi3, usando a tecnologia SpyTag / SpyCatcher. Baixas doses de RBD-SpyVLP em um regime de iniciação-reforço induzem uma forte resposta de anticorpos neutralizantes em camundongos e porcos que é superior ao soro humano convalescente. Pesquisadores avaliaram a qualidade do anticorpo usando o bloqueio de ECA2 e a neutralização da infecção celular por pseudovírus ou SARS-CoV-2 de tipo selvagem. Usando ensaios de competição com um painel de anticorpo monoclonal, mostraram que RBD-SpyVLP induz uma resposta de anticorpo policlonal que reconhece epítopos-chave no RBD, reduzindo a probabilidade de selecionar mutantes de escape de neutralização. Além disso, o RBD-SpyVLP é termoestável e pode ser liofilizado sem perder a imunogenicidade, para facilitar a distribuição global e reduzir a dependência da cadeia de frio. Os dados sugerem que o RBD-SpyVLP oferece forte potencial para enfrentar os desafios clínicos e logísticos da pandemia de COVID-19 (22/01/2021). Fonte: Nature Communications
Artigo identifica as vacinas contra COVID-19 em desenvolvimento no Brasil. Há mais de 20 imunizantes brasileiros em estudo, parte deles com financiamento do governo federal. Nenhum deve estar disponível ainda em 2021, mas podem ajudar o país a combater o coronavírus no futuro. Todos ainda estão em fase preliminar – chamada de fase pré-clínica. Constam em um levantamento do Ministério da Saúde três projetos da Fundação Oswaldo Cruz (Fiocruz), três do Instituto Butantan, sete da Universidade de São Paulo (USP) – um deles em parceria com uma empresa privada –, um da Universidade Federal de Viçosa, um da Universidade Federal do Paraná (UFPR), um da Universidade Federal de Minas Gerais (UFMG) e um da Universidade Federal do Rio de Janeiro (UFRJ). A DW Brasil levantou que há pelo menos outros cinco projetos em estudo no país, sendo quatro iniciativas do Instituto Butantan e uma da Universidade Federal de Santa Catarina (UFSC). Uma das pesquisas mais avançadas para um imunizante brasileiro é a que vem sendo desenvolvida no Laboratório de Imunologia do Instituto do Coração (Incor), da Faculdade de Medicina da USP que busca uma vacina a ser aplicada por via nasal. Outra solução, desenvolvida pela empresa Farmacore – em parceria com a Faculdade de Medicina de Ribeirão Preto da USP –, também se baseia em uma nanopartícula com uma proteína recombinante cujos estudos pré-clínicos estão na fase final e, em breve, o dossiê deve ser submetido à Agência Nacional de Vigilância Sanitária (Anvisa) para que sejam iniciados os testes clínicos (26/01/2021). Fonte: DW
27/01/2021
A principal desenvolvedora de vacinas Merck (conhecida como MSD fora dos Estados Unidos e Canadá) diz que vai interromper o desenvolvimento de suas duas vacinas para COVID-19. Os resultados dos testes da fase I indicaram que as vacinas não desencadeiam uma resposta imune adequada. Em vez disso, a empresa se concentrará em seus dois tratamentos experimentais de para tratamento da COVID-19 (25/01/2021). Fonte: StatNews
Revisão apresenta as diferentes plataformas de produção de vacinas que vem sendo utilizadas na preparação de vacinas contra SARS-CoV-2, seus status atual e perspectivas (30/11/2020). Fonte: Journal of Experimental Biology and Agricultural Sciences
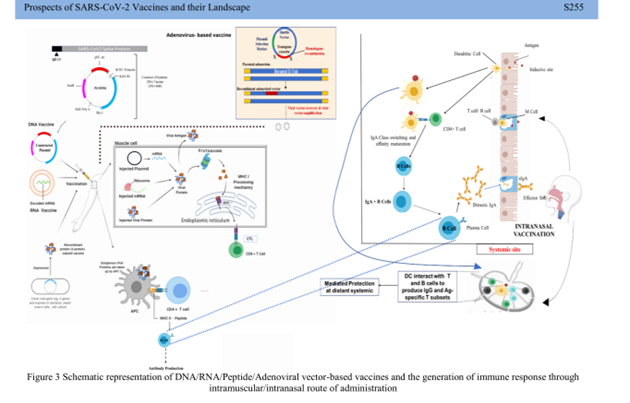
Artigo apresenta como a COVID-19 desbloqueou o poder das vacinas de RNA: a tecnologia que pode revolucionar os esforços de imunização contra HIV, malária, gripe e muito mais. Segundo pesquisadores a ideia da vacinação baseada em RNA remonta à década de 1990, quando pesquisadores na França utilizaram pela primeira vez o RNA que codifica um antígeno da gripe em camundongos. Produziu-se uma resposta, mas o sistema de entrega de lipídios que a equipe usou se mostrou muito tóxico para ser usado em pessoas. Levaria mais uma década antes que as empresas que buscam a terapêutica de interferência de RNA descobrissem as tecnologias de LNP que tornariam as vacinas COVID-19 de hoje possíveis. Destacam ainda que as vacinas de RNA parecem feitas para a velocidade. A partir da sequência genética de um patógeno, os pesquisadores podem retirar rapidamente um segmento potencial de codificação do antígeno, inserir essa sequência em um modelo de DNA e, em seguida, sintetizar o RNA correspondente antes de empacotar a vacina para entrega ao corpo (12/01/2021). Fonte: Nature
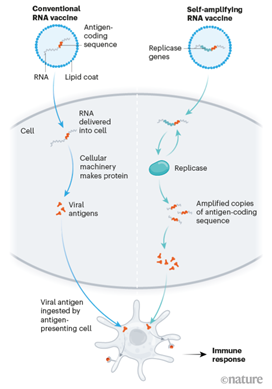
25/01/2021
Um estudo da Universidade Federal de Santa Catarina mostrou que a vacina tríplice viral, que protege contra caxumba, sarampo e rubéola e é oferecida pelo SUS desde 1992, reduz em 54% os sintomas da COVID-19. A pesquisa aponta ainda que houve diminuição de 74% de internação hospitalar para os vacinados. Os dados ainda são preliminares, mas os pesquisadores afirmam que “os resultados são bastante animadores pois trata-se de uma vacina não específica para o novo coronavírus que mostrou resultados de eficácia semelhante a algumas vacinas específicas divulgadas recentemente” (22/01/2021). Fonte.: ND+
Baseados em uma tecnologia que se vale da ação de moléculas de RNA mensageiro sintetizadas em laboratório para estimular uma resposta imunológica específica contra o vírus SARS-CoV-2, os dois imunizantes com melhores resultados nos testes em seres humanos, ambos com cerca de 95% de eficácia, inauguraram a era das chamadas vacinas gênicas. Neste artigo, pesquisadores apresentam uma revisão sobre as vacinas gênicas: produtos que se beneficiaram de anos de trabalho científico, com acertos e erros, e de investimentos em duas startups da área de biotecnologia: a alemã BioNTech, fundada em 2008 por um casal de médicos de ascendência turca, que se associou à gigante e centenária Pfizer, dos Estados Unidos, em sua vacina contra o SARS-CoV-2; e a norte-americana Moderna, criada em 2010 em Cambridge, cidade do estado de Massachusetts vizinha a Boston (Janeiro/2021). Fonte: Revista Pesquisa FAPESP
Pesquisadores analisaram o sangue de 20 voluntários que receberam duas doses da vacina desenvolvida pela Moderna ou da Pfizer – BioNTech. Ambas as vacinas carregam instruções de RNA que levam as células humanas a produzir a proteína spike que o vírus usa para infectar as células. Isso faz com que o corpo gere moléculas imunológicas chamadas anticorpos que reconhecem a proteína spike. Três a 14 semanas após a segunda injeção, os participantes do estudo desenvolveram vários tipos de anticorpos, incluindo alguns que podem bloquear o SARS-CoV-2 de infectar as células. Pesquisadores citaram que alguns dos anticorpos neutralizantes foram tão eficazes contra os vírus que carregam certas mutações na proteína spike quanto contra as formas disseminadas do vírus. Mas alguns foram apenas um terço tão eficazes no bloqueio das variantes mutadas (21/01/2021). Fonte: Nature
A vacina da Moderna demonstrou ser eficaz contra novas variantes do coronavírus que surgiram na Grã-Bretanha e na África do Sul, anunciou a empresa na 25/01/2021. No entanto, demonstrou ser menos protetora contra a variante descoberta na África do Sul, e por isso a empresa está desenvolvendo uma nova forma da vacina que poderia ser usada como injeção de reforço (25/01/2021). Fonte: The New York Times
Em coletiva de imprensa, realizada no último sábado (23/1), a Fiocruz explicou o esforço institucional que tem sido feito para minimizar o impacto sobre o cronograma de produção da Fiocruz com a não confirmação, até a presente data, da chegada do Ingrediente Farmacêutico Ativo (IFA), insumo necessário para iniciar a produção. Um desses esforços tem sido a negociação junto ao Instituto Serum, na Índia, de doses de vacinas prontas adicionais. A negociação segue em andamento e ainda não há um quantitativo acertado. O processo conta com o apoio do governo da Índia e da AstraZeneca, que vem colaborando em todo o esforço de antecipação das vacinas frente às dificuldades alfandegárias para exportação do IFA da China. Com relação ao IFA, no acordo com a AstraZeneca, está previsto o envio de 14 lotes de 7,5 milhões de doses, com intervalo de 2 semanas entre cada remessa, totalizando insumo para a produção de 15 milhões de doses de vacinas. O primeiro lote, para a produção de 7,5 milhões de doses, está pronto para embarque, no local de fabricação, apenas aguardando a emissão da licença de exportação e a conclusão dos procedimentos alfandegários. Há uma sinalização de 8 de fevereiro para envio da carga, mas ainda sem confirmação, já que a licença para exportação, a ser concedida pelas autoridades chinesas, segue pendente (25/01/2021). Fonte: Portal Fiocruz
Estudo resume as muitas variedades de novas formulações de nanopartículas (NP) para entrega de vacinas de DNA e mRNA, bem como fornece uma sinopse dos ensaios clínicos de vacinas de NP. Estudo demonstra que as vantagens das vacinas de ácido nucléico incluem a estimulação da imunidade mediada por células humorais, facilidade de design, rápida adaptabilidade às variações das cepas de patógenos e vacinas multiantigênicas personalizáveis (18/01/2021). Fonte: Advanced Healthcare Materials
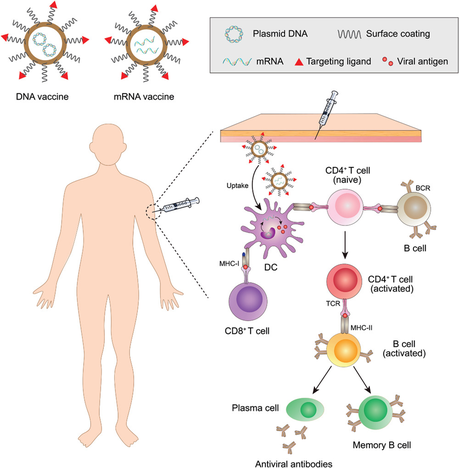
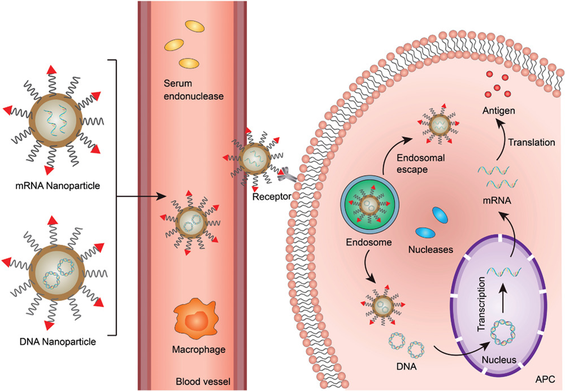
22/01/2021
Na segunda-feira (18), o Butantan fez um pedido de uso emergencial para 4,8 milhões de doses da CoronaVac envasadas no instituto, o que foi aprovado hoje (22/01/2021). Agora, está permitida também a utilização das vacinas envasadas pelo Butantan em sua fábrica, usando a matéria-prima enviada pelo laboratório chinês Sinovac. A partir desta autorização, outras doses que forem envasadas da mesma forma pelo instituto não precisam de novas liberações da Anvisa (22/01/2021). Fonte: G1
Uma das candidatas à vacina contra a COVID-19, a imunizante produzida pela Universidade Federal de Viçosa (UFV), entrará em fase de testes em breve, mais precisamente nos próximos dias, segundo o coordenador do projeto do estudo mineiro do Departamento de Biologia Geral da instituição. A princípio, os testes serão feitos em animais de laboratórios para checar a indução de uma resposta imune protetora capaz de inibir o vírus SARS-CoV-2. Os testes pré-clínicos serão conduzidos em parceria com a Fiocruz (14/01/2021). Fonte: UFV
O Serviço Federal de Defesa dos Direitos dos Consumidores e Bem-Estar Humano da Rússia (Rospotrebnadzor) afirmou nesta terça-feira (19) que, com base nos resultados de testes clínicos, a segunda vacina russa contra a COVID-19, a EpiVacCorona, é 100% eficaz. A EpiVacCorona, desenvolvida pelo Centro Estatal de Pesquisa de Virologia e Biotecnologia Vektor, com sede em Novossibirsk, foi registrada em 13 de outubro. A Rússia iniciou testes em massa da EpiVacCorona em novembro (19/01/2021). Fonte: Jornal do Brasil
Artigo avalia a durabilidade da resposta imunológica após vacinação contra o SARS-CoV-2 com a vacina da empresa Moderna mRNA-1273. São descritos os dados de imunogenicidade 119 dias após a primeira vacinação (90 dias após a segunda vacinação) em 34 participantes adultos saudáveis que receberam duas injeções de vacina a uma dose de 100 μg. As injeções foram recebidas com 28 dias de intervalo. Os beneficiários foram estratificados de acordo com a idade (18 a 55 anos, 56 a 70 anos ou ≥71 anos). A vacina produziu altos níveis de anticorpos de ligação e neutralização que diminuíram ligeiramente ao longo do tempo, como esperado, mas permaneceram elevados em todos os participantes 3 meses após a vacinação de reforço. Outras análises relacionadas à eficácia e segurança estão sendo conduzidos, envolvendo também células de memória (07/01/2021). Fonte: NEJM
A Fiocruz está envolvida em três ensaios clínicos diferentes em Fase 3 (grandes estudos multicêntricos que acompanham milhares de pacientes), em parceria com diversas instituições parceiras nacionais e internacionais. A instituição também está desenvolvendo três estudos pré-clínicos, que incluem um projeto brasileiro, conduzido pelo Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz) para o desenvolvimento de uma vacina sintética para o novo coronavírus, um projeto de vacina com a plataforma de subunidade, também realizado por Bio-Manguinhos/Fiocruz, e uma iniciativa da Fiocruz Minas, em parceria com uma rede do Instituto Nacional de Ciência e Tecnologia em Vacinas (INCTV), que utiliza o vírus da influenza para gerar resposta imunológica contra o SARS-CoV-2 (22/01/2020). Fonte: FIOCRUZ
Cuba tem a Fase II de sua vacina Soberana II iniciada e espera produzir 100 milhões de doses se obtiver sucesso. Além disso tem ainda a vacina Soberana I em desenvolvimento. A pesquisa é realizada em conjunto com a Itália e o Canadá e a expectativa é que a produção atenda a Cuba e possa ser comercializada para outros países (20/01/2021). Fonte: Cuba Debate
O laboratório farmacêutico brasileiro União Química vai produzir a vacina de desenvolvimento russo Sputnik V na planta de Brasília. A produção em pequena escala já foi iniciada e o laboratório visa fornecimento interno e exportação (21/01/2021). Fonte: O Globo
Pesquisadores britânicos apontam que para atingir a imunidade de rebanho com as vacinas disponíveis o percentual de pacientes vacinados deve ser alto. Os pesquisadores modelaram a eficácia dos programas de imunização em todo o Reino Unido usando as vacinas Oxford e Pfizer, levando em consideração a nova variante COVID-19 altamente transmissível. Defendem a vacinação ampla, incluindo as crianças (21/01/2021). Fonte: Medical Press
18/01/2021
Anvisa autoriza por unanimidade o uso emergencial das vacinas Coronovac e da vacina de Oxford/Astrazeneca contra a COVID-19. Pedidos foram feitos por Butantan e Fiocruz e são referentes a 8 milhões de doses importadas. Relatora frisou que não há alternativa de tratamento para prevenir a COVID-19. Butantan terá de assinar termo de compromisso. Com a aprovação do uso emergencial das duas vacinas, o estado de São Paulo iniciou no mesmo dia a imunização dos agentes de saúde do estado (17/01/2021). Fonte: G1
Estudo investiga a imunogenicidade, a eficácia protetora e o potencial para o aumento da doença respiratória associada à vacina (VAERD) mediadas pelo Ad26.COV2.S (vacina desenvolvida pela Johnson & Johnson) em um modelo de desafio de hamster sírio com doença moderada, usando a variante SARS-CoV-2 atualmente mais prevalente, G614. Doses vacinais de 1×109 vp e 1×1010 vp provocaram anticorpos neutralizantes substanciais e protegeram completamente mais de 80% dos hamsters sírios inoculados com SARS-CoV-2 de infecção pulmonar e pneumonia, mas não de infecção do trato respiratório superior. Uma segunda dose de vacina aumentou ainda mais os títulos de anticorpos neutralizantes que estavam associados à diminuição da carga viral infecciosa no trato respiratório superior após o desafio com SARS-CoV-2. Respostas imunes subótimas não protetoras provocadas por vacinação com baixa dose da Ad26.COV2.S não exacerbou a doença respiratória em hamsters sírios inoculados com SARS-CoV-2. Além disso, a dosagem da vacina permitiu estabelecer que os titulos de anticorpos de ligação e neutralização se correlacionam com a menor probabilidade de proteção do trato respiratório. No geral, esses dados pré-clínicos confirmam a eficácia de um regime vacinal de 1 dose com Ad26.COV2.S neste modelo de hamster sírio com a variante do vírus SARS-CoV-2 G614 e mostram o benefício de uma segunda dose adicional de vacina além de demonstrar que não há sinais de VAERD em condições de imunidade subótima (08/01/2021). Fonte: bioRXiv
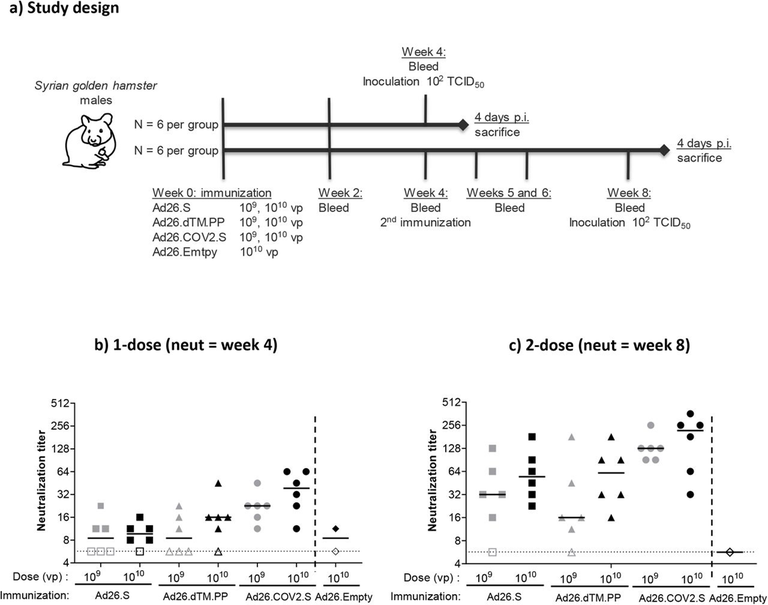
15/01/2021
Artigo apresenta os resultados da análise interina do estudo clínico de fase ½ da vacina candidata Ad26.COV2.S, da Johnson & Johnson, que sugerem o prosseguimento do desenvolvimento da vacina. A vacina é um vetor de adenovírus recombinante, não replicante. O estudo multicêntrico controlado por placebo envolveu 805 indivíduos saudáveis entre 18 e 55 anos (coorte 1) e indivíduos com 65 anos ou mais (coorte 3) para receberem doses de 5x1010 partículas virais (dose baixa) ou 1x1011 partículas virais (dose alta) por mililitro ou placebo em esquema de dose única ou de duas doses. Os dados comparando regimes de dose única e de duas doses estão sendo coletados na coorte 2 e não foram divulgados ainda. Os desfechos primários do presente estudo foram segurança e reatogenicidade de cada esquema de dosagem da vacina. Os títulos dos anticorpos neutralizantes foram detectados em 90% ou mais de todos os participantes no dia 29 após a primeira dose da vacina e atingiu 100% no dia 57, independente da dose da vacina ou da faixa etária. Uma segunda dose provocou aumento dos títulos de anticorpos. No dia 14, as respostas das células T CD4+ foram detectadas em 76 a 83% dos participantes na coorte 1 e em 60 a 67% daqueles na coorte 3. As respostas das células T CD8+ foram robustas em geral, sendo mais baixas na coorte 3 (13/01/2021). Fonte: New England Journal of Medicine.
Os autores previamente relataram a imunogenicidade precoce e os resultados de segurança da vacina ChAdOx1 nCoV-19 (AZD1222), em um ensaio clínico randomizado de fase 1/2 cego único de adultos saudáveis com idade entre 18-55 anos (NCT04324606). Neste artigo, os autores descrevem a segurança e a imunogenicidade humoral e celular exploratória da vacina, de subgrupos de voluntários desse ensaio, que foram posteriormente alocados para receber uma dose completa homóloga (SD / SD D56; n = 20) ou meia dose (SD / LD D56; n = 32) da reforço da vacina ChAdOx1 56 dias após a vacinação primária. Os dados de imunogenicidade relatados anteriormente do grupo aberto-reforço de intervalo de 28 dias (SD / SD D28; n = 10) também são apresentados para facilitar a comparação. Além disso, descrevem voluntários reforçados com a vacina de controle (MenACWY; n = 10). Neste relatório provisório, os autores demonstram que uma dose de reforço de ChAdOx1 nCoV-19 é segura e melhor tolerada do que as doses iniciais. Usando uma abordagem de sorologia de sistemas, também demonstram que os títulos de anticorpos neutralizantes anti-spike, bem como respostas de anticorpos funcionais mediadas por Fc, incluindo fagocitose de neutrófilos / monócitos dependentes de anticorpos, ativação de complemento e ativação de células natural killer, são substancialmente aumentados pela dose de reforço da vacina. Uma dose de reforço da vacina induziu respostas de anticorpos mais fortes do que um reforço de meia dose, embora a magnitude das respostas das células T não tenham aumentado com nenhuma das doses de reforço. Esses dados apoiam o regime de vacina de duas doses que agora está sendo avaliado na fase 3 dos ensaios clínicos (17/12/2020). Fonte: Nature Medicine
Pesquisadores de todo o mundo estão desenvolvendo 213 vacinas candidatas COVID-19, entre as quais 44 estão em testes em humanos. Nesta revisão foi analisado o progresso da vacina contra SARS-CoV, síndrome respiratória do Oriente Médio Coronavírus (MERS-CoV) e SARS-CoV-2, incluindo vacinas vírus inativados, vacinas vírus atenuados, vacinas de subunidade proteica, partículas semelhantes a vírus, vacinas de ácidos nucleicos e vacinas de vetores virais. Como SARS-CoV-2, SARS-CoV e MERS-CoV compartilham o gênero comum, Betacoronavirus, esta revisão apresenta o progresso da pesquisa fornecendo uma referência e novos insights sobre o design e desenvolvimento da vacina contra COVID-19 (23/12/2020). Fonte: Frontiers in Immunology
Revisão com objetivo de apresentar as abordagens estabelecidas e novas que estão sendo examinadas para avaliar a resposta imune celular durante a vacinação viral respiratória (21/12/2020). Fonte: Vaccines
13/01/2021
O executivo da farmacêutica britânica AstraZeneca Mene Pangalos afirmou nesta quarta-feira que apoia a mudança no regime de dosagem estudada pelo Reino Unido para sua vacina contra a COVID-19. A possibilidade de estender a aplicação da segunda dose de imunizantes desenhados com base em duas inoculações tem sido avaliada em diferentes países, entre eles o Brasil, para ampliar a margem da população imunizada no momento de pico da doença (13/01/2021). Fonte: O Globo
Butantan apresentou os principais números do estudo clínico de avaliação da vacina Coronavac. Os cientistas já haviam concluído que a Coronavac era segura e eficaz em produzir imunidade. A fase 3 foi realizada principalmente com o objetivo de investigar se o imunizante, de fato, impedia a infecção por SARS-CoV-2. No grupo placebo, 3,6% dos participantes tiveram COVID-19 (167 em um total de 4.599). No grupo vacinado, 1,8% contraíram a doença (85 em um total de 4.653). No grupo placebo, 0,7% (31 participantes entre os 4.653) precisaram de assistência médica por COVID-19. No grupo vacinado, somente 0,15% (7 de 4.599 participantes) precisou de assistência médica. Ao comparar 0,15%, com 0,7%, chegaram a taxa de 78% pessoas a menos desenvolvendo sintomas graves (12/01/2021). Fonte: Jornal da USP

11/01/2021
Estudo avaliou a segurança e eficácia da vacina desenvolvida pela Oxford-Astrazeneca ChAdOx1 nCoV-19 em uma análise interina agrupada de quatro ensaios desenvolvidos no Brasil, Reino Unido e África do Sul. Os voluntários tinham 18 anos ou mais e foram aleatoriamente designados (1:1) para o grupo da vacina ChAdOx1 nCoV-19 ou para o grupo controle (vacina meningocócica do grupo A, C, W e Y conjugada ou solução salina). Os participantes do grupo da vacina ChAdOx1 nCoV-19 receberam duas doses contendo 5 × 1010 partículas virais (dose padrão), sendo que em um subconjunto no estudo do Reino Unido, os voluntários receberam meia dose como primeira dose (dose baixa) e uma dose padrão como segunda dose. A análise de eficácia primária incluiu COVID-19 sintomático em participantes soronegativos com um esfregaço positivo para teste de amplificação de ácido nucleico mais de 14 dias após a segunda dose da vacina. Os participantes foram analisados de acordo com o tratamento recebido até 4 de novembro de 2020. Os estudos estão registrados em ISRCTN89951424e ClinicalTrials.gov, NCT04324606, NCT04400838, NCT04444674. Entre 23 de abril e 4 de novembro de 2020, 23.848 participantes foram inscritos e 11.636 (7.548 no Reino Unido, 4.088 no Brasil) foram incluídos na análise de eficácia primária provisória. Nos participantes que receberam duas doses padrão, a eficácia da vacina foi de 62,1% (27 [0,6%] de 4440 no grupo ChAdOx1 nCoV-19 versus 71 [6%] de 4455 no grupo de controle); em participantes que receberam uma dose baixa seguida por uma dose padrão, a eficácia foi 90,0% (três [0,2%] de 1367 versus 30 [2%] de 1374). A eficácia geral da vacina em ambos os grupos foi de 70,4% (30 [0,5%] de 5807 versus 101 [1,7%] de 5829). A partir do dia 21 após a primeira dose, houve dez casos de hospitalização por COVID-19, todos no braço de controle; dois foram classificados como COVID-19 grave, incluindo um óbito. Houve 74.341 pessoas-mês de acompanhamento de segurança: 175 eventos adversos graves ocorreram em 168 participantes, 84 eventos no grupo da vacina ChAdOx1 nCoV-19 e 91 no grupo de controle. Três eventos foram classificados como possivelmente relacionados à vacina: um no grupo ChAdOx1 nCoV-19, um no grupo de controle e um em um participante que permanece mascarado para a alocação do grupo. Apesar das pequenas diferenças entre os estudos, há consistência suficiente para justificar a proposta de análise agrupada de dados, o que fornecerá maior precisão para os resultados de eficácia e segurança do que o que pode ser alcançado em estudos individuais e fornece uma compreensão mais ampla do uso da vacina em diferentes populações. Uma vez que os estudos estavam em andamento, um plano de análise estatística para a análise global agrupada foi desenvolvido antes do fechamento dos dados, em 4 de novembro de 2020, e da análise destes dados. O estudo foi finalizado com amplo feedback de reguladores nacionais e internacionais (incluindo a Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido e Agência Europeia de Medicamentos), incluindo a justificativa para a incorporação de grupos que receberam diferentes doses de vacina. O ChAdOx1 nCoV-19 tem um perfil de segurança aceitável e foi considerado eficaz contra COVID-19 sintomático nesta análise provisória de ensaios clínicos em andamento (08/12/2021). Fonte: The Lancet.
Pesquisadores projetaram candidatas de vacinas de subunidade usando nanopartículas de ferritina de automontagem exibindo um dos dois Spikes de SARS-CoV-2 multimerizados: ectodomínio de comprimento total (S-Fer) ou uma deleção de 70 aminoácidos C-terminal (SΔC-Fer). Após uma única imunização de camundongos com qualquer uma das duas partículas de ferritina da proteína spike, em um ensaio de pseudovírus SARS-CoV-2 lentiviral revelou títulos médios de anticorpos neutralizantes pelo menos 2 vezes maiores do que aqueles em plasma convalescente de pacientes COVID-19. Além disso, uma única dose de SΔC-Fer induziu respostas de neutralização significativamente maiores em comparação com a imunização com o monômero do domínio de ligação do receptor de Spike (RBD) ou trímero do ectodomínio da spike sozinha. Após uma segunda dose, os camundongos imunizados com SΔC-Fer exibiram títulos neutralizantes mais elevados do que todos os outros grupos. Os resultados demonstram que a apresentação multivalente Da proteína Spike de SARS-CoV-2 na ferritina pode aumentar notavelmente a produção de anticorpos neutralizantes, constituindo assim uma estratégia viável para a vacinação em dose única contra COVID-19 (05/01/2021). Fonte: ACS Central Science
Auto-montagem (self-assembly) é uma organização espontânea de moléculas individuais que permite o design de nanopartículas com propriedades customizáveis. Neste artigo, os autores revisam o design e a auto-montagem das vacinas de mRNA. São destacados os materiais mais utilizados para a entrega do mRNA, suas características físico-químicas e outras considerações relevantes, como otimização do mRNA, rotas de administração, destino celular e ativação imunológica, importantes para o sucesso da vacinação por mRNA. Os autores também fazem uma análise das vacinas de mRNA para COVID-19 que atualmente estão em ensaios clínicos, ou prontas para clínica. (02/01/2021). Fonte: Advanced Drug Delivery Reviews
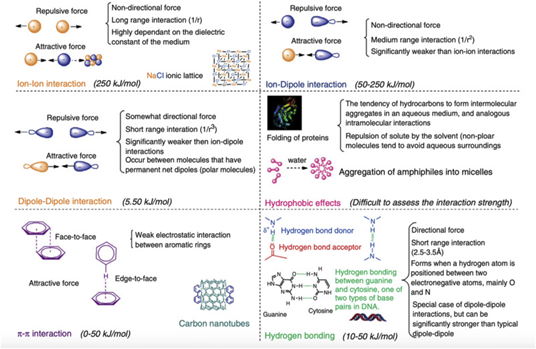
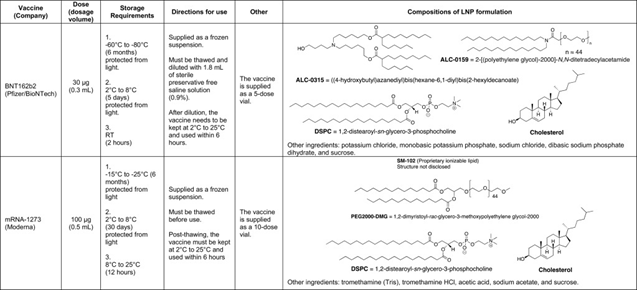
08/01/2021
Instituto Butantan divulga os dados de eficácia da vacina Coronavac, com 78% de proteção para contaminação e 100% de proteção para casos graves e moderados no espaço amostral de cerca de 12.500 voluntários. Foi apresentado também o cronograma inicial para administração das vacinas (07/01/2021). Fonte: Folha de São Paulo

O Instituto Butantan apresentou à ANVISA o pedido de uso emergencial das 6 milhões de doses da vacina Coronavac, desenvolvida pelo laboratório Sinofar (08/01/2021). Fonte: G1
Fiocruz apresentou o pedido à ANVISA de uso emergencial de 2 milhões de doses da vacina desenvolvida em parceria entre a Universidade de Oxford e o Laboratório AstraZeneca, cuja produção será realizada no Brasil em Biomanguinhos (08/01/2021). Fonte: G1
O regulador de medicamentos do Reino Unido aprovou uso emergencial a vacina COVID-19 de Oxford e AstraZeneca, que será administrada em duas doses padrão - a segunda dentro de 12 semanas da primeira (30/12/2020). Fonte: TheBMJ
06/01/2021
A vacina contra o novo coronavírus da Moderna se tornou hoje (6) a segunda a receber aprovação da agência reguladora de medicamentos da Europa, com as autoridades acelerando a disponibilização de doses para conter a pandemia em meio às preocupações com novas variantes do vírus. Um ensaio clínico que envolveu cerca de 30 mil pessoas concluiu que a vacina da Moderna demonstrou uma eficácia de 94,1% na prevenção da COVID-19 em pessoas com mais de 18 anos. A vacina da Moderna é administrada em duas doses, com 28 dias de intervalo entre cada uma. Após o aval da Agência Europeia de Medicamentos (EMA), o passo final é a aprovação pela Comissão Europeia, o que deve acontecer rapidamente. O ensaio também demonstrou uma eficácia de 90,9% em participantes incluídos nos grupos de risco, com doenças pulmonares crônicas, doenças cardíacas, obesidade, diabetes ou infeção por HIV/Aids (06/01/2021). Fonte: Agencia Brasil
O regulador de medicamentos da Índia aprovou duas vacinas contra COVID-19 em 3 de janeiro, mas alguns cientistas e defensores dos pacientes são duramente críticos desta medida - em particular, à decisão de dar luz verde à Covaxin, uma vacina desenvolvida na Índia pela Bharat Biotech, sem esperar os resultados de um ensaio de fase III para determinar a eficácia e segurança. A Covaxin e outra vacina, a versão indiana de uma vacina desenvolvida pela Universidade de Oxford e AstraZeneca, foram aprovadas para “uso restrito” em uma situação de emergência e seus fabricantes teriam que continuar os ensaios clínicos iniciados no país. O presidente e diretor administrativo da Bharat Biotech disse que as aprovações de emergência das vacinas COVID-19 antes dos dados da fase III não são incomuns; ele citou o Sputnik V da Rússia e a vacina desenvolvida pela Sinopharm da China, os quais foram amplamente administrados com base em estudos com animais e dados de fase I e II (05/01/2021). Fonte: Science
04/01/2021
Artigo apresenta os resultados de segurança e imunogenicidade da vacina BBV152, uma vacina SARS-CoV-2 inativada de virus total formulada com uma molécula agonista TLR 7/8 adsorvida a alúmen (Algel-IMDG). O ensaio clínico duplo-cego randomizado controlado avaliou 375 participantes randomizados igualmente para receber três formulações de vacina (n = 100 cada) preparadas com 3 μg com Algel-IMDG, 6 μg com Algel-IMDG e 6 μg com Algel, e um braço de controle apenas com Algel (n = 75). As vacinas foram administradas em um esquema intramuscular de duas doses. Os desfechos primários foram reatogenicidade e segurança. Os resultados secundários foram imunogenicidade com base na resposta anti-IgG e neutralização de vírus de tipo selvagem. As respostas mediadas por células também foram avaliadas. A maioria dos eventos adversos foram leves e resolvidos. Todas as três formulações de vacinas resultaram em respostas imunes robustas comparáveis a um painel de soro convalescente. O BBV152 induziu a ligação e as respostas de anticorpos neutralizantes e, com a inclusão do adjuvante Algel-IMDG, passou a ser a primeira vacina inativada de SARS-CoV-2 onde foi relatada a induzição de uma resposta tendenciosa de Th1. Os títulos de anticorpos neutralizantes induzidos pelas vacinas foram relatados com duas cepas divergentes de SARS-CoV-2. O BBV152 é armazenado entre 2° C e 8° C. Ambas as formulações Algel-IMDG foram selecionadas para os ensaios de imunogenicidade de fase 2. Outros ensaios de eficácia estão em andamento (15/12/2020). Fonte: medRXiv
Ensaio clínico para investigar a prevenção da COVID-19 pela vacina de mRNA-1273 estabeleceu eficácia de 94.1%. O estudo envolveu 30.420 voluntários que foram designados aleatoriamente em uma proporção de 1:1 para receber a vacina ou o placebo (15.210 participantes em cada grupo). A vacina de mRNA-1273 consiste de mRNA encapsulado por nanopartículas lipídicas que codifica a proteína spike do SARS-CoV-2. COVID-19 foi confirmada em 185 voluntários do grupo placebo (56,5 por 1000 pessoas-ano) e em 11 participantes do grupo vacinado (3,3 por 1000 pessoas- anos). A eficácia da vacina, 94,1%, foi semelhante nas principais análises secundárias, incluindo avaliação 14 dias após a primeira dose, análises que incluíram participantes que tinham evidência de infecção por SARS-CoV-2 no início do estudo e análises em participantes com 65 anos de idade ou mais. COVID-19 grave ocorreu em 30 participantes, todos incluídos no grupo placebo, com uma fatalidade. Os eventos adversos graves foram raros e a incidência foi semelhante nos dois grupos (30/12/2020). Fonte: NEJM.
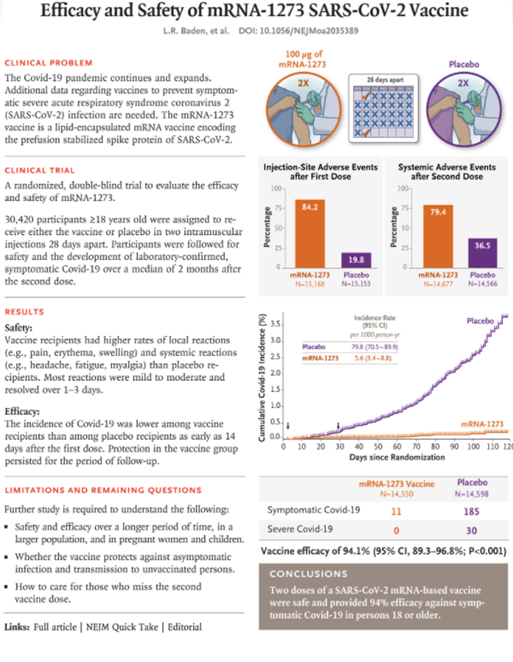
Estudo clínico em andamento investigou a eficácia e segurança da vacina candidata BNT162b2 contra COVID-19 e estabeleceu eficácia de 95%. BNT162b2 é uma vacina de RNA com nucleosídeos modificados formulada com nanopartículas lipídicas que codifica a proteína spike do SARS-CoV-2, ancorada na membrana e estabilizada por pré-fusão. O estudo incluiu 43.548 voluntários maiores de 16 anos que foram submetidos à randomização, dos quais 43.448 receberam injeções: 21.720 com BNT162b2 e 21.728 com placebo. Foram detectados 8 eventos de COVID-19, com início pelo menos 7 dias após a segunda dose, entre os participantes designados para receber BNT162b2 e 162 casos entre aqueles do grupo placebo. A eficácia da vacina BNT162b2, 95%, foi semelhante em subgrupos definidos por idade, sexo, raça, etnia, índice de massa corporal inicial e por doenças coexistentes. Entre 10 casos de COVID-19 grave com início após a primeira dose, 9 ocorreram no grupo placebo e 1 no grupo de BNT162b2. A incidência de eventos adversos graves foi baixa e semelhante nos grupos da vacina e do placebo (31/12/2020). Fonte: NEJM.
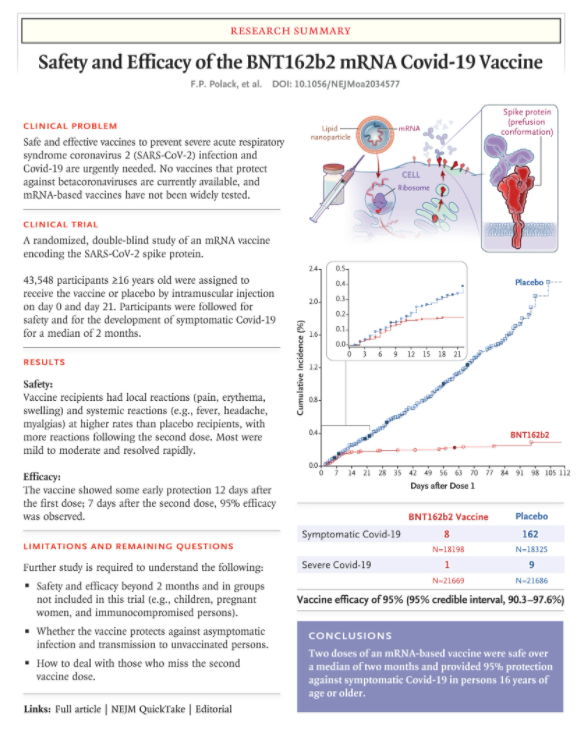
Artigo discute o perfil de reações alérgicas com administração de vacina baseada em mRNA, os autores apontam que os resultados tem sido positivos, com poucos efeitos colaterais, como dor, vermelhidão e inchaço foram observados com mais freqüência com as vacinas do que com o placebo. Sintomas sistêmicos como febre, fadiga, dor de cabeça e dores musculares e articulares também foram um pouco mais comuns com as vacinas do que com o placebo, e a maioria ocorreu durante as primeiras 24 a 48 horas após a vacinação. Nos ensaios das vacinas de mRNA Pfizer – BioNTech e Moderna, foram excluídos os participantes potenciais com histórico de reação alérgica a qualquer componente da vacina. Os estudos Pfizer – BioNTech também excluíram participantes com histórico de alergia grave associada a qualquer vacina. Hipersensibilidade os eventos adversos foram igualmente representados nos grupos de placebo (solução salina normal) e de vacina em ambos os ensaios. Os autores focam principalmente na composição das vacinas para a identificação prévia de sensibilidade aos excipientes (30/12/2020). Fonte: NEJM

O ministério da saúde alemão considerou atrasar as segundas doses da vacina Pfizer / BioNTech para fazer com que os suprimentos escassos fossem mais longe. No entanto, A BioNTech e a Pfizer alertaram que não tinham evidências de que a vacina continuaria a funcionar se a injeção de reforço fosse aplicada mais tarde do que o testado. Eles disseram que “a segurança e eficácia da vacina não foram avaliadas em esquemas de dosagem diferentes” (04/01/2021). Fonte: Reuters
Artigo discute os resultados positivos da vacinação com vacinas produzidas com plataformas de RNA focando na vacina da Moderna e aponta a eficácia acima de 90% e os efeitos colaterais leves em cerca de metade dos voluntários como dores de cabeça, após a segunda dose. Autores apontam que os efeitos colaterais graves foram raros e ocorreram com tanta frequência no grupo do placebo quanto no grupo vacinado (04/01/2021). Fonte: Nature
30/12/2020
O governo do Reino Unido aceitou hoje a recomendação da Agência Reguladora de Medicamentos e Produtos de Saúde inglesa (MHRA) para autorizar o uso emergencial da vacina contra o coronavírus ChAdOx1 nCoV-19 no Reino Unido. A vacina Oxford (ChAdOx1 nCoV-19) é feita a partir de uma versão enfraquecida de um vírus do resfriado comum (adenovírus), que foi geneticamente modificado para ser seguro e não se replicar em humanos. É estável, facilmente fabricado, transportado e armazenado em temperatura de geladeira doméstica (2-8 graus C) facilmente administrado em ambientes de saúde existentes, permitindo que a vacina seja distribuída muito rapidamente (30/12/2020). Fonte: University Oxford
O laboratório brasileiro União Química pediu à Anvisa autorização para realizar uma pesquisa clínica de Fase 3 no Brasil com a vacina russa contra a COVID-19 Sputnik V. A agência recebeu o pedido na noite dessa 3ª feira (29/12/2020). Fonte: Anvisa
Artigo apresenta os resultados de ensaio clínico de Fase 1–2 de uma vacina de nanopartícula de proteína S recombinante do SARS-CoV-2. Após 35 dias a vacina NVX-CoV2373 demonstrou ser segura e desencadeou respostas imunológicas que excederam os níveis no soro convalescente de pacientes que tiveram COVID-19. O adjuvante Matrix-M1 induziu respostas de células T CD4 + principalmente de fenótipo Th1 (10/12/2020). Fonte: NEJM
Depois de obter resultados promissores de estudos preliminares em macacos e humanos, Novavax lançou um ensaio de Fase 2 em 2.900 voluntários na África do Sul em agosto 2020 e, no mês seguinte, lançou um ensaio de Fase 3 com até 15.000 voluntários no Reino Unido. Espera-se que o estudo britânico entregue resultados no início de 2021. Em 28 de dezembro um estudo de Fase 3 com 30.000 voluntários nos Estados Unidos foi lançado. A Novavax fez um acordo com o Serum Institute of India para permitir a produção de até 2 bilhões de doses por ano. Se seus testes clínicos forem bem-sucedidos, a Novavax espera entregar 100 milhões de doses para uso nos Estados Unidos em 2021 (28/12/2020). Fonte: The New York Times
A farmacêutica Sinopharm disse que uma vacina candidata feita por seu braço do Instituto de Produtos Biológicos de Pequim teve uma taxa de eficácia de 79 por cento com base em uma análise provisória de testes de Fase 3. A Sinopharm disse que entrou com um pedido junto aos reguladores chineses para permitir que a vacina seja amplamente utilizada (30/12/2020). Fonte: The New York Times
23/12/2020
As reações alérgicas graves em pelo menos oito pessoas que receberam a vacina COVID-19 produzida pela Pfizer e BioNTech nas últimas 2 semanas podem ser devidas a um composto que envolve o RNA mensageiro (mRNA) que constitui o ingrediente principal da vacina. Cientistas continuam pesquisando. (21/12/2020). Fonte: Science
Para desenvolver uma vacina candidata contra COVID-19, foi gerado um Vetor Lentiviral (LV), induzindo anticorpos neutralizantes contra a glicoproteína Spike do SARS-CoV-2. A vacinação sistêmica por este vetor em camundongos, nos quais a expressão do receptor SARS-CoV-2 hECA2 foi induzida pela transdução de células do trato respiratório por um vetor adenoviral, confere proteção apenas parcial, apesar dos altos níveis de atividade neutralizante do soro. No entanto, induzir uma resposta imune no trato respiratório por meio de um reforço intranasal resulta em uma redução > 3 log10 nas cargas virais pulmonares e reduz a inflamação local. Além disso, as plataformas integrativas e não integrativas do LV exibem forte eficácia da vacina e inibem a lesão pulmonar deletéria em hamsters dourados, que são naturalmente permissivos à replicação do SARS-CoV-2 e espelham de perto a fisiopatologia do COVID-19 humano. Os resultados fornecem evidências de efeitos profiláticos marcados da vacinação baseada em LV contra SARS-CoV-2 e designam a imunização intranasal como uma abordagem poderosa contra COVID-19 (16/12/2020). Fonte: Cell Host & Microbe
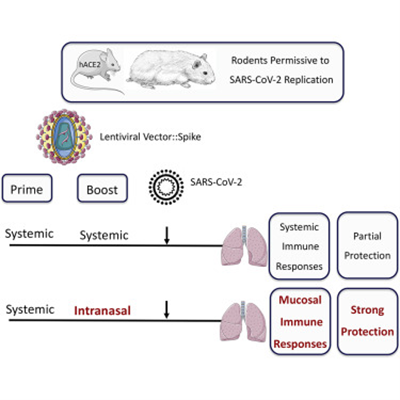
21/12/2020
As respostas de células T para SARS-CoV-2 são fortes e enviesadas em Th1 podem conduzir as respostas imunes humorais protetoras e mediadas por células e podem reduzir o potencial de aumento da COVID-19. As células T citotóxicas eliminam as células hospedeiras infectadas por vírus e contribuem para o controle da infecção. Estudos de pacientes infectados com SARS-CoV-2 sugeriram um papel protetor para as respostas imunes humorais e mediadas por células na recuperação de COVID-19. A vacina ChAdOx1 nCoV-19 (AZD1222) candidata contra SARS-CoV-2 que compreende um adenovírus símio deficiente para replicação que expressa a proteína de pico SARS-CoV-2 de comprimento total. Recentemente, foram relatados dados preliminares de segurança e imunogenicidade de um ensaio de fase 1/2 da vacina ChAdOx1 nCoV-19 (NCT04400838) administrada em regime de uma ou duas doses. A vacina foi tolerada, com indução de anticorpos neutralizantes e células T antígeno-específicas contra a proteína spike do SARS-CoV-2. Estudo descreve análises exploratórias das respostas imunes em adultos, com idade entre 18-55 anos, até 8 semanas após a vacinação com uma dose única de ChAdOx1 nCoV-19 neste estudo, demonstrando uma indução de uma resposta tendenciosa de Th1 caracterizado por interferon-γ e secreção de citocinas do fator de necrose tumoral-α por células T CD4 + e produção de anticorpos predominantemente de subclasses IgG1 e IgG3. Células T CD8 +, de fenótipos monofuncionais, polifuncionais e citotóxicos, também foram induzidas. Tomados em conjunto, esses resultados sugerem um perfil imunológico favorável induzido pela vacina ChAdOx1 nCoV-19, apoiando a progressão desta vacina candidata para estudos de fase 2/3 em andamento para avaliar a eficácia da vacina(17/12/2020). Fonte: Nature Medicine
A agência sanitária dos Estados Unidos, a Food and Drug Administration (FDA), aprovou na última sexta-feira (18/11) uma segunda vacina contra a COVID-19 para aplicação no país, desta vez produzida pela empresa Moderna. Antes da decisão da agência, um painel de consultores do FDA votou na quinta-feira (17/11), por 20 votos a 0 e uma abstenção, pela aprovação desta segunda vacina em território americano, avaliando que os benefícios da vacina superam os risco (18/12/2020). Fonte: BBC
18/12/2020
Vacina cubana contra o Coronavírus, Soberana 02 avança à segunda fase de testes. Segundo a reportagem, a Soberana 02, a primeira vacina da América Latina entrando na fase 2 dos testes clínicos, obteve resultados positivos na primeira fase de testes e o avanço das pesquisas foi aprovado pela Organização Mundial de Saúde (OMS), que monitora a pesquisa com vacinas contra o coronavírus em todo o mundo – duas delas cubanas. A vacina emprega tecnologia que combina o antígeno do coronavírus ao toxóide do tétano. A segunda fase dos testes deve envolver cerca de cem pessoas e a fase 2 B entre 300 e 600 pessoas. Já na fase 3, os pesquisadores prevêem a vacinação de 150 mil pessoas (18/12/2020). Fonte: Revista Forum
A vacina candidata contra a COVID-19, mRNA-1273, da empresa americana de biotecnologia Moderna, mostrou, em uma análise provisória de seu ensaio de fase III, que é 94,5% eficaz. O ensaio envolveu mais de 30.000 participantes norte-americanos, incluindo 7.000 com idade acima de 65 anos e 5.000 abaixo de 65 anos com doenças crônicas de alto risco. Mais de um terço (37%) dos participantes do estudo não são brancos, com 6.000 participantes identificados como hispânicos e mais de 3.000 identificados como negros. A Moderna anunciou ainda que a vacina pode ser mantida em freezer convencional por até seis meses e que, uma vez descongelada, pode ser mantida por até 30 dias em geladeira padrão. Isso torna a vacina muito mais fácil de aplicar (17/11/2020). Fonte: BMJ
Estudo relata o desenvolvimento de vacinas de nanopartículas conjugando covalentemente a ferritina 24-mer auto-montada ao domínio de ligação do receptor (RBD) e / ou subunidades de repetição de heptal (HR) da proteína S do SARS-CoV-2). Em comparação com as vacinas de monômero, as vacinas de nanopartículas produziram anticorpos neutralizantes e respostas imunes celulares mais robustas. Camundongos transgênicos hECA2 vacinados com nanopartículas RBD e RBD-HR exibiram carga viral reduzida nos pulmões após desafio com SARS-CoV-2. As vacinas de nanopartículas RBD-HR também promoveram anticorpos neutralizantes e respostas imunes celulares contra outros coronavírus. A vacinação com nanopartículas de macacos rhesus induziu anticorpos neutralizantes e respostas de células T e B antes do reforço da imunização; essas respostas persistiram por mais de três meses. Nanopartículas baseadas em RBD e HR apresentam, portanto, uma abordagem de vacinação promissora contra SARS-CoV-2 e outros coronavírus (25/11/2020). Fonte: Immunity
16/12/2020
O laboratório canadense Medicago e o britânico GlaxoSmithKline (GSK) anunciaram o início dos ensaios clínicos de fase 2 e 3 de sua vacina (VLP) contra a COVID-19, uma das candidatas em desenvolvimento ao redor do mundo, após obter uma resposta imunológica "encorajadora" de "100%" em 180 pessoas saudáveis que participaram de seus estudos clínicos de fase 1. A expectativa é que os estudos confirmem que tanto a fórmula quanto a dosagem, administradas com 21 dias de intervalo, são seguras e acionam uma resposta imunológica do corpo em adultos saudáveis com idades entre 18 e 64 anos e em idosos acima dos 65 anos de idade (12/11/2020). Fonte: G1
A Food and Drug Administration afirmou que a vacina contra a COVID-19 desenvolvida pela empresa Moderna Inc. é "altamente eficaz". A agência publicou documentos online, preparados por sua equipe e pela Moderna Inc., analisando a segurança e a eficácia da vacina em um grande estudo clínico. Os resultados serão apresentados a um painel consultivo independente que votará na quinta-feira (17/12/2020) sobre a recomendação da autorização do FDA. Salvo complicações, a FDA pretende autorizar o uso emergencial da vacina Moderna na sexta-feira (18/12/2020), seguindo o mesmo cronograma da primeira vacina contra a COVID-19 da Pfizer Inc. e BioNTech SE (15/12/2020). Fonte: The Wall Street Journal
A vacina candidata contra a COVID-19, desenvolvida pela empresa estatal chinesa Sinopharm e o Instituto de Produtos Biológicos de Pequim, foi considerada 86% eficaz contra a infecção por SARS-CoV-2. O Ministério da Saúde e Prevenção dos Emirados Árabes Unidos divulgou um comunicado no dia 9 de dezembro, alegando que havia revisado a análise provisória de um ensaio clínico de fase III que está em andamento no país e inscreveu 31.000 pessoas. Eles relataram ainda que a vacina inativada foi 100% eficaz na prevenção de casos moderados e graves da doença e não apresentou problemas de segurança graves. Mas nenhum detalhe adicional foi divulgado. Em setembro, essa vacina recebeu autorização de uso emergencial dos Emirados Árabes Unidos e foi utilizada para funcionários da linha de frente (09/12/2020). Fonte: Ministério da Saúde dos Emirados Árabes
As vacinas podem conferir proteção induzindo células plasmáticas de vida longa (LLPCs) e células B de memória (MBCs), tipos de células gerados canonicamente durante reações do centro germinativo (GC). Aqui, comparamos diretamente duas plataformas de vacinas - vacinas de mRNA e uma proteína recombinante formulada com um adjuvante semelhante ao MF59 - identificando quantitativa e qualitativamente respostas de GC primárias específicas para SARS-CoV-2 ao longo do tempo. Foi demonstrado que uma única imunização com mRNA de SARS-CoV-2, mas não com a vacina de proteína recombinante, desencadeou respostas celulares GC potentes B e T foliculares auxiliares específicas para SARS-CoV-2 (Tfh), bem como LLPCs e MBCs. É importante ressaltar que as respostas de GC estão fortemente correlacionadas com a produção de anticorpos neutralizantes. As vacinas de mRNA induziram reguladores-chave de células Tfh de forma mais eficiente e influenciaram as propriedades funcionais das células Tfh. No geral, este estudo identifica as vacinas de mRNA da SARS-CoV-2 como fortes candidatas para a promoção de respostas imunes derivadas de resposta GC robustas (15/12/2020). Fonte: Immunity
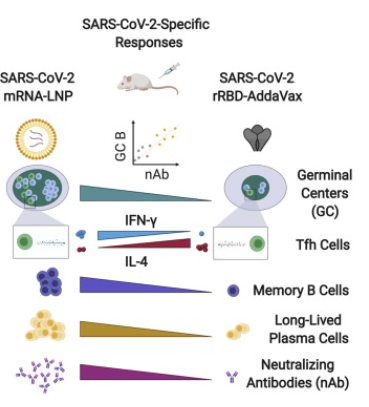
Artigo analisa o processo de desenvolvimento da vacina e os sistemas em vigor para garantir a segurança e eficácia (09/12/2020). Fonte: Pediatric annals
14/12/2020
Cientistas do Reino Unido e da Rússia devem testar se a combinação das vacinas Oxford/AstraZeneca e Sputnik V poderia resultar em melhor proteção contra o SARS-CoV-2 do que a administração de duas doses de uma única vacina. Assim como a vacina Oxford/AstraZeneca, a vacina russa Sputnik V é baseada em uma versão modificada do adenovírus, um vírus do resfriado comum. Um problema potencial deste tipo de vacina, no entanto, é o da “imunidade anti-vetor”, quando o sistema imunológico pode destruir o adenovírus em caso de já ter havido contato prévio. É por esta razão que o grupo da Universidade de Oxford escolheu usar um adenovírus de chimpanzé, em vez de um humano. A imunidade anti-vetor também pode reduzir a eficácia das vacinas de reforço, se isso envolver a injeção do mesmo vírus como vetor na segunda ou terceira dose da vacina. Misturar e combinar diferentes vacinas pode fornecer uma solução. Esse conceito é conhecido como “prime-boost” heterólogo e tem sido usado em programas de vacinação contra outras doenças (11/12/2020). Fonte: The Guardian
Patrocinadores da vacina candidata contra COVID-19 da Austrália anunciaram hoje a suspensão de seu desenvolvimento, depois que algumas das primeiras pessoas a receber a vacina em um ensaio de segurança geraram anticorpos para um alvo não intencional, o vírus da AIDS. A tecnologia de “clamp molecular” (grampo molecular) da vacina australiana foi desenvolvida por pesquisadores da Universidade de Queensland e baseia-se numa configuração específica da proteína antígeno (proteína spike), que expõe partes escondidas em sua forma pós-fusão e pode gerar uma resposta mais robusta de anticorpos. Mas esta conformação da proteína spike é instável, então a equipe australiana introduziu um material molecular - a pinça molecular - para mantê-la na posição: um pequeno fragmento de 80 aminoácidos de uma proteína do HIV, que era capaz de fornecer a estabilidade necessária. Embora o componente molecular do HIV não representasse uma infecção real pelo HIV, os desenvolvedores da vacina e o governo australiano concluíram que uma ampla distribuição da vacina candidata prejudicaria os testes de diagnóstico de HIV e decidiram não prosseguir com ensaios clínicos para avaliação da proteção contra COVID-19. O evento ilustra que, dada a forte eficácia demonstrada por várias outras vacinas contra COVID-19 em teste, é provável que outras candidatas em desenvolvimento tenham agora uma barreira maior para superar para seguir em frente (11/12/2020). Fonte: Science
A presidente da Fundação Oswaldo Cruz (Fiocruz) informou que o primeiro lote da vacina de Oxford estará disponível no fim de fevereiro. A expectativa é que, a partir dele, 15 milhões de doses sejam entregues mensalmente no Brasil, chegando a 100,4 milhões até julho do ano que vem. A vacina inglesa tem eficácia mínima de 62% e os resultados do estudo já foram entregues ao Ministério da Saúde. As informações foram apresentadas na manhã desta segunda-feira (14), durante uma reunião do Fórum Rio Desenvolvimento. No evento, a presidente da Fiocruz explicou a importância do plano de vacinação no Brasil e as ações de combate à pandemia no estado do Rio de Janeiro (14/12/2020). Fonte: CNN Brasil
10/12/2020
O painel do Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados (VRBPAC) da Food and Drug Administration (FDA) dos EUA aprovou no dia 10 de dezembro, após discussão, a recomendação do pedido de autorização de uso de emergência (EUA) da vacina contra COVID-19 da Pfizer, Inc. em parceria com a BioNTech Manufacturing GmbH (10/12/2020). Fonte: FDA
Um total de 43.548 participantes foram submetidos à randomização, dos quais 21.720 receberam a vacina BNT162b2 e 21.728 placebo. Houve 8 casos de COVID-19 com início pelo menos 7 dias após a segunda dose entre os participantes designados para receber BNT162b2 e 162 casos entre aqueles designados para receber placebo. O BNT162b2 foi 95% eficaz na prevenção da COVID-19 (intervalo de credibilidade de 95%, 90,3 a 97,6). Eficácia de vacina semelhante (geralmente 90 a 100%) foi observada em todos os subgrupos definido por idade, sexo, raça, etnia, índice de massa corporal de base e a presença de condições coexistentes. O perfil de segurança de BNT162b2 foi caracterizado por dor leve a moderada de curto prazo no local da injeção, fadiga e dor de cabeça. A incidência de eventos adversos graves foi baixo e foi semelhante nos grupos da vacina e do placebo (10/12/2020). Fonte: The New England Journal of Medicine
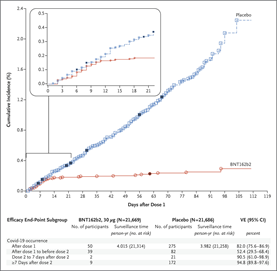
A FDA divulgou uma análise detalhada na terça-feira (10/12/2020) de manhã da vacina COVID-19 da Pfizer (BNT162b2) e seu parceiro BioNTech que aconselhará a agência sobre se deve conceder à vacina uma autorização de uso de emergência. A análise da agência revela que "não foram identificadas preocupações de segurança específicas que impeçam a emissão de uma autorização de uso emergencial nos EUA". As reações graves foram raras. Os efeitos colaterais são comuns, no entanto, com a maioria dos voluntários do estudo experimentando reações no local da injeção, dores de cabeça e fadiga. A análise também afirma a eficácia da vacina previamente declarada de 95%, avaliada uma semana após duas doses da vacina. As doses da vacina são administradas com 21 dias de intervalo (10/12/2020). Fonte: FDA1 FDA2
O Canadá aprovou nesta quarta-feira (09/12) a vacina contra COVID-19 desenvolvida pela multinacional Pfizer em parceria com a empresa alemã Biontech, um dia depois de o Reino Unido ter se tornado o primeiro país a iniciar a vacinação em massa com este imunizante. A agência reguladora canadense diz que imunizante da Pfizer-Biontech atende a requisitos rigorosos de segurança e eficácia e dá aval para vacinação. Primeiras doses chegam ao país ainda neste mês (10/12/2020). Fonte: DW
Notícia apresenta a situação dos imunizantes em desenvolvimento por Sinovac, Oxford/AstraZeneca, Instituto Gamaleya, Moderna, Johnson e Pfizer/BioNTech. Mostrando o estágio de aprovação e aquisição em cada país (10/12/2020). Fonte: G1
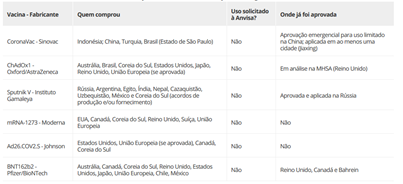
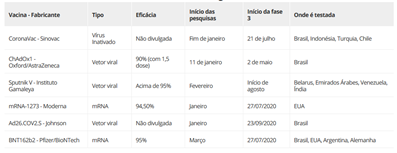
Pesquisadores investigam a relação entre a vacinação BCG e SARS‐CoV‐2 por abordagem de bioinformática. Dois conjuntos de dados para o grupo de infecção com SARS-CoV‐2 e grupo vacinado com BCG foram baixados. Genes expressos diferencialmente foram identificados. A ontologia e os caminhos do gene foram enriquecidos funcionalmente e a rede foi construída no NetworkAnalyst. Por fim, foi estabelecida a correlação entre a vacinação pós-BCG e as assinaturas do transcriptoma COVID-19. As 45 vias comuns reguladas positivamente em SARS-CoV-2 e regulação negativa na vacinação BCG sugerem que a vacinação BCG pode ajudar a mitigar a desregulação da via. Dada a relação inversa das vias específicas destacadas nos resultados apresentados, a vacina BCG pode incorrer em um papel protetor contra COVID-19 ao montar uma resposta imunológica não específica (02/12/2020). Fonte: Journal of Medical Virology
Pesquisadores apresentam a hipótese de que a vacinação contra o tétano pode estar contribuindo para a redução da gravidade da infecção por COVID-19 e incentivam mais pesquisas para validar ou invalidar a eficácia da vacina de toxóide tetânico contra COVID-19. Esta hipótese foi revelada por um sistema de inteligência artificial baseado em conjuntos de dados biomédicos públicos e abertos. Concluiu-se que as correlações de fontes múltiplas são mais do que uma coincidência fortuita que merece uma investigação mais aprofundada (28/11/2020) Pre proof. Fonte: Medical Hypotheses
08/12/2020
O Reino Unido começou nesta terça-feira (8) a vacinar sua população contra a COVID-19 com a vacina da farmacêutica norte-americana Pfizer e da empresa alemã de biotecnologia BioNTech. O país europeu é o primeiro a iniciar campanha de vacinação com a vacina desenvolvida pela parceria das duas empresas, o que pode ser um divisor de águas no combate ao novo coronavírus (08/12/2020). Fonte: G1
A FDA divulgou nesta terça-feira (8) um documento que detalha informações sobre a eficácia da vacina BNT162b2, desenvolvida pela Pfizer em parceria com a BioNTech. De acordo com o documento, a FDA confirmou a eficácia de 95% da vacina, cerca de sete dias após a aplicação da segunda dose. Mesmo assim, foi relatado que a vacina traz uma certa proteção se também for aplicada em apenas uma dose. A ideia das empresas é que duas doses de 30 microgramas sejam aplicadas em um intervalo de 21 dias. Ainda segundo o documento divulgado pela FDA, a eficácia da vacina durante o intervalo entre a primeira e a segunda dose é de 52,4%, o que não significa que apenas uma dose seria o suficiente para uma imunização segura. Além da eficácia, foram relatadas as reações que a vacina pode causar no organismo, como fadiga, dor de cabeça e muscular, calafrios, dores articulares e febre (08/12/2020). Fonte: CNN
Estudo avalia a segurança e eficácia da vacina ChAdOx1 nCoV-19 em uma análise interina agrupada de quatro ensaios. Esta análise inclui dados de quatro estudos cegos, randomizados e controlados em andamento feitos em todo o Reino Unido, Brasil e África do Sul. Os participantes com 18 anos ou mais foram atribuídos aleatoriamente (1:1) ao ChAdOx1 nCoV-19 vacina ou controle (vacina meningocócica do grupo A, C, W e Y conjugada ou solução salina). O grupo nCoV-19 recebeu duas doses contendo 5 × 10¹⁰ partículas virais (dose padrão; coorte SD / SD); um subconjunto no Reino Unido do ensaio recebeu meia dose como primeira dose (dose baixa) e uma dose padrão como segunda dose (coorte LD / SD). A análise de eficácia primária incluiu COVID-19 sintomático em participantes soronegativos com um ácido nucleico zaragatoa com teste de amplificação positivo mais de 14 dias após uma segunda dose da vacina. Os participantes foram analisados de acordo com o tratamento recebido, com corte de dados em 4 de novembro de 2020. A eficácia da vacina foi calculada como um risco relativo derivado de um modelo de regressão de Poisson robusto ajustado para a idade (08/12/2020). Fonte: The Lancet
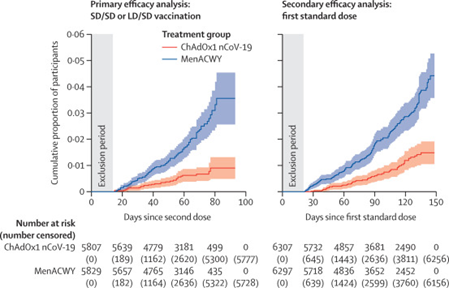
A Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) independente do Reino Unido aprovou a vacina COVID-19 da Pfizer e da BioNTech. A vacina de mRNA, BNT162b2, foi considerada até 95% eficaz 28 dias após a primeira dose em um estudo de fase III. O estudo avaliou 170 casos confirmados de COVID-19, 162 dos quais foram observados no grupo de placebo. Houve 10 casos graves, nove dos quais no grupo do placebo. A vacina será transportada em gelo seco, pois deve ser armazenada por volta de T= -70°C. Depois de entregue, pode ser guardado no frigorífico durante cinco dias (02/12/2020). Fonte: BMJ
Atualizações da pesquisa COVID: uma vacina contra o coronavírus mostra benefícios duradouros. A empresa de biotecnologia Moderna em Cambridge, Massachusetts, relatou que sua vacina é mais de 94% eficaz na prevenção de COVID-19. Para avaliar se essa proteção dura, pesquisadores analisaram o sangue de 34 voluntários do estudo que receberam duas doses da vacina com um mês de intervalo. Os níveis de anticorpos que se ligam a uma proteína chave SARS-CoV-2 atingiram um pico de 1 a 2 semanas após a segunda vacina e caíram apenas ligeiramente nos 2,5 meses subsequentes. Quatro meses após a primeira injeção, seus sangues ainda continham anticorpos ‘neutralizantes’ que desativam o vírus, e nenhum dos participantes experimentou quaisquer efeitos colaterais graves relacionados à vacina. Os resultados mostram que a vacina pode fornecer uma resposta de anticorpos “durável”, escrevem os autores (08/12/2020). Fonte: Nature
Pesquisadores descrevem os dados de imunogenicidade após 119 dias da primeira vacinação (90 dias após a segunda vacinação) em 34 participantes adultos saudáveis no mesmo ensaio que receberam duas injeções de vacina de RNA mensageiro, mRNA-1273 (na dose de 100 μg), para prevenir a infecção por SARS-CoV-2. As injeções foram recebidas com 28 dias de intervalo. Os receptores foram estratificados de acordo com a idade (18 a 55 anos, 56 a 70 anos, ou ≥71 anos), e os ensaios usados foram descritos anteriormente. Anticorpos neutralizantes séricos continuaram a ser detectados em todos os participantes no dia 119. Embora os correlatos de proteção contra a infecção por SARS-CoV-2 em humanos ainda não estejam estabelecidos, esses resultados mostram que, apesar de um ligeiro declínio esperado nos títulos de ligação e anticorpos neutralizantes, o mRNA-1273 tem o potencial de fornecer imunidade humoral durável. A infecção natural produz longevidade variável de anticorpos e pode induzir respostas robustas de células B de memória, apesar da baixa atividade neutralizante do plasma. Embora a resposta celular de memória ao mRNA-1273 ainda não esteja definida, esta vacina induziu respostas T auxiliares de tipo 1 de CD4 primárias após 43 dias da primeira vacinação e estudos de células B induzidas por vacina estão em andamento. Os resultados fornecem suporte para o uso de uma dose de 100 μg de mRNA-1273 em um estudo de fase 3 em andamento, que recentemente mostrou uma taxa de eficácia de 94,5% em uma análise intermediária (03/12/2020). Fonte: NEJM
Pesquisadores discutem os ensaios de vacinas COVID-19 controlados por placebo e explicam o porquê de ainda precisarmos deles. Segundo os cientistas, como centenas de milhões de pessoas em alguns grupos prioritários acabarão sendo vacinadas contra a COVID-19, o mundo precisa de evidências altamente confiáveis da segurança da vacina que possam ser explicadas ao público de maneira direta e convincente. Eles alertam ainda que os estudos atuais de fase 3 geralmente fornecem dados controlados sobre cerca de 20.000 receptores de vacina e 20.000 receptores de placebo e que, embora esses números devam ser suficientes para detectar eventos adversos relativamente comuns, existe o risco de omitir ou exagerar eventos menos comuns, mas clinicamente importantes. Como um grande número de pessoas será vacinado rapidamente, a vacinação inevitavelmente parecerá estar temporariamente associada a alguns eventos adversos incomuns (02/12/2020). Fonte: NEJM
Quatro vacinas estão em teste no Brasil. Nenhuma delas foi aprovada e registrada pela Anvisa. Os dados gerais sobre as empresas desenvolvedoras e a fase atual da vacina pode ser verificado na figura que se segue (07/12/2020). Fonte: UOL

Sítio faz acompanhamento constante das vacinas em estágio mais avançado. Hoje, são 58 vacinas em estudo clínico e 86 em estudos pré-clínicos mais avançados. Das vacinas em Fase 3, 7 tem autorização de uso limitado, principalmente na China e Rússia e uma teve autorização para comercialização (08/12/2020). Fonte: NYTimes
07/12/2020
Uma empresa de biotecnologia portuguesa Immunethep desenvolveu uma possível vacina intra-nasal contra a Covid-19. A vacina portuguesa é composta pelo SARS-CoV-2 inativado por um químico chamado beta-propiolactona. A vantagem de utilizar a totalidade do vírus (não apenas uma parte, como é a estratégia da Moderna, por exemplo) é que, se o SARS-CoV-2 sofrer uma mutação, o corpo continuará a reconhecê-lo. Utilizando apenas uma parte do vírus, se essa porção sofrer uma mutação, o organismo poderá já não ser capaz de o identificar. O diretor espera ter resultados positivos nos próximos meses. Se a vacina da Immunethep for segura e eficaz, a produção será feita com uma empresa no Canadá (29/11/2020). Fonte: Jornal Nacional (Portugal)
Opinião de especialistas aponta para o fato de que a logística de administração de vacinas vai bem além da vacina em si. Passando por toda a estrutura necessária a administração, como seringas e agulhas. Bem como discutem a necessidade do país diversificar a oferta de vacinas, indo além das que se enquadram na estrutura existente hoje, que limita a escolha a questão da conservação até 8º. A Pfizer (vacina de RNA que deve ser conservada a -75º) alerta que ciente do desfio de logística, desenvolveu embalagem que permite a conservação da temperatura ideal por 15 dias e que as vacinas poderiam ficar em refrigerador comum por até 5 dias (06/12/2020). Fonte: A Gazeta
Pfizer divulga documento detalhado (bula) direcionado para profissionais de saúde, orientando sobre todo o processo e acompanhamento durante a administração da vacina. A empresa também apresentou documentação para o início do processo de registro da vacina no Brasil (07/12/2020). Fonte: G1
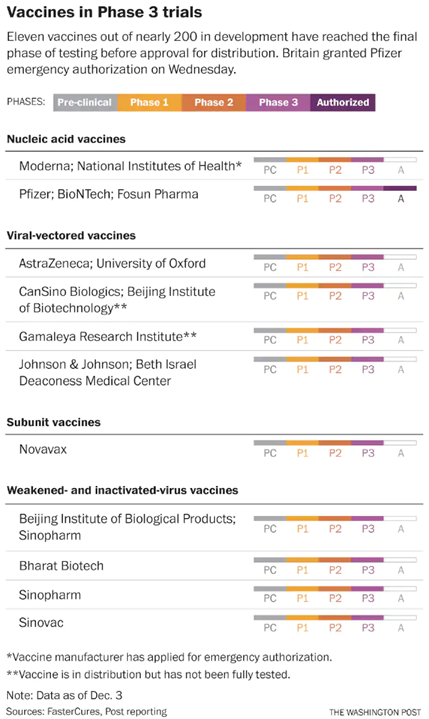
O FDA apresentará ao público pela primeira vez sua visão da vacina experimental contra o SARS-CoV-2 da farmacêutica Pfizer e da alemã BioNTech, quando divulgará sua avaliação dos dados de segurança e eficácia. Funcionários da agência utilizarão o painel para dizer que os dados de segurança e eficácia da Pfizer justificam uma autorização de uso emergencial para a vacina. E, segundo a reportagem, é provável que considerem um “rótulo” amplo, dizendo que a vacina deve ser usada para prevenir a COVID-19 em pessoas com 16 anos ou mais, uma vez que não há dados suficientes para crianças. Autorizações de emergência são aprovações temporárias usadas para acelerar a disponibilidade de produtos médicos durante uma emergência de saúde pública. Eles exigem menos dados do que aprovações completas. O FDA disse, no entanto, que aplicará critérios rigorosos porque milhões de pessoas saudáveis devem receber a vacina (07/12/2020). Fonte: The Washington Post
Das cerca de 200 vacinas em desenvolvimento contra a COVID-19, 11 (onze) estão em fase final de testes clínicos (fase 3) antes da aprovação e distribuição. A vacina da farmacêutica Pfizer já recebeu autorização para uso emergencial. A vacina da farmacêutica Moderna entrou com pedido de autorização para uso emergencial. As vacinas da CanSino Biologicas e do Gamaleya Reserch Institute já estão sendo distribuídas localmente sem terem sido completamente testadas e aprovadas (04/12/2020). Fonte: Washington Post
Estudo emprega várias ferramentas de imunoinformática para projetar um polipeptídeo de vacina de múltiplos epítopos com o maior potencial para ativar o sistema imunológico humano contra SARS-CoV-2. O conjunto inicial de epítopos foi extraído de todo o conjunto de proteínas estruturais virais. Potenciais não tóxicos e não alergênicos de ligação de células T e células B e epítopos indutores de citocinas foram então identificados através de uma previsão a priori. Os epítopos selecionados foram ligados uns aos outros com ligantes apropriados, seguido por anexar um adjuvante adequado para aumentar a imunogenicidade do polipeptídeo da vacina. A modelagem molecular da estrutura 3D da construção da vacina, docking, simulações de dinâmica molecular e cálculos de energia livre confirmaram que o peptídeo da vacina tinha alta afinidade para a ligação do receptor 3 do tipo Toll e que o complexo vacina-receptor era altamente estável. O projeto de polipeptídeo de vacina captura as vantagens dos epítopos estruturais e simultaneamente integra precauções para evitar efeitos colaterais relevantes, sugere-se que seja promissor para a elicitação de uma resposta imune eficaz e segura contra SARS-CoV-2 in vivo (30/11/2020). Fonte: Scientific reports

04/12/2020
O governo de São Paulo recebe mais 600 litros a granel da vacina CoronaVac, correspondente a um milhão de doses. A remessa totaliza 1 milhão 120 mil doses enviadas pela farmacêutica chinesa Sinovac ao estado. O governo do estado revela que, ao todo serão 46 milhões de doses, sendo 6 milhões já prontas para aplicação e 40 milhões em forma de matéria-prima para produção, envase e rotulagem em fábrica própria do Instituto Butantan. A disponibilização para a população ocorrerá somente após a comprovação da eficácia, que pode ocorrer após a conclusão da terceira fase dos estudos clínicos e posterior aprovação e registro por parte da Anvisa. Do total de voluntários que receberam vacina ou placebo, apenas 35% apresentaram algum tipo de reação adversa, mas todas elas classificadas como leves, como febrícula ou dor no local da aplicação (03/12/2020). Fonte: Costa Norte de Comunicação
O comitê de medicamentos humanos da European Medicines Agency (CHMP) deu início a uma revisão contínua do Ad26.COV2.S, uma vacina COVID-19 da Janssen-Cilag International N.V. A decisão do CHMP de iniciar a revisão contínua é baseada em resultados preliminares de estudos laboratoriais e estudos clínicos iniciais em adultos. Esses estudos sugerem que a vacina desencadeia a produção de anticorpos e células imunes que têm como alvo o coronavírus SARS-CoV-2 (01/12/2020). Fonte: European Medicines Agency
A European Medicine Agency (EMA) recebeu um pedido de autorização condicional de comercialização (CMA) para BNT162b2, uma vacina de mRNA COVID-19 desenvolvida pela BioNTech e Pfizer. A avaliação do BNT162b2 ocorrerá em um cronograma acelerado. Pode ser emitido um parecer sobre a autorização de introdução no mercado dentro de semanas, dependendo se os dados apresentados são suficientemente sólidos e completos para demonstrar a qualidade, segurança e eficácia da vacina. A EMA também analisou os resultados sobre a eficácia da vacina e os dados de segurança iniciais emergentes de um ensaio clínico em grande escala assim que foram disponibilizados. A EMA irá agora avaliar os dados apresentados como parte do pedido formal de autorização condicional de introdução no mercado (01/12/2020). Fonte: European Medicines Agency
Estudo utiliza a glicoproteína de membrana (M), presentes nos envelopes dos coronavírus, para o desenho de uma vacina multiepítopo por abordagem de imunoinformática. Os epítopos de células B e T usados para a construção da vacina eram antigênicos, não alérgicos e não tóxicos. Um adjuvante, β-defensina e sequência PADRE foram incluídos na extremidade N-terminal da vacina. Vários parâmetros físico-químicos da vacina foram avaliados. Estruturas secundárias e terciárias foram previstas para a construção da vacina. A estrutura terciária foi posteriormente refinada, e vários parâmetros relacionados ao refinamento da estrutura da proteína foram validados usando diferentes ferramentas.. A análise da cobertura da população mostrou que a vacina de múltiplos epítopos cobre 94,06% da população global. A construção da vacina foi clonada com sucesso in silico em pET-28a (+). Estudos de simulação imune mostraram a indução de respostas imunes primária, secundária e terciária marcadas pelo aumento dos níveis de anticorpos, INF-γ, IL-2, TGF-β, células B-, células CD4 + e CD8 +. Finalmente, a construção da vacina foi capaz de induzir a resposta imune conforme desejado (30/11/2020). Fonte: Journal of Biomolecular Structure and Dynamics

02/12/2020
O Reino Unido aprovou, nesta quarta-feira (2), a vacina contra a Covid-19 desenvolvida pelas farmacêuticas Pfizer e BioNTech e anunciou que prevê iniciar a vacinação na semana que vem. Um primeiro lote com 10 milhões de doses será disponibilizado pelo NHS, serviço público de saúde britânico, ainda em 2020. Por causa das condições de armazenamento da vacina – que precisa ser mantida a -70°C – as campanhas de vacinação serão feitas em hospitais (02/12/2020). Fonte: G1
A farmacêutica americana Pfizer e o laboratório de biotecnologia alemão BioNTech soilicitaram ao regulador de medicamentos da Europa autorização para o uso emergencial de sua vacina contra a COVID-19 no continente. As duas companhias submeteram anteriormente pedidos semelhantes nos Estados Unidos e no Reino Unido e, na última semana, divulgaram que seu imunizante candidato é 95% eficaz contra o novo coronavírus. O pedido feito na Europa conclui o processo de análise contínua, que foi iniciada junto à EMA em 6 de outubro, e poderia permitir o uso do BNT162b2 na Europa antes do final de 2020 (01/12/2020). Fonte: O Globo
A Anvisa recebeu pedido de submissão contínua da vacina contra a COVID-19 do laboratório Janssen-Cilag. Com a abertura do processo na sexta-feira (27), o laboratório enviou também o primeiro pacote referente aos dados de qualidade do produto, o AD26.COV2.S. Na submissão contínua, os laboratórios devem apresentar os pacotes de dados de qualidade e de eficácia/segurança. Este é quarto laboratório a enviar dados por submissão contínua para vacina contra a COVID-19. Com isso, todos os laboratórios com pesquisa de vacinas em andamento no Brasil já iniciaram o envio de dados prontos e consolidados que serão necessários para o futuro pedido de registro (28/11/2020). Fonte: Agência Brasil
Uma equipe de inspetores, designados pela Anvisa (Agência Nacional de Vigilância Sanitária), já está na China em missão para vistoriar as empresas Sinovac e Wuxi Biologics, envolvidas nas pesquisas de vacinas contra a COVID-19. Em comunicado, a Anvisa esclareceu que a equipe segue uma agenda de trabalho que se estenderá até sexta-feira (4) na empresa Sinovac, onde eles verificam as práticas de fabricação da vacina CoronaVac, que está em fase de testes no Brasil, em parceria com o Instituto Butantan. Do dia 7 ao dia 11, a equipe estará na Wuxi Biologics, que produz os insumos para a vacina da farmacêutica AstraZeneca, que está desenvolvendo o imunizante em parceria com a Universidade de Oxford. Esta vacina também está sendo testada no Brasil e, em caso de sucesso, será fabricada no país pela Fiocruz (01/12/2020). Fonte: Agência Brasil
A Anvisa disponibilizou nesta quarta-feira (2/12) um guia sobre os requisitos mínimos para solicitações de autorização de uso emergencial, em caráter experimental, de vacinas contra COVID-19. O documento tem como objetivo orientar as empresas desenvolvedoras de vacinas sobre os dados e as informações necessárias para apoiar a decisão da Agência na emissão de autorização temporária para vacinas experimentais (02/12/2020). Fonte: Anvisa
Artigo apresenta o domínio de ligação ao receptor (RBD) da proteína S de SARS-CoV-2 como uma nova estratégia para vacinas contra COVID-19. Uma vacina recombinante direcionada ao domínio de ligação ao receptor (RBD) da proteína S do SARS-CoV-2 pode induzir uma resposta imune protetora. A proteína RBD recombinante foi expressa em células de inseto usando o sistema Bac-to-Bac e precipitada com Alumínio para formulação de vacina. Após a vacinação dos macacos primatas não humanos com a vacina RBD, anticorpos séricos que poderiam se ligar ao RBD e neutralizar a infecção viral foram efetivamente induzidos, fornecendo a justificativa para o desenvolvimento de uma vacina protetora através da indução de anticorpos contra o RBD (26/11/2020). Fonte: Cellular & Molecullar Immunology
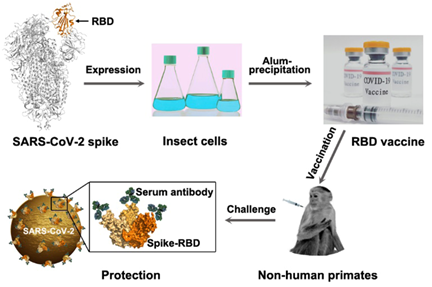
30/11/2020
A Altimmune submeteu um pedido ao FDA para iniciar um estudo clínico de Fase I de sua vacina candidata COVID-19. A empresa está em vias de iniciar em dezembro o estudo clínico da vacina candidata AdCOVID. O AdCOVID induz uma ampla resposta imune, incluindo imunidade sistêmica (anticorpo neutralizante) e local (IgA mucosa e células T de memória residentes) na cavidade nasal e no trato respiratório (26/11/2020). Fonte: Pharmaceutical Technology
Como aproximadamente 2-4% dos 50 milhões de infectados com SARS-CoV-2 sucumbiram à COVID-19, o departamento de Saúde e Serviços Humanos dos EUA organizou uma parceria público-privada chamada Operation Warp Speed (OWS) para desenvolver, produzir e entregar 300 milhões de doses de vacinas seguras e eficazes com uma meta de janeiro de 2021. Nesta parceria, 6 candidatas são apoiadas com mais de US$ 10 bilhões. Essa abordagem sem precedentes pretende investir na fabricação de produtos candidatos antes da aprovação do produto, o que é possível graças à nova plataforma farmacêutica de novos genes e tecnologia recombinante que estão acelerando o cronograma de estudos clínicos de cerca de 10 para menos de 1 ano. Prevê-se que um ou mais das 6 vacinas candidatas sob a iniciativa OWS serão seguras, eficazes e fornecerão uma resposta imunológica sustentada para prevenir a infecção e a progressão da doença (10/11/2020) Pre-proof. Fonte: Journal of Pharmaceutical Sciences
A Moderna assinou um acordo com o governo do Reino Unido para fornecer mais dois milhões de doses de sua vacina candidata COVID-19, mRNA-1273, a partir de março do próximo ano. Co-desenvolvido pelos investigadores da Moderna e do NIAID Vaccine Research Center, a vacina candidata de mRNA codifica uma forma estabilizada de pré-fusão da proteína Spike (S) (30/11/2020). Fonte: Pharmaceutical Technology
Moderna anuncia análise de eficácia primária no estudo COVE de fase 3 para sua candidata à vacina COVID-19 e pede hoje registro junto ao FDA dos EUA para Autorização de Uso Emergencial da vacina. O estudo COVE da vacina mRNA-1273 envolveu 30.000 participantes tendo sido registados 196 casos de COVID-19, dos quais 30 casos foram graves. A eficácia da vacina contra COVID-19 foi de 94,1% enquanto que a eficácia da vacina contra COVID-19 grave foi de 100%. A vacina mRNA-1273 continua a ser geralmente bem tolerada, não gerando nenhuma preocupação séria de segurança identificada até o momento. O estudo COVE de fase 3 excedeu 2 meses de acompanhamento médio pós-vacinação, conforme exigido pelo FDA dos EUA para Autorização de Uso Emergencial (30/11/2020). Fonte: Moderna
A empresa americana COVAXX anunciou compromissos de compra antecipada de US $ 2,8 bilhões de mais de 140 milhões de doses de sua vacina UB-612 a serem entregues em países como Brasil, Equador e Peru. A UB-612 é uma vacina de peptídeo sintético multiepitopo que pode potencialmente ativar os braços de células B e T do sistema imunológico. O desenvolvimento mais recente segue o início dos testes em humanos em Taiwan (26/11/2020). Fonte: Pharmaceutical Technology
A BioNTech e a Shanghai Fosun Pharmaceutical (Fosun Pharma) iniciaram o ensaio clínico de Fase II do seu candidato a vacina de mRNA Covid-19, BNT162b2, em Taizhou e Lianshui, província de Jiangsu, China (26/11/2020). Fonte: Pharmaceutical Technology
Artigo discute o porquê das aprovações de uso emergencial de vacinas contra COVID-19 representam um dilema para os cientistas. As imunizações estão acelerando em direção à aprovação antes do fim dos testes clínicos, mas os cientistas dizem que isso pode complicar os esforços para estudar os efeitos de longo prazo. Por exemplo, uma vez que uma vacina recebe a aprovação de emergência, há pressão sobre os desenvolvedores para oferecer a imunização aos participantes do ensaio que receberam um placebo. Mas se muitas pessoas passarem para o grupo de vacinas, as empresas podem não ter dados suficientes para estabelecer resultados de longo prazo, como segurança, quanto tempo dura a proteção da vacina e se a vacina previne a infecção ou apenas a doença. O artigo propõe algumas formas de lidar com estes dilemas (23/11/2020). Fonte: Nature
A Rússia anunciou nesta segunda-feira que começou a vacinar a população com a vacina Sputnik V, que foi registrada no país em setembro a despeito dos ensaios clínicos ainda não terem sido concluídos. O site da instituição informa que residentes interessados em serem vacinados devem se registrar em uma plataforma do governo com antecedência. Outro pré-requisito é apresentar um teste de COVID-19 atestando que não houve contágio pelo novo coronavírus e documentos de identificação. No Brasil, os estados do Paraná e da Bahia formalizaram acordos com a Rússia visando a encomenda de doses e a produção da Sputnik V no país. No entanto, o laboratório Nikolai Gamaleya não formalizou pedido de testes ou de registro da vacina junto à Agência Nacional de Vigilância Sanitária (Anvisa) ate momento (30/11/2020). Fonte: O Globo
Métodos de imunoinformática foram explorados para projetar uma nova vacina de subunidade baseada em epítopo contra o SARS-CoV-2, tendo como alvo quatro proteínas essenciais do vírus, ou seja, glicoproteína da proteína S, fosfoproteína de nucleocapsídeo, glicoproteína de membrana e proteína de envelope. Os epítopos altamente antigênicos, não alergênicos, não tóxicos, homólogos não humanos e 100% conservados (em outros isolados de diferentes regiões do mundo) foram usados para construir a vacina. No total, catorze epítopos CTL e dezoito epítopos HTL foram usados para construir a vacina. Depois disso, várias validações in silico, ou seja, docking molecular, simulação de dinâmica molecular e estudos de simulação imunológica também foram realizados, prevendo que a vacina projetada deveria ser bastante segura, eficaz e estável dentro do ambiente biológico. Finalmente, a clonagem in silico e estudos de adaptação de códons também foram conduzidos para projetar uma estratégia eficaz de produção em massa da vacina. No entanto, mais estudos in vitro e in vivo são necessários na vacina prevista para finalmente validar sua segurança e eficácia (05/11/2020). Fonte: Informatics in Medicine Unlocked
Os fabricantes de vacinas têm muito em jogo caso algum dos imunizantes desenvolvidos para proteger contra a Covid-19 falhar, afirmou Emma Walmsley, CEO do laboratório britânico GlaxoSmithKline (GSK), que desenvolve, em parceria com a Sanofi, uma vacina cujos testes estão em fase 3 (30/11/2020). Fonte: O Globo
A aliança mundial para a vacinação, que coordena a iniciativa Covax em parceria com a Organização Mundial da Saúde para acelerar o desenvolvimento e a produção de um imunizante contra a COVID-19, anunciou nesta sexta-feira que ultrapassou a meta provisória de arrecadar mais de US$ 2 bilhões para comprar e distribuir vacinas para os países mais pobres, mas que ainda precisa de mais (30/11/2020). Fonte: O Globo
O Reino Unido está prestes a se tornar o primeiro país ocidental a aprovar uma vacina contra a covid-19 e dar início à imunização. De acordo com o jornal Financial Times, o imunizante desenvolvido pela empresa de biotecnologia alemã BioNTech em parceria com a farmacêutica Pfizer deve receber aprovação da agência regulatória do país nos próximos dias (30/11/2020). Fonte: Gaúcha Zero Hora
27/11/2020
Uma vacina baseada em RNA de autotranscrição e replicação (STARR ™) (LUNAR®-COV19) foi desenvolvida para prevenir a infecção por SARS-CoV-2. A vacina codifica um replicon baseado em alfavírus e a glicoproteína spike (S) de comprimento total do SARS-CoV-2. A tradução do replicon produz um complexo replicase que amplifica e prolonga a expressão da glicoproteína S de SARS-CoV-2. Uma única vacinação em camundongos levou a respostas robustas de anticorpos, com títulos de anticorpos neutralizantes aumentando até o dia 60. A ativação da imunidade mediada por células produziu uma forte resposta de linfócitos T CD8 + específica para o antígeno viral. O ensaio de coloração de citocina intracelular para linfócitos T auxiliares T CD4 + positivos para IFN-γ e IL-4, bem como razões de IgG2a / IgG1 anti-glicoproteína S suportaram uma forte resposta imune dominante Th1. Finalmente, a vacinação única de LUNAR-COV19 em doses de 2 μg e 10 μg protegeu completamente os camundongos transgênicos contendo ECA2 humanos tanto da mortalidade quanto da infecção mensurável após o desafio de SARS-CoV-2 de tipo selvagem. Os resultados sugerem o potencial do Lunar-COV19 como uma vacina de dose única (03/09/2020). Fonte: bioRxiv
Artigo demontra que se uma vacina contra a SARS-CoV-2 for licenciada dentro de 18 meses do início da pandemia, isso marcará uma conquista sem precedentes para o desenvolvimento de uma vacina viral não influenza. Os pesquisadores demonstram que a maioria das vacinas aprovados em tempos menores correspondem as vacinas contra influenza H1N1 e H5N1. No entanto, o rápido desenvolvimento das vacinas H1N1 e H5N1 é provavelmente atribuível à pesquisa e plataformas existentes da gripe sazonal (20). Os esforços de desenvolvimento de vacinas para SARS-CoV-2 estão construindo em uma base muito mais limitada de pesquisas e vacinas candidatas, incluindo aquelas desenvolvidas usando plataformas menos bem estabelecidas. Na amostra deste estudo o desenvolvimento de vacina não contra influenza mais rápido e bem-sucedido foi para a vacina de vetor recombinante Ebola, Ervebo (5,0 anos no total da fase 2 até a aprovação), que também é a única aprovação de uma vacina de ácido nucleico até o momento (24/11/2020). Fonte: Annaks of Internal Medicine
A vacina para a COVID-19 da empresa CureVac apresentou boa resposta imune no ensaio clinico de Fase 1. A empresa de biotecnologia está usando a chamada abordagem de RNA mensageiro (mRNA) para desenvolver uma vacina. Os dados do ensaio envolvendo cerca de 250 indivíduos, com idades entre 18-60 anos, demonstraram que a vacina foi geralmente bem tolerada em todas as cinco doses testadas - de 2 a 12 microgramas - e induziram aumentos nos anticorpos neutralizantes de vírus, bem como os primeiros sinais de ativação de células T. Os dados do estudo devem ser publicados em breve e o inicio da Fase 2b/3 devera ocorrer no final de 2020 (02/11/2020). Fonte: Curevac
O ensaio da vacina da Moderna é o terceiro em uma semana a liberar resultados positivos, aumentando as esperanças de uma escolha de vacinas (21/11/2020). Fonte:New Scientist
Para induzir uma resposta imune forte e reproduzível contra patógenos difíceis, tecnologias sofisticadas de nanovacinas estão sendo investigadas. Em contraste com as vacinas convencionais, as nanovacinas fornecem melhor acesso aos linfonodos, embalagem e apresentação ideais de antígenos e indução de uma resposta imune persistente. Esta revisão fornece uma perspectiva sobre as tendências globais em vacinas emergentes em nanoescala para doenças infecciosas e descreve os problemas biológicos, experimentais e logísticos associados ao seu desenvolvimento e como a imunoengenharia pode ser aproveitada para superar esses desafios (16/11/2020). Fonte: Nature Nanotechnology
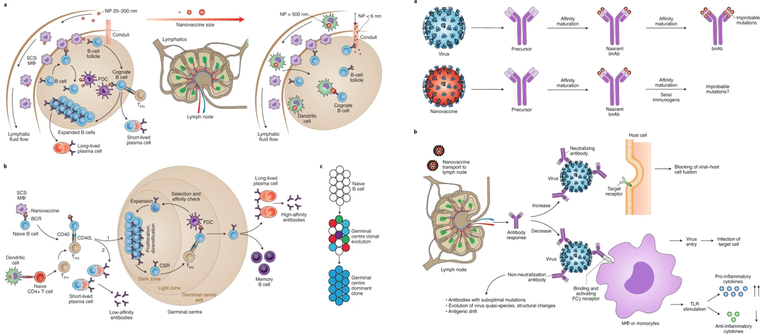
Dos 6.201 profissionais de saúde, 29,6% que relataram história de vacinação BCG, enquanto 68,9% não receberam a vacina BCG. A soroprevalência de IgG anti-SARS-CoV-2, bem como a incidência de sintomas clínicos auto-relatados associados a COVID-19, foram significativamente diminuídas entre os profissionais de saúde com histórico de vacinação com BCG em comparação com aqueles sem vacinação com BCG. Após o ajuste para idade e sexo, os pesquisadores verificaram que a vacinação BCG, mas não a vacinação meningocócica, pneumocócica ou contra influenza, foi associada à diminuição da soroconversão de IgG para SARS-CoV-2 (19/11/2020). Fonte: The Journal of Clinical Investigation
25/11/2020
O estudo da fase 3 da CoronaVac, vacina produzida por laboratório chinês Sinovac em parceria com o Instituto Butantan, atingiu o número mínimo de infectados pela Covid-19 necessário para o início da fase final de testes. A nova etapa permite a abertura do estudo e a análise interina dos resultados do imunizante. Para que a análise interina da CoronaVac fosse feita, era necessário que pelo menos 61 casos de Covid-19 ocorressem entre os 13 mil voluntários, sejam eles membros do grupo que tomou vacina ou do chamado grupo de controle. Ao todo, foram 74 infectados. O grupo de infectados permite realizar a chamada análise interina, a primeira análise da eficácia da vacina. Caso ainda persista alguma dúvida, o estudo deve ter ainda uma segunda análise, chamada de análise primária, que é feita quando o número de casos confirmados de Covid-19 entre os 13 mil voluntários chegar a 154 casos (23/11/2020). Fonte: G1
Uma vacina desenvolvida pela Janssen Pharmaceutical Companies se tornará a terceira vacina potencial contra a COVID-19 a ser testada em ensaios clínicos envolvendo pacientes no Reino Unido. O ensaio clínico randomizado de fase III controlado por placebo avaliará a eficácia e segurança de um regime de duas doses da vacina com 57 dias de intervalo, usando o mesmo adenovírus humano que forneceu o vetor para a vacina de Janssen contra o vírus Ebola. Trinta mil pacientes estarão envolvidos no estudo da Janssen e o recrutamento deverá ser concluído até março de 2021. O estudo durará 12 meses. Um teste de uma única dose da vacina Janssen já está em andamento nos Estados Unidos, porém, segundo cientistas, há algumas evidências de que duas doses de vacinas vetoriais virais irão devolver imunidade um pouco melhor e mais duradoura. O objetivo do estudo é determinar se o sistema imunológico pode ser preparado e reforçado pela mesma vacina. Se a vacina candidata da Janssen for considerada segura e eficaz, pode estar disponível em meados de 2021, e o Reino Unido receberá 30 milhões de doses. No total, o governo do Reino Unido garantiu 350 milhões de doses da vacina contra COVID-19, em seis candidatas diferentes (16/11/2020). Fonte: BMJ
Rússia diz que vacina contra Covid-19 teve eficácia acima de 95% após segunda dose. Segundo o anúncio, vacina Sputnik V, desenvolvida pelo instituto Gamaleya, alcançou o índice 21 dias após a aplicação da segunda dose e 42 dias após a aplicação da primeira. Resultados ainda não foram publicados em revista científica. A análise considera dados de 18.794 pessoas vacinadas. Dessas, 14.095 receberam a vacina, em ambas as doses. As outras 4.699 receberam uma substância inativa (placebo). (24/11/2020). Fonte: G1
A Fiocruz indicou que o protocolo de maior eficácia da vacina contra a COVID-19 (90%) representa a possibilidade de vacinar ainda mais pessoas com o mesmo número de doses a serem produzidas. Segundo os dados apresentados, a eficácia de 90% foi alcançada ao se utilizar uma primeira dose reduzida pela metade e uma segunda dose padrão, com um mês entre as duas dosagens, o que permite o aumento de 30% no número de pessoas a serem vacinadas, já que, inicialmente, pensava-se que seria necessário utilizar o esquema vacinal de duas doses para cada pessoa. Outro aspecto positivo desses resultados é que, dos 11.636 voluntários que tiveram seus dados analisados, apenas 30 testaram positivo para a Covid-19 mesmo após a vacina e nenhum deles precisou ser hospitalizado ou teve reações graves (23/11/2020). Fonte: Agencia Fiocruz
O laboratório AstraZeneca e a Universidade de Oxford, responsáveis pela produção da vacina contra a covid-19 que já tem acordo para distribuição no Brasil, informaram, que enviarão os dados referentes às últimas análises para a Agência Nacional de Vigilância Sanitária (Anvisa). A medida busca a autorização para utilizar o imunizante de forma emergencial no Brasil. Representantes das duas instituições participarão de reunião com o Ministério da Saúde, a Fundação Oswaldo Cruz (Fiocruz) e a Anvisa para tratar do assunto. Em comunicado, informaram que a vacina tem eficácia média de 70% (23/11/2020). Fonte: Jornal de Brasilia
Artigo revisa os dados publicados mais atualizados sobre as principais terapias farmacológicas em testes clínicos e vacinas candidatas em desenvolvimento para conter a ameaça de COVID-19 (17/11/2020) Pre-proof. Fonte: Clinical Immunology
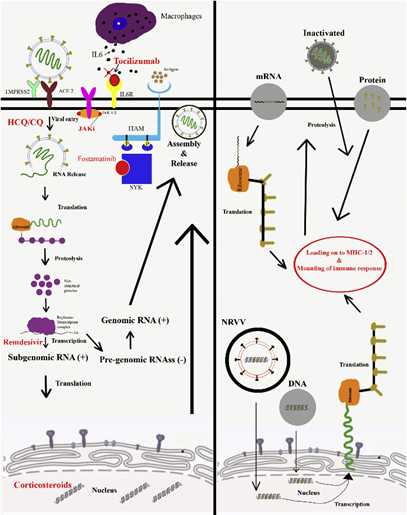
23/11/2020
Esta revisão discute as vantagens e desvantagens de diferentes vacinas de vetores virais e suas estratégias e aplicações gerais em medicamentos humanos e veterinários. Uma revisão cuidadosa dessas questões é necessária, pois eles podem fornecer insights importantes sobre como alguns dessas vacinas de vetores virais podem induzir respostas imunes robustas e duradouras, a fim de fornecer eficácia protetora contra uma variedade de ameaças de doenças infecciosas a humanos e animais, incluindo aqueles com potencial zoonótico para causar pandemias globais (13/11/2020). Fonte: Vaccines
A vacina ChAdOx1 é uma vacina de vetor de adenovírus de chimpanzé. Este é um adenovírus inofensivo e enfraquecido que geralmente causa o resfriado comum em chimpanzés. A ChAdOx1 foi escolhida como a tecnologia de vacina pela Universidade de Oxford e pela AstraZeneca como mais adequada para uma vacina contra SARS-CoV-2, pois demonstrou gerar uma forte resposta imunológica de uma dose em outras vacinas. Os vetores adenovirais para chimpanzés são um tipo de vacina muito bem estudada, tendo sido usada com segurança em milhares de indivíduos (19/11/2020). Fonte: University Oxford
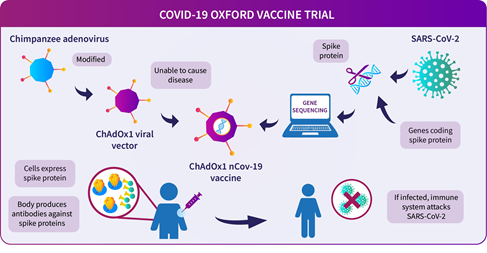
A Universidade de Oxford, em colaboração com a AstraZeneca, anuncia que os dados do ensaio provisório de seus ensaios de Fase III mostram que sua vacina candidata a coronavírus, ChAdOx1 nCoV-2019, é eficaz na prevenção de COVID-19 (SARS-CoV-2) e oferece um alto nível de proteção. A análise interina de fase 3 que inclui 131 casos de COVID-19, indica que a vacina apresenta 70,4% de eficácia ao combinar dados de dois regimes de dosagem. Nos dois regimes de dosagem diferentes, a eficácia da vacina foi de 90% em um e 62% no outro. O regime de maior eficácia usou uma primeira dose reduzida pela metade e uma segunda dose padrão. Não houve casos graves ou hospitalização no grupo que recebeu a vacina. Esta fase gerou um grande banco de dados de segurança de mais de 24.000 voluntários de ensaios clínicos no Reino Unido, Brasil e África do Sul. As vantagens desta vacina é que ela é armazenada em "temperatura de geladeira" (2-8°C) e distribuída e administrada empregando a logística existente no país (23/11/2020). Fonte: University Oxford
A empresa de biotecnologia Moderna em Cambridge, Massachusetts, relatou que sua vacina baseada em RNA é mais de 94% eficaz na prevenção de COVID-19, com base em uma análise de 95 casos em seu ensaio de eficácia de fase III em andamento (16/11/2020). Fonte: Nature
Artigo de revisão apresenta uma visão geral dos avanços recentes das vacinas SARS-CoV-2 e os desafios que podem ser encontrados no processo de desenvolvimento, destacando as vantagens e desvantagens dessas abordagens que podem ajudar no combate eficaz à COVID-19 (12/11/2020). Fonte: Journal of The Chinese Medical Association
A Croda International assinou um contrato de 5 anos para fornecer excipientes à base de lipídios para a Pfizer para a produção da vacina candidata COVID-19 baseada em RNA mensageiro da farmacêutica. Os ingredientes inativos serão produzidos pela Avanti Polar Lipids, uma empresa de lipídios de alta pureza que a Croda adquiriu no início deste ano. O contrato de até US$ 100 milhões especifica que a Croda fornecerá quatro excipientes durante os primeiros 3 anos do acordo. As firmas de serviços farmacêuticos Lonza e CordenPharma anteriormente contrataram o fornecimento de lipídios com a Moderna, outra pioneira em vacinas COVID-19 (16/11/2020). Fonte: Global & Enterprise
A natureza altamente contagiosa do vírus respiratório SARS-CoV-2 estimulou enormes esforços globais para desenvolver vacinas em velocidades recordes. Além de aumentar a liberação de imunogênio, os adjuvantes podem ter um grande impacto na eficácia protetora de uma vacina contra SARS-CoV-2. Para investigar a adequação do adjuvante, neste estudo, os pesquisadores formularam vacinas de subunidade de proteína consistindo no domínio S1 recombinante da proteína S de SARS-CoV-2 sozinha ou em combinação com CoVaccine HT ™ ou Alhydrogel. CoVaccine HT ™ induziu altos títulos de IgG de ligação ao antígeno após uma única dose, facilitou a maturação de afinidade e a mudança de classe em maior extensão do que o Alhydrogel e induziu potente imunidade mediada por células, bem como títulos de anticorpos neutralizantes de vírus. Os dados apresentados aqui sugerem que utilizar o adjuvante CoVaccine HT ™ pode induzir uma resposta imune mais abrangente e protetora ao SARS-CoV-2 (30/10/2020). Fonte: Frontiers in Immunology
19/11/2020
Afiliações do Médicos Sem Fronteiras (MSF) pediu aos governos que exijam transparência das empresas farmacêuticas nos acordos de licenciamento da vacina COVID-19, custos, testes e dados, como condição para o financiamento. De acordo com MSF, o governo do Reino Unido contribuiu com £ 84 milhões para apoiar o desenvolvimento da vacina COVID-19 da AstraZeneca, cujos resultados iniciais são esperados em breve. Mas os termos do acordo firmado entre a AstraZeneca e o governo do Reino Unido, ou os dos outros não foram divulgados. A AstraZeneca declarou que não lucrará com a vacina durante a pandemia. Mas, em acordo com o órgão de pesquisa público brasileiro Fiocruz, visto pelo Financial Times, a AstraZeneca define o período pandêmico como terminando em 1º de julho de 2021. MSF disse que isso significa que a AstraZeneca “poderia cobrar dos governos e de outros compradores, incluindo o NHS, preços altos por uma vacina predominantemente financiada pelo público”(12/11/2020). Fonte: The BMJ
Estudo com 560 adultos saudáveis - incluindo 240 com mais de 70 anos - apresenta descobertas preliminares sobre a segurança e as respostas imunológicas da vacina ChAdOx1 nCoV-19. Os resultados do ensaio de fase 2 mostram que a vacina causa poucos efeitos colaterais e é melhor tolerada em pessoas mais velhas do que em adultos mais jovens, e produz uma resposta imunológica semelhante em adultos idosos e jovens. Os pesquisadores ainda citam que suas novas descobertas podem ser encorajadoras se as respostas imunes encontradas em seu estudo estiverem associadas à proteção contra a infecção com SARS-CoV-2, mas este estudo não avaliou a eficácia e os ensaios de fase 3 ainda estão em andamento (18/11/2020). Fonte: The Lancet

Artigo discute as preocupações com a temperatura necessária para o armazenamento e distribuição de algumas vacinas, que podem retardar o lançamento de novas vacinas contra o coronavírus. No caso das vacinas na Pfizer e da Moderna, ambas usam uma nova tecnologia - filamentos de RNA mensageiro (mRNA), mantidos dentro de partículas lipídicas - que é vulnerável à degradação em temperatura ambiente e requer que as doses sejam congeladas para transporte e descongeladas para uso (16/11/2020). Fonte: Science
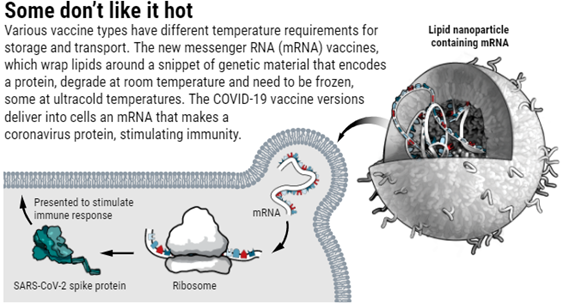
18/11/2020
A farmacêutica alemã Curevac diz que seu candidato à vacina da COVID-19, CVnCoV, pode permanecer estável por pelo menos três meses a 5oC, tornando-a mais fácil de distribuir do que as vacinas de alguns concorrentes. O composto é um mRNA otimizado, não quimicamente modificado, codificando a proteína S de pré-fusão estabilizada do vírus SARS-CoV-2. Esta temperatura de armazenamento apresentaria menos desafios de distribuição do que a vacina Pfizer/BioNTech que deve ser mantida em um ultra-freezer a -70o C. A empresa espera lançar um teste de fase 3 até o final do ano (13/11/2020). Fonte: FDA News
Autores analisaram se a vacinação contra a gripe afeta a suscetibilidade à infecção pelo SARS-CoV-2 e os desfechos clínicos em pacientes COVID-19 em 17.608 residentes da província italiana de Reggio Emilia submetidos a testes de SARS-CoV-2. Em pacientes COVID-19, no geral, a vacina contra gripe não afetou os desfechos, embora tenha sido observado efeito protetor para os idosos que receberam vacina para gripe quase em paralelo com o surto de SARS-CoV-2. Esses achados proporcionam tranquilidade no planejamento de campanhas de vacina para gripe e ressaltam a necessidade de explorar ainda mais seu impacto no COVID-19 (12/11/2020). Fonte: Vaccines
A Pfizer e a BioNTech anunciaram que o estudo de Fase 3 em andamento para a vacina candidata contra COVID-19 atingiu todos os objetivos primários de eficácia. A análise dos dados mostra que a vacina candidata foi eficaz em ajudar a prevenir a COVID-19 com um perfil de segurança geral favorável. A Pfizer e a BioNTech estão planejando enviar dentro de alguns dias um pedido de Autorização de Uso de Emergência ao FDA dos EUA; o que incluirá todos os dados sobre a vacina candidata contra COVID-19 coletados até o momento. Essa evidência será então revisada pelos próprios cientistas do FDA, bem como por um painel externo de especialistas independentes, conhecido como Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados, que ocorrerá provavelmente em dezembro. As empresas informam ainda que aumentaram as capacidades de fabricação em todo o mundo e esperam produzir globalmente até 50 milhões de doses de vacinas em 2020 e até 1,3 bilhão de doses até o final de 2021. (18/11/2020). Fonte: PFIZER
Pesquisadores comprovam a segurança, tolerabilidade e imunogenicidade da vacina SARS-CoV-2 inativada (CoronaVac) em adultos saudáveis com idade entre 18-59 anos em um ensaio clínico de fase 1/2 randomizado, duplo-cego, controlado por placebo. No ensaio de fase 1 (114 participantes), a soroconversão de anticorpos neutralizantes no dia 14 após o esquema de vacinação dos dias 0 e 14 foi observada em 46% dos participantes no grupo de 3 μg, 50% no grupo de 6 μg e nenhum no grupo placebo; ao passo que no dia 28 após o esquema de vacinação dos dias 0 e 28, a soroconversão foi observada em 83% no grupo de 3 μg, 79% no grupo de 6 μg e 4% no grupo placebo. No ensaio de fase 2 (600 participantes), a soroconversão de anticorpos neutralizantes foi observada em 92% no grupo de 3 μg, 98% no grupo de 6 μg e 3% no grupo de placebo no dia 14 após a programação dos dias 0 e 14; enquanto no dia 28 após o cronograma dos dias 0 e 28, a soroconversão foi observada em 97% no grupo de 3 μg, 100% no grupo de 6 μg e nenhuma no grupo placebo. O estudo conclui que a vacina CoronaVac foi bem tolerada e induziu respostas humorais contra SARS-CoV-2, o que apoiou a aprovação do uso de emergência de CoronaVac na China e em três estudos de fase 3. A eficácia protetora de CoronaVac ainda precisa ser determinada (17/11/2020). Fonte: The Lancet
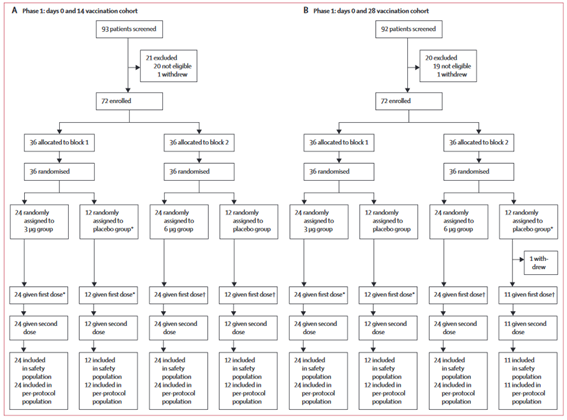
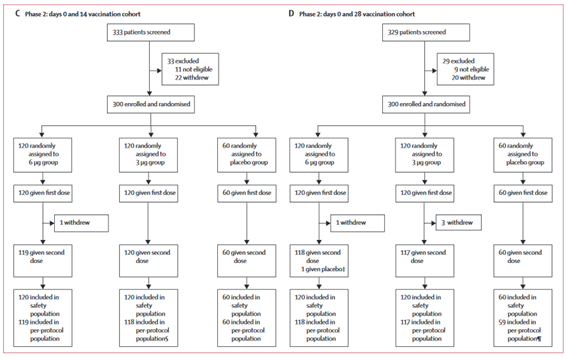
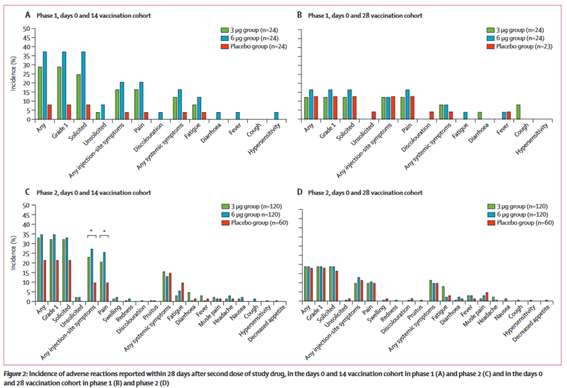
A Diretoria Colegiada da Anvisa (Dicol) aprovou, por unanimidade, proposta de instrução normativa (IN) para dispor sobre o procedimento de submissão contínua de dados técnicos para o registro de vacinas contra COVID-19. Os diretores também validaram a dispensa de análise de impacto regulatório e consulta pública devido ao grau de urgência e gravidade, caracterizadas por situação de iminente risco à saúde e necessidade de atuação imediata. As vacinas que tiverem a análise iniciada pelo procedimento de submissão contínua poderão submeter pedido de registro formal após a conclusão da análise. Além disso, a empresa deve ter avaliado a suficiência de dados de qualidade, eficácia e segurança para o estabelecimento de uma relação positiva de benefício e risco, considerando a indicação terapêutica pleiteada na Anvisa (17/11/2020). Fonte: ANVISA
17/11/2020
A Pfizer anunciou que vai realizar um programa piloto para testar e melhorar a logística de distribuição da vacina contra a COVID-19. A infraestrutura é um dos obstáculos do imunizante da Pfizer, desenvolvido em parceria com o laboratório BioNTech. Para se manter viável, a vacina precisa ser mantida a uma temperatura de -70ºC, o que dificulta o transporte e armazenamento. O teste será realizado em 4 Estados norte-americanos: Rhode Island, Texas, Novo México e Tennessee, que foram escolhidos em função de suas diferenças de extensão, diversidade de populações, infraestrutura de imunização e necessidade de alcançar indivíduos em ambientes urbanos e rurais (12/11/2020). Fonte: New York Times
16/11/2020
Estudo feito na Holanda, sugere que a vacina da gripe protege em até 39% contra o contágio pelo coronavírus. O novo estudo conclui que a vacina da gripe reforça a primeira linha de defesa do sistema imunológico ― conhecida como imunidade inata ― e aponta o porquê. O trabalho se baseia em amostras de sangue de pessoas sãs, às quais se acrescentou primeiro uma vacina da gripe tetravalente ― ou seja, que combate quatro variantes do vírus ― e depois o coronavírus SARS-CoV-2. O trabalho mostra um reforço da resposta imunológica inata e a secreção de certos tipos de citocinas. Além disso o estudo avaliou também a incidência de COVID-19 entre mais de 10.000 profissionais de saúde, dos quais 184 se contaminaram, e a compara com outros hospitais do país. O estudo mostra que o risco de contrair COVID-19 é aproximadamente 39% menor entre os que se vacinaram previamente contra a gripe (16/10/2020). Fonte: medRxiv

De acordo com os primeiros dados divulgados segunda-feira pela empresa, a vacina contra a COVID-19 da Moderna é 94,5% eficaz, tornando-se a segunda vacina nos Estados Unidos a ter uma taxa de sucesso surpreendentemente alta. No ensaio da Moderna, 15.000 participantes do estudo receberam um placebo. Ao longo de vários meses, 90 deles desenvolveram COVID-19, com 11 desenvolvendo formas graves da doença. Outros 15.000 participantes receberam a vacina, e apenas cinco deles desenvolveram COVID-19. Nenhum dos cinco ficou gravemente doente. A vacina da Moderna tem uma vantagem prática significativa sobre a Pfizer. A vacina da Moderna deve ser armazenada e transportada a -20oC enquanto a da Pfizer precisa de -70oC. Outra vantagem da vacina da Moderna é que ela pode ser mantida por 30 dias na geladeira, enquanto a vacina da Pfizer pode durar apenas cinco dias na geladeira (16/11/2020). Fonte: CNN
Pesquisadores tem por objetivo prever uma potencial vacina de peptídeos múltiplos contra COVID-19 projetada a partir da fosfoproteína do nucleocapsídeo (N) e da glicoproteína spike (S) por meio da abordagem imunoinformática. De acordo com os resultados, prevê-se que um peptídeo S, SQCVNLTTRTQLPPAYTNSFTRGVY, tenha a afinidade de ligação mais elevada para as células B. E outro peptídeo S, FTISVTTEI, tem a maior afinidade de ligação para o alelo de leucócitos humanos MHC HLA-B. Os peptídeos de nucleocapsídeo KTFPPTEPK e RWYFYYLGTGPEAGL têm a maior afinidade de ligação para o alelo MHC I HLA-A0202 e MHC II HLA-DPA1, respectivamente. Além disso, esses peptídeos foram previstos como não tóxicos e não alergênicos. Portanto, prevê-se que a combinação desses peptídeos estimule melhores respostas imunológicas com segurança (10/11/2020). Fonte: Informatics in Medicine Unlocked
12/11/2020
A irradiação de vírus tem sido realizada há muitas décadas para estudos de pesquisa básica, esterilização e desenvolvimento de vacinas. Altas doses de raios γ podem ser utilizadas para o desenvolvimento de vacinas que exploram vírus inativados. Esta técnica foi gradualmente substituída por métodos mais práticos, em particular o uso de produtos químicos, mas a irradiação continua sendo um método simples e eficaz usado em alguns casos. A técnica empregada para inativar o vírus tem impacto sobre sua capacidade de induzir uma resposta imune adaptativa capaz de conferir uma proteção efetiva. Autores propõe aqui que os íons pesados acelerados podem ser usados para inativar os vírus SARS-CoV-2 com pequenos danos às proteínas de pico do envelope e podem, então, fornece um vírion intacto para o desenvolvimento da vacina (20/10/2020). Frontiers in Physics
11/11/2020
Artigo discute importantes aspectos do processo de vacinação de uma população para obtenção da imunidade rebanho, tais como a avaliação da quantidade de doses necessárias, a distribuição da vacina, seleção dos grupos prioritários e comunicação com a população para conscientização da importância da vacinação (04/11/2020). Fonte: The Lancet.
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou que os testes da CoronaVac, a vacina desenvolvida pelo laboratório chinês Sinovac para a Covid-19, serão retomados. O Instituto Butantan, responsável pela aplicação das doses no Brasil, disse que os estudos reiniciarão imediatamente, ainda nesta quarta-feira (11/11/2020). G1
10/11/2020
Nesta revisão, pesquisadores exploram os desafios na avaliação da eficácia das vacinas candidatas à SARS-CoV-2, discutem as advertências necessárias para interpretar os desfechos de eficácia relatados e fornecem uma visão para responder à pergunta aparentemente simples: “Esta vacina contra COVID-19 funciona?” (27/10/2020). Fonte: The Lancet
Nesta revisão, pesquisadores descrevem estudos relacionados a conhecimentos básicos sobre o SARS-CoV-2, atualizações em modelos animais, panorama atual de vacinas em avaliação clínica e resultados de pesquisas atualizados sobre desenvolvimento de vacinas. Segundo os autores, as vacinas contra COVID-19 seguras e eficazes requerem investigação adicional (29/10/2020). Fonte: Human Vaccines & Immunotherapeutics
Artigo propõe métodos de produção rápida de um segmento estendido do Domínio de Ligação ao Receptor da proteína S (RBD) em células HEK293SF cultivadas em suspensão, como um componente principal de uma vacina de subunidade para COVID-19 em desenvolvimento. A expressão de RBD foi alcançada com alto rendimento por transfecção transiente de plasmídeo ou infecção adenoviral das células, em um período de apenas duas e três semanas, respectivamente. Ambos os métodos de produção foram avaliados em biorreatores controlados resultando em uma recuperação de produto com pureza superior a 95%. A infecção adenoviral levou a mais de 100 µg / mL de RBD em sobrenadantes de cultura, o que foi cerca de 7 vezes maior do que os níveis obtidos em culturas transfectadas. O RDB também exibiu uma estrutura conformacional adequada, sendo reconhecido por anticorpos monoclonais dirigidos contra epítopos da proteína S nativos. A ligação direta e eficiente a ECA2 também foi demonstrada em níveis semelhantes em RBD obtido de ambos os métodos e de diferentes lotes de produção. No geral, foram fornecidos dados relacionados ao bioprocesso para a fabricação rápida e escalonável de vacinas baseadas em RBD de baixo custo contra SARS-CoV-2, com o valor agregado de disponibilizar um antígeno funcional para apoiar pesquisas futuras sobre a descoberta de mecanismos de ligação e entrada de vírus como bem como rastreio de potenciais terapias para a COVID-19 (04/11/2020). Fonte: Vaccines
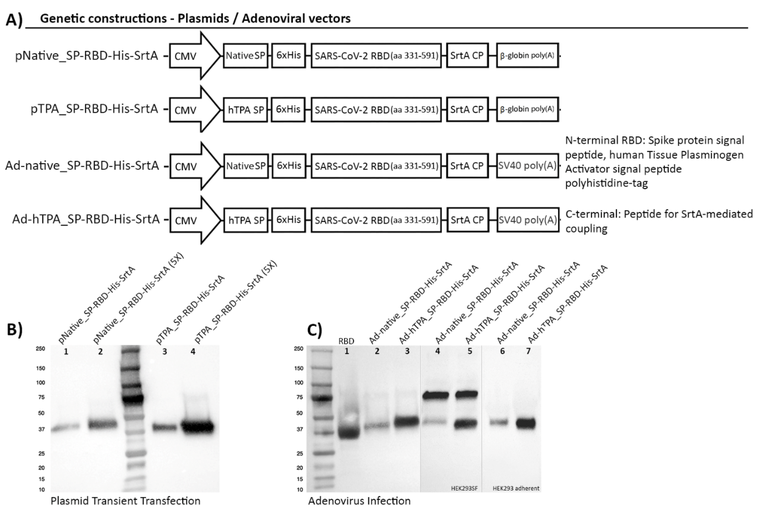
09/11/2020
A Pfizer e BioNTech anunciam que a sua vacina candidata baseada em mRNA, BNT162b2, contra SARS-CoV-2 demonstrou evidência de eficácia contra COVID-19 em participantes sem evidência prévia de infecção por SARS-CoV-2 segundo a análise provisória do estudo de Fase 3. O ensaio clínico de Fase 3 começou em 27 de julho e inscreveu 43.538 participantes até o momento, 38.955 dos quais receberam uma segunda dose da vacina candidata em 8 de novembro de 2020. Aproximadamente 42% dos participantes globais e 30% dos participantes dos EUA têm origens racial e etnica diversas. A divisão do estudo entre indivíduos vacinados e aqueles que receberam o placebo indica uma taxa de eficácia da vacina acima de 90%, 7 dias após a segunda dose (09/11/2020). Fonte: Pfizer
A vacina da Novavax recebeu status de aprovação rápida da FDA. A decisão deve ajudar a acelerar o desenvolvimento do imunizante, que está em fase 3 de estudos clínicos no Reino Unido. Até o final de novembro, a pesquisa deve ser iniciada em mais dois países: México e Estados Unidos. Resultados preliminares do estudo no Reino Unido, que conta com a participação de 10.000 voluntários, são esperados para o primeiro trimestre de 2021. Em agosto, a vacina da Novavax mostrou resultados preliminares encorajadores em dois estudos: a) fase 1 em humanos, mostrou que 56 voluntários que receberam duas doses da vacina produziram um alto nível de anticorpos contra o vírus (sem efeitos colaterais graves) e b) em animais, mostrou que o imunizante foi capaz de prevenir a infecção em macacos (09/11/2020). Fonte: Veja
Após anúncio da Pfizer, Rússia diz que vacina Sputnik V tem 90% de eficácia. O resultado do imunizante russo tem como base dados de vacinações no público, não de um teste em andamento; produto gera preocupação e desconfiança na comunidade científica devido à rapidez e falta de transparência. A Rússia está disponibilizando a vacina para o público geral embora ainda não tenha finalizado os testes clínicos de estágio avançado. Representantes do governo russo dizem que esperam publicar os resultados provisórios dos testes em breve (09/11/2020). Fonte: Terra
Autora explica o papel do Grupo de Trabalho de Vacinas do Governo do Reino Unido (The UK Government's Vaccine Taskforce), assim como a estratégia para proteger o Reino Unido e o mundo. A estratégia tem sido construir um portfólio diversificado para dar ao Reino Unido a maior chance de fornecer uma vacina segura e eficaz, reconhecendo que muitas, e possivelmente todas, essas vacinas podem falhar. O grupo concentrou-se em vacinas que devem eliciar respostas imunes na população com mais de 65 anos e que possuam escalabilidade da fabricação de vacinas, com o objetivo de serem fabricadas no Reino Unido. A Vaccine Taskforce garantiu o acesso a seis vacinas (de mais de 240 vacinas em desenvolvimento) em quatro formatos diferentes: vetores adenovirais, mRNA, proteínas com adjuvante e vacinas virais inativadas inteiras, que são promissoras de maneiras diferentes. As vacinas mais avançadas, como as desenvolvidas pela AstraZeneca e pela Universidade de Oxford, BioNTech e Pfizer, e Janssen, são baseadas em novos formatos para os quais tem-se pouca experiência de seu uso como vacinas, embora os dados iniciais de imunogenicidade e segurança sejam encorajadores. Vacinas baseadas em formatos de vacina usados com frequência, como vacinas de proteína com adjuvante desenvolvidas por Novavax e por GSK e Sanofi, e vírus inteiros inativados desenvolvidos por Valneva, não estarão disponíveis até o final de 2021. Ainda segundo a autora, também há um acordo com a AstraZeneca para fornecer um coquetel de anticorpos neutralizantes como tratamento profilático para pessoas que não podem receber a vacina, como pessoas fortemente imunossuprimidas e não podem montar uma resposta imunológica, ou pessoas que precisam de proteção imediata, como profissionais de saúde (27/10/2020). Fonte: The Lancet
06/11/2020
Os autores fazem uma avaliação da atual corrida para o desenvolvimento de uma vacina para o SARS-CoV-2. Apontam as dificuldades e as estratégias de estudo acelerado. E fazem uma discussão sobreas plataformas tecnológicas utilizadas e apresentam uma atualização do status atual das principais vacinas em desenvolvimento (14/10/2020). Fonte: Frontiers in Immunology

Artigo apresenta o desenvolvimento de uma candidato a vacina produzido através de levedura engenheirada de alto rendimento produzindo subunidade de proteína recombinante para SARS com base em um domínio de ligação ao receptor (RBD219-N1) da proteína S de beta-coronavírus (SARS-CoV). Quando formulado com Alhydrogel®, o RBD219-N1 induziu a produção de anticorpos neutralizantes de alto nível contra um pseudovírus e um isolado clínico (adaptado para camundongo) de SARS-CoV. No estudo foi relatado que camundongos imunizados com RBD219-N1 / Alhydrogel® foram totalmente protegidos do desafio letal com SARS-CoV (0% de mortalidade), em comparação com ∼ 30% de mortalidade em camundongos quando imunizados com a proteína S do SARS formulada com Alhydrogel®, e 100% de mortalidade em controles negativos. Uma formulação de RBD219-N1 Alhydrogel® também foi superior à proteína S, RBD sem adjuvante e RBD formulado com AddaVax (adjuvante semelhante a MF59) na indução de anticorpos específicos e na prevenção de infiltrados celulares nos pulmões após desafio com SARS-CoV. Especificamente, a formulação de RBD219-N1 com Alhydrogel® forneceu altos títulos de anticorpos neutralizantes, 100% de proteção com cargas virais não detectáveis com mínimo ou nenhum infiltrado pulmonar eosinofílico, de forma que esta formulação de vacina está sendo considerada para desenvolvimento adicional contra SARS-CoV e potencialmente outros beta-CoVs emergentes e reemergentes, como SARS-CoV-2 (05/07/2020). Fonte: bioRXiv, Vaccine
Artigo descreve um projeto baseado na estrutura de imunógenos de nanopartículas de proteína S automontáveis que eliciam respostas de anticorpos potentes e protetores contra SARS-CoV-2 em camundongos. As vacinas de nanopartículas exibem 60 domínios de ligação ao receptor da proteína S de SARS-CoV-2 (RBDs) em uma matriz altamente imunogênica e induzem títulos de anticorpos neutralizantes dez vezes maiores do que a proteína S estabilizada por pré-fusão, apesar de uma dose cinco vezes menor. Os anticorpos produzidos pelas nanopartículas de RBD têm como alvo múltiplos epítopos distintos, sugerindo que eles podem não ser facilmente suscetíveis a mutações do vírus e exibem uma relação de ligação: neutralização mais baixa do que o soro humano convalescente, o que pode minimizar o risco de doença respiratória aumentada associada à vacina. O alto rendimento e estabilidade das nanopartículas montadas sugerem que a fabricação das vacinas de nanopartículas será altamente escalonável (31/10/2020). Fonte: Cell
04/11/2020
Estudo apresenta análise que demonstra que há uma grande diferença na resposta imune contra a SARS em crianças, adultos jovens e idosos, tanto em nível inato quanto adaptativo. Levando em consideração essas informações, foram estudadas as estratégias que estão sendo utilizadas para o desenvolvimento de vacinas para a COVID-19. São discutidas as perspectivas de obtenção e distribuição mundial de vacinas confiáveis. A conclusão é que diferentes vacinas podem ser protetoras para diferentes segmentos de idade dentro da população, dependendo da estratégia utilizada para seu desenho. Portanto, será necessário que várias vacinas cheguem à linha de chegada, não só para garantir a disponibilidade, mas também para garantir uma resposta imunológica adequada a nível individual (pre-print). Fonte: Current Medicinal Chemistry
Reino Unido inicia revisão acelerada da vacina de Oxford. A farmacêutica AstraZeneca informou que a Agência Regulatória de Produtos de Saúde e Medicamentos (MHRA, sigla original) do Reino Unido iniciou uma revisão acelerada da vacina contra a COVID-19 desenvolvida pela empresa em parceria com a Universidade de Oxford, onde, nessa revisão, os reguladores são capazes de ver os dados clínicos em tempo real e dialogar com os fabricantes de medicamentos sobre os processos de fabricação e testes para acelerar o processo de aprovação. O objetivo é acelerar as avaliações de remédios ou vacinas promissores durante uma emergência de saúde pública (01/11/2020). Fonte: Terra
29/10/2020
O presidente-executivo da Pfizer declara que a vacina COVID-19 estava na “última milha” e que a empresa farmacêutica esperava resultados em questão de semanas. Ele disse que a empresa espera solicitar autorização de uso de emergência para sua vacina contra o coronavírus na terceira semana de novembro, aproximadamente em linha com os cronogramas anteriores (29/10/2020). Fonte: TheTimes
A biofarmacêutica americana Moderna anunciou nesta quinta-feira, 29, que está preparando o lançamento global de sua vacina contra o novo coronavírus depois de receber um investimento de 1,1 bilhão de dólares de vários governos no mundo todo. Na semana passada, a empresa atingiu a marca de 30 mil voluntários para a fase três de testes da imunização. De acordo com a companhia, 25.650 indivíduos já receberam as duas doses da proteção e resultados sobre ela devem ser divulgados no final de novembro e uma aprovação para uso emergencial deve ser protocolada no FDA (29/10/2020). Fonte: EXAME
27/10/2020
Os autores discutem que a autorização de uso emergencial de vacinas para COVID-19 nos EUA dependerá do rigor dos critérios clínicos, incluindo a duração do seguimento, usados para avaliá-la. Autores comentam a orientação publicada recentemente da Food and Drug Administration (FDA), que recomenda que os dados dos estudos de fase 3 que pode resultar de uma análise provisória especificada por protocolo, incluam uma duração média de acompanhamento de pelo menos 2 meses após a conclusão o regime de vacinação completo. Essa recomendação leva em consideração a provável administração rápida de uma vacina a milhões de americanos saudáveis e potencialmente a mais bilhões de pessoas em todo o mundo (16/10/2020). Fonte: NEJM
A autora traça um paralelo entre o desenvolvimento da vacina da COVID-19 e de outras vacinas. Adverte que várias vacinas candidatas foram submetidas a testes em tempo recorde e os dados são promissores. Autora afirma que o aprendizado sobre como as vacinas funcionam e como melhor usá-las será continuo e que, à medida que novas informações forem incorporadas, a tomada de decisão deve priorizar de forma clara e transparente o que se sabe e o que não se sabe (20/10/2020). Fonte: Nature
A COVAXX, sediada em Nova York, uma subsidiária da United Biomedical, criou uma vacina contendo partes de várias proteínas virais (UB-612). Em 11 de setembro, eles registraram um teste de Fase 1 em Taiwan. Eles chegaram a um acordo com as autoridades brasileiras para realizar seu teste de Fase 2/3 no Brasil (09/09/2020). Fonte: PR newswire
26/10/2020
A Universidade de Oxford e o laboratório AstraZeneca anunciaram nesta segunda-feira (26) que a vacina contra a COVID-19 que estão desenvolvendo, e está na última fase de testes no Brasil, induziu 'fortes respostas imunes' em voluntários idosos em testes de fase 2. Etapa verifica a segurança e a capacidade da vacina de gerar uma resposta do sistema de defesa. A vacina foi testada em idosos com idades de 56 a 69 anos e em um segundo grupo, acima dos 70 anos. As respostas de imunogenicidade foram semelhantes entre adultos mais velhos e mais jovens e a reatogenicidade [geração de efeitos adversos] foi menor em adultos mais velhos, nos quais a gravidade da COVID-19 é maior (26/10/2020). Fonte: G1
O investigador-chefe do Oxford Vaccine Trial na Oxford University disse: “Estamos muito satisfeitos que a FDA tenha chegado à mesma conclusão que os outros reguladores dos locais de testes clínicos em todo o mundo, declarando que o teste é seguro para prosseguir nos EUA. Isso permitirá que nossos parceiros AstraZeneca comecem a testar a vacina em outros 30.000 voluntários, levando nossos testes clínicos combinados de fase 3 em grande escala para 50.000 em todo o mundo” (23/10/2020). Fonte:University of Oxford
Artigo discute o potencial da administração intranasal das vacinas. Muitos estudos demonstram que a proteção dos pulmões é proporcionada pela administração nasal de uma variedade de vacinas virais e bacterianas. Embora existam preocupações sobre a durabilidade dos anticorpos IgG para COVID-19, os anticorpos IgA para influenza gerados pelo NALT difuso que reveste as passagens nasais duraram por toda a vida em modelo animal. Um benefício adicional da IgA é baseado em seus efeitos não inflamatórios, uma vez que nem a forma monomérica secretada (sIgA) encontrada no soro nem a forma polimérica secretora (S-IgA) encontrada nas secreções mucosas ativam qualquer uma das três vias do complemento. Se for bem-sucedido, a administração da vacina pela mucosa terá um papel protetor na prevenção da invasão do vírus no início do processo infeccioso e na prevenção da viremia. A administração pela mucosa também representa um meio mais econômico e eficiente de administrar uma vacina em tempos de pandemia. E, em última análise, há menos probabilidade de uma resposta imune imunopatológica conhecida como ADE, que está invariavelmente associada a IgG (30/09/2020). Fonte: Frontiers in Immunology
O Brasil tem, ao menos, 11 projetos de candidatas a vacina contra a COVID-19, de acordo com levantamento do G1. Todos estão sendo desenvolvidos em universidades e instituições de pesquisa públicas do país. Os projetos para criar um imunizante nacional contra a doença causada pelo novo coronavírus (SARS-CoV-2) ainda estão em fases iniciais de pesquisa. Não há previsão de que entrem em testes com humanos ou de que tenham seus estudos concluídos antes das candidatas estrangeiras que já passam por ensaios clínicos no país. Os 11 projetos têm participação de ao menos 9 instituições de pesquisa – em São Paulo, Rio de Janeiro, Minas Gerais e Paraná (25/10/2020). Fonte: G1
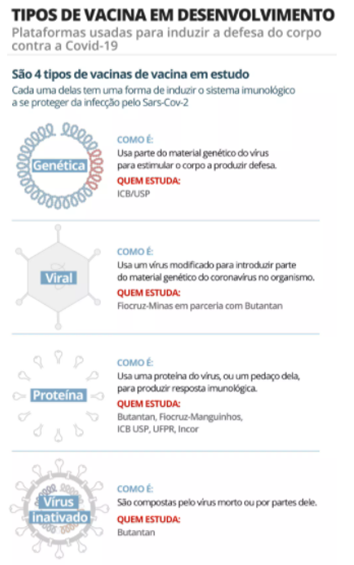
23/10/2020
Artigo apresenta o rápido desenvolvimento de uma vacina contra COVID-19 nova (CORAVAXTM), altamente eficiente e segura usando um vetor baseado no vírus da raiva que provou ser uma vacina eficiente contra várias doenças infecciosas emergentes. Este estudo relata que um vírus da raiva vivo e um inativado contendo a proteína S do SARS-CoV-2 induz anticorpos neutralizantes potentes em níveis muito mais elevados do que os observados no soro de pacientes convalescentes. Em resumo, os resultados fornecidos garantem um maior desenvolvimento desta plataforma de vacina segura e estabelecida contra COVID-19 (16/10/2020). Fonte: NPJ Vaccines

Estudo utilizando uma das principais subunidades candidatas a vacinas da Novavax confirma a integridade estrutural do imunógeno da proteína spike e fornece uma base para a interpretação das respostas imunes a este imunógeno. Segundo os autores, o NVAX-CoV2372 é estável, homogêneo e bloqueado na conformação de pré-fusão antigenicamente preferida. Com a caracterização estrutural, biofísica e antigênica completa, a avaliação contínua em humanos fornecerá a verdadeira prova para o princípio deste conceito de vacina (20/10/2020). Fonte: Science.
21/10/2020
Reportagem resume os quatro tipos de vacina contra a COVID-19 e apresenta o que falta para elas ficarem prontas. Segundo o autor, a Organização Mundial da Saúde (OMS) calcula que 44 candidatas à vacina estão nas fases 1, 2 ou 3 de estudos clínicos e, de maneira geral, pode-se dividir os imunizantes contra a COVID-19 que estão mais adiantados (fase 3) em quatro grandes grupos: vacinas com vírus inativado, vacinas de subunidade proteica, vacinas baseadas em RNA e vacinas com vetor viral não replicante. Todas as candidatas à vacina que estão iniciando ou em meio à fase 3 dos testes clínicos tem como objetivo aplicar o imunizante em milhares de voluntários e acompanhá-los por determinado período de tempo (21/10/2020). Fonte: BBC News Brasil
Estudo demonstra as fases do desenvolvimento de uma vacina explicando que a Fase I examina principalmente a segurança e a imunogenicidade preliminar em aproximadamente 50 voluntários. Os ensaios de Fase II analisam a imunogenicidade e a segurança na população-alvo e normalmente envolvem centenas de voluntários. O sucesso na Fase II permite que uma vacina entre na Fase III, envolvendo milhares de voluntários. Se o estudo de Fase III demonstrar segurança e eficácia, um pedido é feito à autoridade reguladora nacional (por exemplo, a US FDA) para licenciamento e autorização de comercialização (16/10/2020). Fonte: Journal of Experimental Medicine
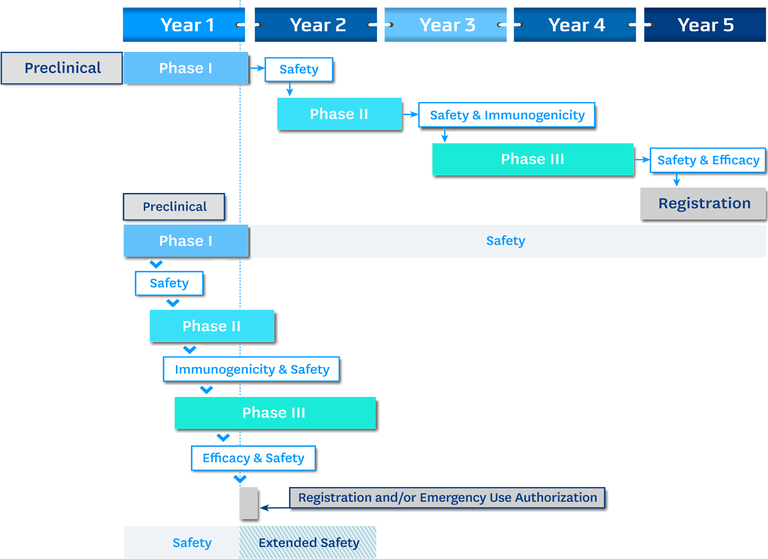
Artigo procura responder as principais questões relacionadas as vacinas que estão sendo desenvolvidas para prevenção da COVID-19, muitas delas envolvendo novas tecnologias. Fornecer informações baseadas em evidências será particularmente importante em um ambiente de polarização e desconfiança. Este artigo enfoca as perguntas comuns que os pacientes provavelmente farão sobre as vacinas COVID-19 (16/10/2020). Fonte: JAMA
20/10/2020
Estudo com vacinas candidatas a vacinas de RNA modificadas com nucleosídeos formuladas com nanopartículas lipídicas: BNT162b1, que codifica um domínio de ligação ao receptor SARS-CoV-2 trimerizado secretado; ou BNT162b2, que codifica a proteína S de comprimento total SARS-CoV-2 ancorado na membrana, estabilizado na conformação de pré-fusão. Um total de 195 participantes foram submetidos à randomização. Em cada um dos 13 grupos de 15 participantes, 12 participantes receberam vacina e 3 receberam placebo. O BNT162b2 foi associado a uma menor incidência e gravidade de reações sistêmicas do que o BNT162b1, particularmente em adultos mais velhos. Os dados de segurança e imunogenicidade deste estudo de fase 1 dos EUA das vacinas candidatas em adultos mais jovens e mais velhos, adicionados aos dados de segurança e imunogenicidade provisórios anteriores em relação ao BNT162b1 em adultos jovens de estudos na Alemanha e nos Estados Unidos, apóiam a seleção de BNT162b2 para avanço a uma avaliação essencial de segurança e eficácia de fase 2 e 3 (14/10/2020). Fonte: The New England Journal of Medicine
O governo do Reino Unido e uma empresa que administra tais estudos, anunciaram em 20 de outubro que pessoas jovens e saudáveis serão intencionalmente expostas ao vírus responsável pela COVID-19 em um "teste de desafio humano". O experimento, programado para começar em janeiro em um hospital de Londres, visa acelerar o desenvolvimento de vacinas que podem acabar com a pandemia. A COVID-19 Vaccine Taskforce do governo do Reino Unido concordou em pagar à empresa até £ 10 milhões (US $ 13 milhões) para realizar o teste, com a possibilidade de contratar a Open Orphan para executar vários outros para testar várias vacinas. A Agência Reguladora de Medicamentos e Cuidados de Saúde do Reino Unido (MHRA), que regula os ensaios clínicos no Reino Unido, e um comitê de revisão ética, ainda precisam aprovar o ensaio inicial e seu desenho, bem como de estudos futuros (20/10/2020). Fonte: Nature
19/10/2020
O estudo relata os resultados provisórios de segurança e imunogenicidade da vacina SARS-CoV-2 com virion inteiro inativado que assegura a presença de todos os epítopos imunogênicos. No entanto, processos de inativação inadequados podem alterar as propriedades antigênicas e resultados na indução de anticorpos não neutralizantes podem levar ao aumento da doença. Dos resultados mostraram níveis muito semelhantes de eventos adversos e títulos de anticorpos neutralizantes pós-vacinação de vacinas com partes de vírus inativados (15/10/2020). Fonte: The Lancet Infectios Diseases
Artigo apresenta uma revisão das vacinas candidatas para a COVID-19 baseadas na proteína S do SARS-CoV-2. A proteína spike (S) dos SARS-CoVs é o principal determinante da entrada e tropismo celular e é responsável por facilitar a zoonose em humanos e a transmissão sustentada de pessoa a pessoa. Além disso, a proteína 'S' contém múltiplos epítopos neutralizantes que desempenham um papel essencial na indução de anticorpos neutralizantes (nAbs) e imunidade protetora. Adicionalmente, as respostas das células T contra a proteína "S" do SARS-CoV-2 também foram caracterizadas como correlacionadas aos títulos de anticorpos IgG e IgA em pacientes com COVID-19. Assim, a proteína S é um antígeno candidato óbvio para inclusão em plataformas de vacina contra a infecção viral de SARS-CoV-2. O artigo revisa as diferentes características da proteína S, sua potencial e "estado da arte" das estratégias de desenvolvimento de vacinas e plataformas usando este antígeno, para a construção de uma vacina SARS‐CoV‐2 segura e eficaz (15/10/2020). Fonte: Reviews in Medical Virology

Estudo apresenta os resultados de segurança e imunogenicidade de uma vacina inativada para o SARS-CoV-2, BBIBP-CorV: um ensaio de fase 1/2 randomizado, duplo-cego, controlado por placebo. Participaram 192 voluntários na Fase I e 448 voluntários na fase II. A reação adversa mais comum foi febre e não foram relatadas reações graves. Este estudo está registrado com www.chictr.org.cn, ChiCTR2000032459. Os resultados mostraram que a vacina inativada BBIBP-CorV, é segura e bem tolerada em todas as doses testadas em dois grupos de idades diferentes. As respostas humorais contra SARS-CoV-2 foram induzidas em todos os voluntários que receberam a vacina no dia 42. A imunização de duas doses com 4 μg de vacina nos dias 0 e 21 ou nos dias 0 e 28 alcançou títulos de anticorpos neutralizantes mais altos do que a dose única de 8 μg ou 4 μg nos dias 0 e 14 (15/10/2020). Fonte: The Lancet Infectious Diseases
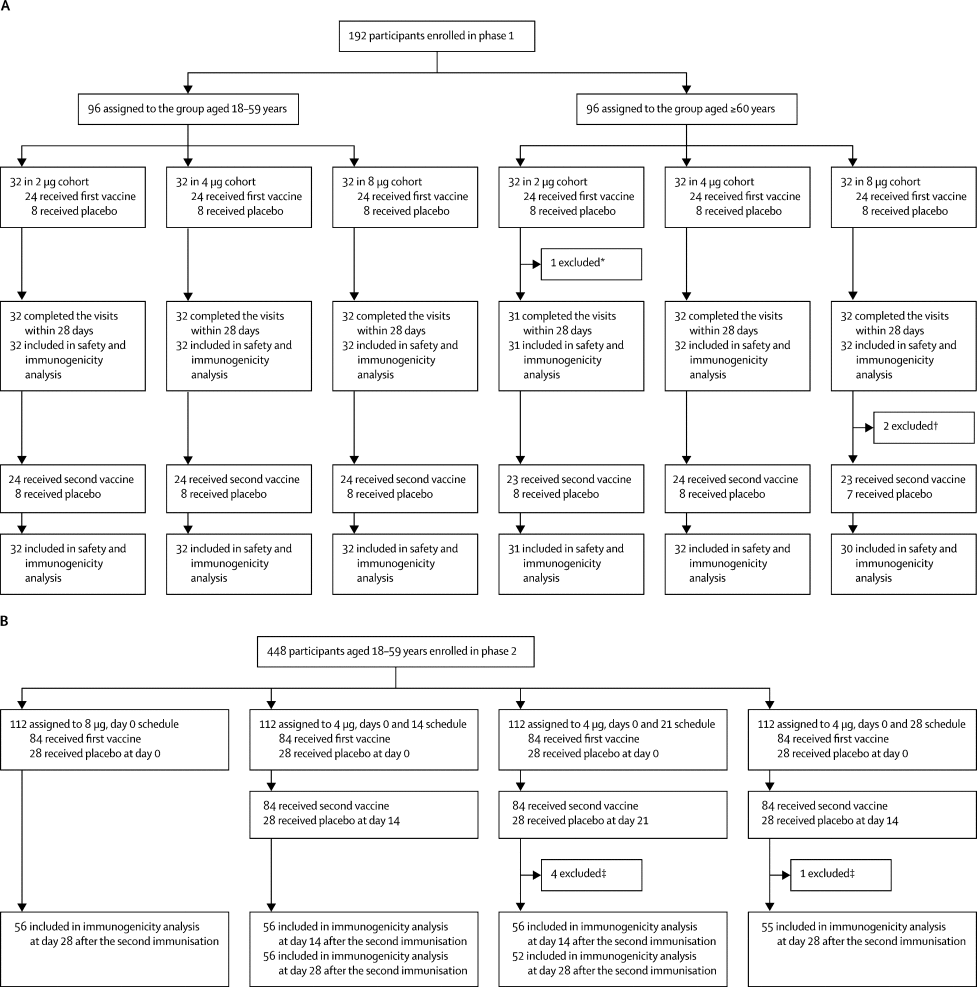
Artigo faz uma revisão da histórica do desenvolvimento de vacinas e adjuvantes, os principais tipos de vacinas, explicando como e quando cada uma delas funciona além de discutir os progressos e desafios na ciência de vacinas (15/10/2020). Fonte: Cell


O diretor do Instituto Butantan, Dimas Covas, disse nesta segunda-feira (19) que a Coronavac, vacina desenvolvida pela empresa chinesa Sinovac em parceria com o Butantan é a vacina contra o coronavírus mais segura das que estão em desenvolvimento. No Brasil, apenas 35% dos 9 mil voluntários tiveram reações adversas leves após a aplicação da vacina, tais como dor no local da aplicação ou dor de cabeça. Não houve qualquer registro de efeito colateral grave durante a testagem. Os resultados de eficácia ainda não foram finalizados porque eles dependem da ocorrência de um número mínimo de infecções por COVID-19 entre os voluntários. Para a CoronaVac, o número mínimo estipulado para uma primeira análise é de 61 infecções. Isso, segundo ele, só deverá ser atingido entre os meses de novembro ou dezembro (19/10/2020). Fonte: Agencia Brasil
Revisão aborda o conhecimento atual sobre as respostas imunes humorais e celulares humanas à COVID-19 e relaciona esse conhecimento às vacinas que se encontram em fase 3 de ensaios clínicos. Na conclusão, é exposto que muito ainda deve ser estudado sobre a imunidade ao SARS-CoV-2. Provavelmente, diferentes vacinas serão necessárias para diferentes populações (por exemplo, bebês imunodeprimidos, crianças, mulheres grávidas, indivíduos imunocomprometidos e imunossenescentes indivíduos com idade ≥65 anos). Além da resposta imunológica adaptativa, dados sugerem que a imunidade inata "treinada" também pode ter um papel na proteção contra o vírus. Vários ensaios clínicos (por exemplo, NCT04327206, NCT04328441, NCT04414267, e NCT04417335) estão examinando se outras vacinas não relacionadas ao SARS-COV-2, como a vacina contra sarampo, caxumba e rubéola e a vacina Bacillus Calmette-Guérin, pode induzir proteção contra COVID-19 (13/10/2020). Fonte: The Lancet.
16/10/2020
A farmacêutica Pfizer em comunicado no site da empresa afirma que embora a Pfizer pudesse ter números preliminares até o final de outubro sobre se a vacina funciona, ela ainda precisaria coletar dados de segurança e fabricação que se estenderão o cronograma para pelo menos a terceira semana de novembro. Logo, a Pfizer não solicitaria autorização de emergência para sua vacina contra o coronavírus antes da terceira semana de novembro (16/10/2020). Fonte: Pfizer e The New York Times
O comitê de medicamentos humanos da EMA (CHMP) deu início a uma "revisão contínua" de dados sobre a vacina para COVID-19 conhecida como BNT162b2, que está sendo desenvolvida pela BioNTech em colaboração com a Pfizer. A decisão do CHMP de iniciar a revisão contínua do BNT162b2 é baseada em resultados preliminares de estudos não clínicos e clínicos em adultos que sugerem que a vacina desencadeia a produção de anticorpos e células T (células do sistema imunológico, as defesas naturais do corpo) que visam o vírus. A EMA irá concluir a sua avaliação de acordo com os seus padrões habituais de qualidade, segurança e eficácia. Embora o cronograma geral da revisão ainda não possa ser previsto, o processo deve ser mais curto do que uma avaliação regular devido ao tempo ganho durante a revisão contínua (06/10/2020). Fonte: EMA
Revisão resume os principais avanços das vacinas e antivirais atuais contra SARS-CoV e MERS-CoV, bem como discute o desafio e a oportunidade na crise atual de SARS-CoV-2. No final, os autores suportam o desenvolvimento de tecnologias de plataforma “plug-and-play” que possam permitir a fabricação e administração rápida de contramedidas de amplo espectro em um cenário de surto. São discutidos também o potencial da tecnologia de terapia genética baseada em sistemas de vetores AAV para a entrega de anticorpos terapêuticos in vivo para combater o surto de SARS-CoV-2 e possíveis futuros surgimentos de outros coronavírus graves (24/04/2020). Fonte: Front. Microbiol.
15/10/2020
Segundo o governo de São Paulo a vacina contra a COVID-19, CoronaVac, desenvolvida pelo laboratório chinês Sinovac e testada no país em parceria com o Instituto Butantan, terá os resultados dos estudos de fase 3 reunidos na próxima sexta-feira (16) e apresentados publicamente na segunda-feira (19). Mesmo sem a resposta sobre a eficácia da CoronaVac, o governo de SP já está divulgando o plano de vacinação, que começará em 15 de dezembro, com prioridade para profissionais de saúde. Na sequência, serão vacinados professores e portadores de doenças crônicas que podem agravar a infecção pelo coronavírus. O acordo com a Sinovac prevê a entrega de 60 milhões de doses da CoronaVac até fevereiro de 2021, entre àquelas entregues já prontas pela Sinovac e àquelas envasadas no Instituto Butantan, que assumirá a tecnologia de produção que permitirá a produção local para distribuição no Brasil. A expectativa é de que até maio sejam acumuladas 100 milhões de doses, e investimentos estão sendo realizados para ampliação da capacidade produtiva do Butantan, para que possam ser produzidas as 100 milhões de doses por ano (14/10/2020). Fonte: Olhar Digital
14/10/2020
Estudo apresenta evidências experimentais e in silico que sugerem ser improvável que as vacinas para COVID-19 sejam afetadas pela mutação D614G na proteína S do SARS-CoV-2. Foram realizados ensaios de neutralização do vírus utilizando-se soros de furões que receberam duas doses da vacina INO-4800 contra a COVID-19, e isolados de vírus australianos (VIC01, SA01 e VIC31) que possuem ou não possuem essa mutação. Através dessa abordagem, apoiada pela modelagem biomolecular dessa mutação e pela mutação P314L comumente associada na polimerase viral, foi demonstrado que não há evidências experimentais que sustentem a especulação de que as vacinas poderiam ser afetadas pela mutação D614G (08/10/2020). Fonte: Nature
Rússia registra segunda vacina contra COVID-19. Fórmula de laboratório da Sibéria ainda não passou pela última fase de ensaios clínicos (14/10/2020). Fonte: O Globo
13/10/2020
Neste estudo, as células T e os epítopos das células B foram previstos e os resíduos selecionados foram submetidos à pesquisa de alergenicidade, antigenicidade e toxicidade para formar uma vacina de subunidade de múltiplos epítopos. As propriedades físico-químicas da vacina em da construção foram analisadas e o peso molecular, fórmula molecular, valor do ponto isoelétrico teórico, meia-vida, pontuação de solubilidade, índice de instabilidade, índice alifático e GRAVY foram preditos. A estrutura da vacina foi construída, refinada, validada e projetada para obter o melhor modelo. Simulação de ligação molecular e simulação de dinâmica molecular foram realizadas para prever a estabilidade e afinidade de ligação da vacina com TLRs. A aclimatação do códon e a clonagem in silico foram realizadas para confirmar a expressão e potência da vacina. Os resultados obtidos indicaram que esta nova vacina candidata é atóxica, capaz de iniciar a resposta imunogênica e não induzir uma reação alérgica. O aumento constante na população de células Th (T-helper) com o desenvolvimento da memória e IFN-g (Interferon gama) provocado após a simulação. Neste ponto, a vacina candidata aguarda teste em animal para validar sua eficácia e segurança para uso na prevenção de novas infecções por COVID-19 (04/10/2020). Fonte: Informatics in Medicine Unlocked
A farmacêutica Johnson & Johnson disse nesta segunda-feira que interrompeu o teste clínico avançado de sua vacina experimental contra o coronavírus por causa de uma doença inexplicada em um dos voluntários. Afirmou que a doença do participante está sendo avaliado pelo Conselho de Monitoramento de Segurança de Dados independente ENSEMBLE (DSMB), bem como por nossos médicos clínicos e de segurança internos", ENSEMBLE é o nome do estudo (13/10/2020). Fonte.: CNN
09/10/2020
O diretor-geral da Organização Mundial da Saúde (OMS), Tedros Adhanom Ghebreyesus, afirmou que há a esperança de uma vacina contra a COVID-19 se viabilizar até o fim do ano. Foi apresentado um painel executivo, mas sem detalhar qual dos imunizantes testados em larga escala no mundo poderia ser comprovado como seguro e eficaz para bloquear a infecção pelo coronavírus (06/10/2020). Fonte: O Globo / WHO
Em artigo de revisão, pesquisadores apresentam avanços recentes no desenvolvimento de vacinas, com foco na descoberta, formulação e dispositivos de carreamento de vacinas habilitados por abordagens alternativas de administração. Destacam o desenvolvimento das melhores soluções para estratégias mais rápidas e melhores de desenvolvimento de vacinas por meio do uso de biomateriais, engenharia biomolecular, nanotecnologia e técnicas de microfabricação (01/10/2020). Fonte: ACS Nano

08/10/2020
Uma vacina experimental chinesa contra o coronavírus que está sendo desenvolvida pelo Instituto de Biologia Médica da Academia Chinesa de Ciências Médicas mostrou-se segura em um ensaio clínico de Fase 1 com 191 participantes saudáveis com idades entre 18 e 59. A vacinação com a injeção experimental do grupo, com 3 doses diferentes (50, 100 e 150 EU) não mostrou reações adversas graves. As amostras de soro incubadas com o vírus não mostraram efeitos de amplificação dependentes de anticorpos (ADEs) em relação a células NK humanas, macrófagos ou células dendríticas. No dia 14, as taxas de soroconversão atingiram 92%, 100% e 96% com títulos médios geométricos (GMTs) de 18,0, 54,5 e 37,1, e no dia 28, as taxas de soroconversão atingiram 80%, 96% e 92% com GMTs de 10,6, 15,4 e 19,6 em procedimentos de 0, 14 e 0, 28, respectivamente. A soroconversão foi associada com a suprarregulação sincronizada de anticorpos em teste ELISA contra a proteína S, proteína N e vírion, além de uma resposta de linfócitos T citotóxicos (CTL). A análise do transcriptoma demonstrou a diversidade genética da resposta imune induzida pela vacina. Os dados sugerem que em uma população de 18 a 59 anos, esta vacina SARS-CoV-2 inativada foi segura e imunogênica (06/10/2020). Fonte MedRxiv
07/10/2020
A Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG) começa na próxima semana os testes com a vacina desenvolvida pelo grupo Johnson & Johnson contra a COVID-19 e buscas ate 2000 voluntários. Interessados em participar do cadastro devem ter mais de 18 anos e não precisam ser da área da saúde. Esse estudo faz parte da fase 3 da vacina, conhecida como Ad26.COV2.S que utiliza como vetor um adenovírus humano, sem capacidade de replicação, onde se insere o material genético do SARS-CoV-2 (05/10/2020). Fonte: G1
A FDA, agência americana que regula medicamentos e produtos de saúde, divulgou nesta terça-feira, 6, diretrizes atualizadas e mais rígidas para a aprovação emergencial de uma vacina contra o novo coronavírus no país. As novas diretrizes recomendam a coleta de dados extras sobre a segurança das vacinas na fase final dos ensaios clínicos, incluindo o acompanhamento dos voluntários por uma média de dois meses após a dose final. A FDA também espera que os fabricantes de vacinas documentem cinco casos de infecção grave em pessoas que receberam o placebo em vez da vacina (06/10/2020). Fonte: Veja
06/10/2020
Estudo sugere que a vacinação com BCG permite que o sistema imunológico inato forneça proteção contra infecções graves por COVID-19. Autores relatam, por exemplo, que na mesma área geográfica com condições socioeconómicas semelhantes, observam-se taxas de mortalidade completamente diferentes e particularmente elevadas na Espanha onde a vacinação contra a tuberculose não é obrigatória, ao contrário de Portugal (29/09/2020). Fonte: PNAS
Estudos epidemiológicos revelam que a infecção de SARS e COVID-19 em crianças é menos frequente e menos grave do que em adultos. Assim, pesquisadores sugerem que a imunidade celular cruzada mediada por vacina infantil e a imunomodulação podem fornecer proteção contra as infecções por COVID-19. Esses dados sugerem que a imunização de rebanho com vacinas infantis em adultos pode melhorar a imunidade celular cruzada e a imunomodulação em adultos e melhorar sua apresentação clínica e prognóstico. (26/09/2020) Fonte: Acta Microbiologica et Immunologica Hungarica
05/10/2020
Página com acompanhamento dos estudos relativos à COVID-19, com destaque para 5 vacinas aprovadas para uso limitado pelos governos chinês e russo (05/10/2020). Fonte: NYT
A UFRJ iniciou nesta segunda-feira (5) a fase de testes para verificar se uma vacina geralmente utilizada contra tuberculose (BCG) pode contribuir para a prevenção contra a COVID-19. A vacina não substituirá, porém, uma eventual imunização especifica contra o novo coronavírus. Mil profissionais de saúde serão vacinados com a vacina BCG, e acompanhados pelos próximos 6 a 12 meses para verificar se a vacina produz efeito protetor no grupo vacinado (05/10/2020). Fonte: G1
A revista Nature Biotechnology convocou um grupo de especialistas para fornecer suas informações sobre as vacinas SARS-CoV-2 em desenvolvimento. As perguntas giram em torno das vacinas COVID-19 enquanto estas entram em testes clínicos em estágio final com antecipação de um projeto de autorização de uso de emergência nos Estados Unidos. Como é ampliar o conhecimento das respostas imunológicas ao SARS-CoV-2 informando a pesquisa sobre vacinas? Quais são os prós e contras das diferentes modalidades de vacinas em descoberta e desenvolvimento clínico? Quais são os principais desafios associados aos testes clínicos, e quais são suas implicações para a segurança e eficácia dos programas de imunização na população global mais ampla? E quais questões relacionadas à fiscalização regulatória, fabricação e distribuição provavelmente serão importantes na implantação de uma vacina COVID-19? (28/09/2020). Fonte: Nature Biotechnology

Estudo em fase inicial desenvolvido pela Universidade Federal de Santa Catarina aponta que vacina tríplice viral (sarampo, caxumba e rubéola)pode reduzir sintomas da COVID-19. A investigação conta com 400 profissionais da área de saúde. Os resultados mostraram que dentre os indivíduos diagnosticados com COVID-19, 83% daqueles vacinados permaneceram assintomáticos; o índice cai para 50% no grupo que recebeu placebo. (01/10/2020). Fonte: OSul.
Pesquisadores apresentam as respostas de anticorpos e células T após a vacinação com a vacina BNT162b1 contra COVID-19 de um segundo ensaio de fase 1/2 aberto não-randomizado em adultos saudáveis, de 18 a 55 anos de idade. Com duas doses de BNT162b1 foram obtidas respostas robustas de células T CD4 + e CD8 + e fortes respostas de anticorpos, com concentrações de IgG de ligação a RBD claramente acima daquelas em um painel de amostra de convalescença humana por COVID-19. Os soros imunes neutralizaram amplamente os pseudovírus com diversas variantes da proteína S do SARS-CoV-2. O anticorpo RBD específico robusto, células T e respostas de citocinas favoráveis induzidas pela vacina de mRNA BNT162b1 sugerem múltiplos mecanismos benéficos com potencial para proteger contra COVID-19 (30/09/2020). Fonte: Nature
01/10/2020
Anvisa começa a análise do 1º pedido de registro de uma vacina contra a COVID-19 no Brasil. Pedido foi protocolado pela empresa Astrazeneca. A farmacêutica britânica está desenvolvendo uma vacina em parceria com a Universidade de Oxford, que deverá ser produzida no Brasil pela Fundação Oswaldo Cruz (Fiocruz). O pedido de análise junto à Anvisa é o passo inicial para que seja autorizada a aplicação da vacina no país. Entretanto, ainda é preciso que sejam concluídos os testes clínicos, que estão em andamento (01/10/2020). Fonte: G1
Estudo no Japão avaliou a cobertura da vacina BCG em 1999–2002, 2004 e 2012 em cinco prefeituras sem infecções por COVID-19 que foi significativamente maior do que em cinco prefeituras com alta prevalência de infecções (teste U de Mann-Whitney, p <0,05). A prevalência da infecção por SARS-CoV-2 foi significativamente negativa correlacionada com a cobertura da vacina BCG em 2004 e foi significativamente positiva correlacionada com os grupos de idade 20-34 e 40-54 anos (correlação de Spearman, p <0,01). Os resultados sugerem que a cobertura vacinal de rotina infantil com BCG na geração jovem teve um impacto significativo na prevenção da disseminação local de COVID-19 no Japão (12/08/2020). Fonte: Journal of Infection
Artigo fornece uma análise crítica dos processos de desenvolvimento de vacinas e operações de unidade que podem inviabilizar a resposta à pandemia. Os principais obstáculos técnicos relativos à formulação de antígeno-adjuvante, entrega e desafios de fabricação de nanopartículas lipídicas (LNPs) para vacinas de mRNA e estabilidade das formulações precisam ser resolvidos para o desenvolvimento e armazenamento de produtos com sucesso. Além disso, a forma de dosagem, o nível de dosagem e o regime para induzir uma resposta imune protetora ainda precisam ser estabelecidos. A alta dependência das cadeias de abastecimento globais e da oferta de demanda para obter matérias-primas de qualidade, artigos de vidro e outros suprimentos, junto com o estresse sobre as capacidades de produção existentes e os desafios de fabricação específicos da plataforma podem impedir o desenvolvimento e o acesso à vacina (29/09/2020). Fonte: Human Vaccines & Immunotherapeutics
Pesquisadores relatam que a imunização com proteína recombinante SARS-CoV-2 RBD em camundongos é capaz de induzir uma forte resposta de anticorpos e potente capacidade de neutralização conforme medido usando ensaios de neutralização de SARS-CoV-2 vivos ou pseudotipados (29/09/2020). Fonte: Human Vaccines & Immunotherapeutics
30/09/2020
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou uma nota técnica nesta terça-feira (29) que reduz a documentação inicial e simplifica o registro para vacinas da Covid-19. A Anvisa estabeleceu um prazo de até 20 dias para dar resposta à farmacêutica ou instituição interessada. Durante o período, a reguladora irá comunicar eventuais pendências e informações a serem apresentadas e, assim, agilizar o processo sem afetar o padrão de qualidade requerido (29/09/2020). Fonte: O Globo
Um estudo feito com 40 pacientes com mais de 56 anos mostrou que a vacina mRNA-1273, produzida pela farmacêutica norte-americana Moderna contra a Covid-19, provocou reações leves ou moderadas em idosos. Os pacientes foram divididos em dois grupos: 56 a 70 anos e acima de 71 anos, todos receberam duas doses, administradas com 28 dias de intervalo. Os dados sugerem que uma segunda dose da vacina é necessária para obter anticorpos neutralizantes em participantes com mais de 56 anos. Resposta de células T CD4 também foi observada neste grupo de pacientes (29/09/2020). Fonte: New England Journal of Medicine
Artigo traz as vantagens das vacinas inteiras inativadas, que preservam a estrutura intacta dos antígenos e seus epítopos de células B, que os permitem interagir com os anticorpos e promovem a síntese de anticorpos neutralizantes. Além disso, compara a eficácia das vacinas já publicadas com os resultados. Os autores, concluem apresentando a realidade de alguns países em desenvolvimento, onde as doenças infecciosas costumam ser as causas mais importantes de mortalidade, dando como exemplo o caso do Instituto Butantan e Bio-Manguinhos no Brasil (26/08/2020). Fonte: Frontiers in Immunology
29/09/2020
Artigo faz uma revisão sobre as vacinas em desenvolvimento para a COVID-19, e os autores sugerem que os resultados até então apresentados indicam que teremos uma vacina em questão de meses, e não de anos como seria esperado (23/ 09/ 2020). Fonte Nature
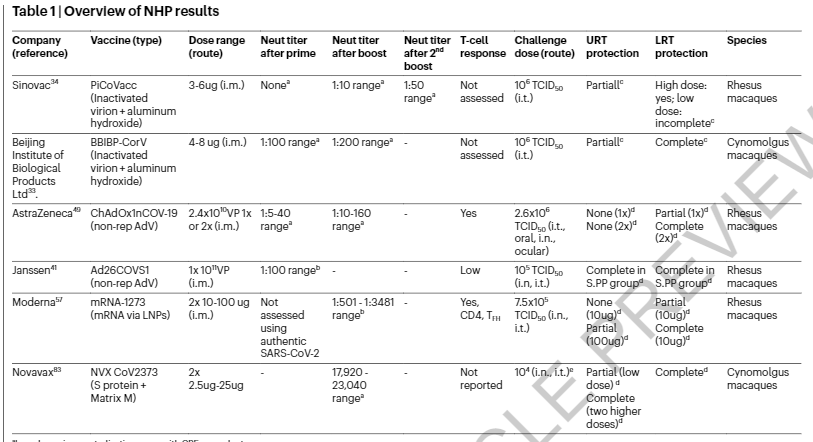
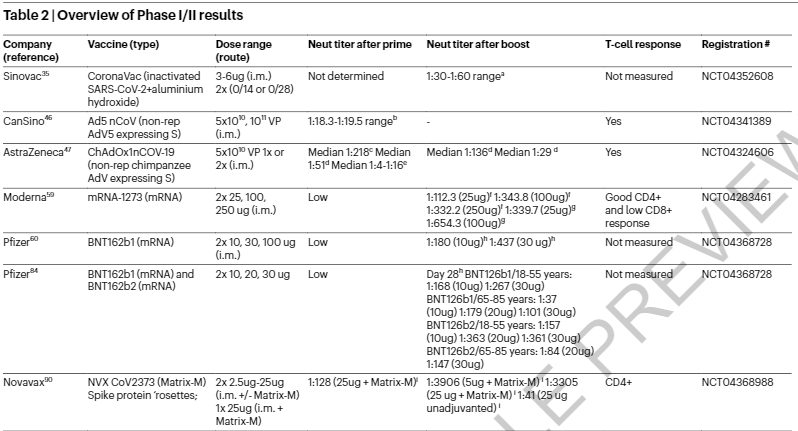
A Janssen, braço farmacêutico da Johnson & Johnson, publicou no sábado (26) os resultados preliminares dos estudos fase 1/2a da sua vacina contra a covid-19. Segundo a companhia, os ensaios demonstraram que, com uma única dose, induziu uma forte resposta imunológica. Com base nesses resultados, segundo a companhia, a Janssen dará continuidade aos estudos clínicos fase 3 nos 60 mil voluntários em todo mundo. No Brasil, os ensaios serão realizados em sete mil pessoas de 18 a 60 anos (28/09/2020). Fonte Valor Investe
28/09/2020
O Diretor do Butantã anuncia que apesar da ampliação de 6 mil para 13 mil voluntários no teste da vacina CoronaVac, com a ampliação dos centros de testagem, o cronograma previsto será mantido. A previsão é de que 5 milhões de doses cheguem ao Instituto ainda em outubro, mas a vacinação depende do resultado dos estudos em andamento (28/09/2020). O Globo
25/09/2020
Estudo analisa criticamente os avanços científicos mais recentes em genômica, padrão de replicação, patogênese e imunopatologia da infecção por SARS-CoV-2 e como esses conceitos podem ser usados no desenvolvimento de vacinas. Também oferece uma discussão detalhada sobre a potência, eficácia, segurança e questões farmacoeconômicas previstas que estão e serão associadas às vacinas candidatas (16/09/2020). Fonte: Human Vaccines & Immunotherapeutics
Artigo de revisão explora as respostas imunes necessárias para proteger contra SARS-CoV-2 e o potencial para imunopatologia induzida por vacina. Ele descreve o perfil das diferentes plataformas e as vantagens e desvantagens de cada abordagem. A revisão também aborda as etapas críticas entre os ensaios pré-clínicos e a fabricação em escala. Os problemas enfrentados durante a pandemia da COVID-19 e as plataformas em desenvolvimento para abordá-los serão inestimáveis para o controle de surtos futuros. Nove meses após o início do surto, estamos em um ponto em que os dados pré-clínicos e clínicos iniciais estão sendo gerados para as vacinas (15/09/2020). Fonte: Clinical & Experimental Immunology
24/09/2020
Revisão sobre vacinas em desenvolvimento, as estratégias adotadas para seu design e os desafios e impactos clínicos esperados para as mesmas. O artigo também discute o possível papel dessas vacinas e de preocupações específicas em pacientes com doenças pré-existentes, como doenças cardiovasculares, pulmonares, renais e hepáticas, e pacientes com câncer recebendo medicamentos imunossupressores, e outras populações sensíveis, como crianças e idosos (18/09/2020). Fonte: ACS Pharmacology &Translational Science

Reportagem discute como a pandemia da COVID-19 representa uma oportunidade de colocar à prova novas tecnologias para produção de vacinas que vem sendo desenvolvidas há 30 anos e que utilizam engenharia genética. Tais tecnologias permitem fabricar vacinas mais seguras de forma mais simples e rápida, faltando ainda a comprovação de que elas realmente possuem efeito. A reportagem ainda faz uma revisão sobre os tipos de vacinas existentes e as principais empresas que as desenvolvem (24/09/2020). Fonte: BBC News Brasil
23/09/2020
Resultados de uma pesquisa com 50.027 voluntários na China demonstram que a vacina Coronavac, desenvolvida pelo Instituto Butantan em parceria com a farmacêutica chinesa Sinovac Life Science, é segura e não apresentou reações adversas significativas. Do total de voluntários, 94,7% não tiveram nenhuma reação adversa. Outros 5,36% sentiram efeitos adversos de grau baixo, como dor no local da aplicação, febre moderada e perda de apetite. Começaram na China os testes em crianças e idosos. Entre as pessoas com mais de 60 anos, a vacina foi aplicada em 422 voluntários e os resultados apontaram 97% de eficácia. Os estudos em crianças têm 552 voluntários de 3 a 17 anos. Até dezembro o Instituto Butantan receberá 46 milhões de doses da Coronavac, sendo 6 milhões de doses da vacina já prontas para aplicação. Outras 15 milhões de doses devem chegar até fevereiro de 2021 (23/09/2020). Fonte: Portal do Governo de São Paulo
Pesquisa realizada pelo professor catedrático da Universidade Duke, na Carolina do Norte, que desde o início da pandemia se dedica a estudar o comportamento do coronavírus no Brasil aponta para a possibilidade de que vacinas aprovadas ou em desenvolvimento para a dengue possam provocar alguma forma de proteção contra o novo coronavírus (21/09/2020). CNN
A Johnson & Johnson anunciou o lançamento dos testes clínicos em fase 3 de larga escala, ENSEMBLE, para sua candidata à vacina para COVID-19, JNJ-78436735, que está sendo desenvolvida por suas empresas farmacêuticas Janssen. O estudo clínico fase 1/2a da empresa demonstrou que o perfil de segurança e a imunogenicidade após uma única vacinação apoiaram o desenvolvimento posterior. O estudo ENSEMBLE será um ensaio clínico randomizado, duplo-cego e controlado por placebo projetado para avaliar a segurança e a eficácia de uma única dose de vacina versus placebo em até 60.000 adultos com 18 anos ou mais, incluindo representação significativa daqueles com mais de 60 anos. O estudo incluirá aqueles com e sem comorbidades associadas a um risco aumentado de progressão para COVID-19 grave, e terá participantes na Argentina, Brasil, Chile, Colômbia, México, Peru, África do Sul e Estados Unidos (23/09/2020). Fonte: J&J
As vacinas anti-SARS-CoV-2 estão sendo desenvolvida em um ritmo sem precedentes, a opinião de seis especialistas sobre como será a vacina ou vacinas finais após a aprovação e depois (10/09/2020). Fonte: Nature medicine
O governo do estado do Rio de Janeiro anunciou que a Companhia de Desenvolvimento Industrial do Estado do Rio de Janeiro (Codin) e a Fundação Oswaldo Cruz (Fiocruz) celebraram um acordo para a instalação do Complexo Industrial de Biotecnologia em Saúde, no Distrito Industrial de Santa Cruz. Será a maior fábrica de vacinas da América Latina. A unidade vai ocupar uma área de 580 mil metros quadrados e terá capacidade de produção de 120 milhões de frascos de vacinas e biofármacos por ano. A expectativa é de que as obras gerem cinco mil empregos diretos. Previsto para estar pronto em 2023, o complexo será responsável por toda produção de vacinas da Fiocruz, inclusive a de Covid-19, quando esta for aprovada (18/09/2020). Fonte: ODIA.
16/09/2020
Estudo descreve uma vacina baseada no vírus da influenza para SARS-CoV-2. O vírus ΔNA(RBD)–Flu, contendo o domínio de ligação do receptor spike do SARS-CoV-2 (RBD), pode ser gerado por genética reversa e cultivado em cultura de células. Uma inoculação intranasal de dose única em camundongos com ΔNA(RBD)-Flu provoca a produção de títulos de anticorpos neutralizantes contra SARS-CoV-2 comparáveis aos observados em humanos após infecção natural (~ 1: 200). Além disso, o próprio ΔNA(RBD)-Flu não causa doença aparente em camundongos. A produção de uma vacina semelhante a ΔNA (RBD)-Flu em escala, aproveitando as plataformas existentes para a produção de vacinas contra a gripe, pode ser viável (05/09/2020). Fonte: Viruses.
Artigo discute os desafios para o desenvolvimento de vacinas incluindo a segurança, eficácia, os testes em humanos e a capacidade de produção no desenvolvimento da vacina COVID-19 (14/09/2020). Fonte: Engineering
Em uma carta aberta aos autores do estudo sobre a vacina russa Sputnik V, que publicaram os resultados do ensaio1 neste mês no The Lancet, os pesquisadores destacam valores que parecem estar duplicados e alertam que o artigo apresenta seus resultados apenas como boxplots, sem fornecer uma análise detalhada dos dados em que se baseiam. Até agora, foi assinado por 38 cientistas. O principal autor do artigo russo, Denis Logunov, do Centro Nacional de Pesquisa de Epidemiologia e Microbiologia de Gamaleya em Moscou, não respondeu aos pedidos de comentários da equipe de notícias da Nature. Ele negou que houvesse erros na publicação e afirmou que os níveis de anticorpos medidos eram “exatamente como eram apresentados” nas figuras (15/09/2020). Fonte: Nature
15/09/2020
O desenvolvimento pré-clínico e clínico de medicamentos à base de anticorpos e vacinas contra o SARS-CoV-2 está acelerado. No entanto, dados do estudo sobre SARS-CoV e outros vírus respiratórios sugerem que anticorpos para anti-SARS-CoV-2 podem exacerbar a COVID-19 através da amplificação dependente de anticorpos (ADE). Estudos anteriores de vacinas para o vírus sincicial respiratório e o vírus da dengue revelaram riscos de segurança clínica a relacionados à ADE, resultando em testes de vacinas fracassados. No presente estudo, os autores descrevem os principais mecanismos da ADE e discutem estratégias de mitigação para as vacinas e terapias em desenvolvimento para SARS-CoV-2. Os autores também relatam dados publicados recentemente para avaliar os riscos e oportunidades de proteção baseada em anticorpos contra SARS-CoV-2 (09/09/2020). Fonte: Nature Microbiology
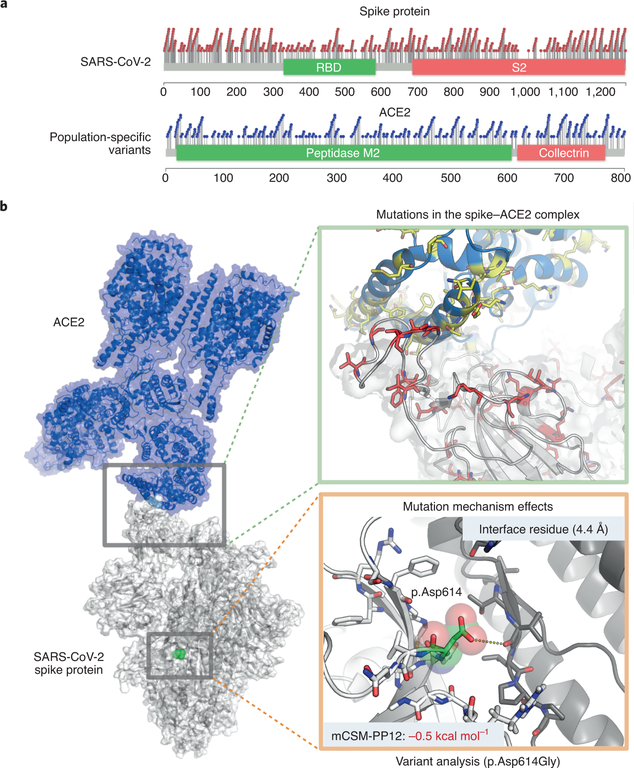
Em carta para o editor, pesquisadores abordam que anticorpos produzidos contra vacina de coronavírus de vírus inteiros inativados, especialmente as que produzem anticorpos direcionados à proteína S, podem aumentar a infecção viral de células que expressam o receptor Fc (FcR) - um fenômeno chamado amplificação dependente de anticorpos (ADE), que está bem documentado para flavivírus. Os autores citam que todas as vacinas candidatas à SARS-CoV-2, até o momento, que entraram em testes clínicos contêm ou expressam a proteína S completa ou quase completa e, portanto, apresentam risco de ADE. O estudo avalia a possibilidade das vacinas baseadas em SARS-CoV-2 RBD recombinante induzir anticorpos neutralizantes em camundongos e se tais anticorpos promoveriam ADE in vitro (03/09/2020). Fonte: Cell Discovery
Em carta para o editor, pesquisadores citam que a proteína regulada por glicose 78 (CS-GRP78) da superfície celular, chamada de proteína de choque térmico A5 (HSPA5), pode ser uma rota possível para a internalização de SARS-CoV-2. Os autores previram que o sítio de ligação da proteína S de SARS-CoV-2 pode reconhecer CS-GRP78. Através do uso de uma abordagem de bioinformática simples sugeriram um possível papel do GRP78 na imunização cruzada de células T contra COVID-19. Os autores concluiram que coronavírus humanos leves podem ser úteis como uma vacinação contra COVID-19. Ao analisar sete cepas de coronavírus humano (NL63, 229E, OC43, HKU1, MERS-CoV, SARS-CoV e SARS-CoV-2) notou-se que resíduos mais conservados no SARS-CoV-2 em comparação com outras cepas são C480, G485 e C488 (10/09/2020). Fonte: Journal of Infection
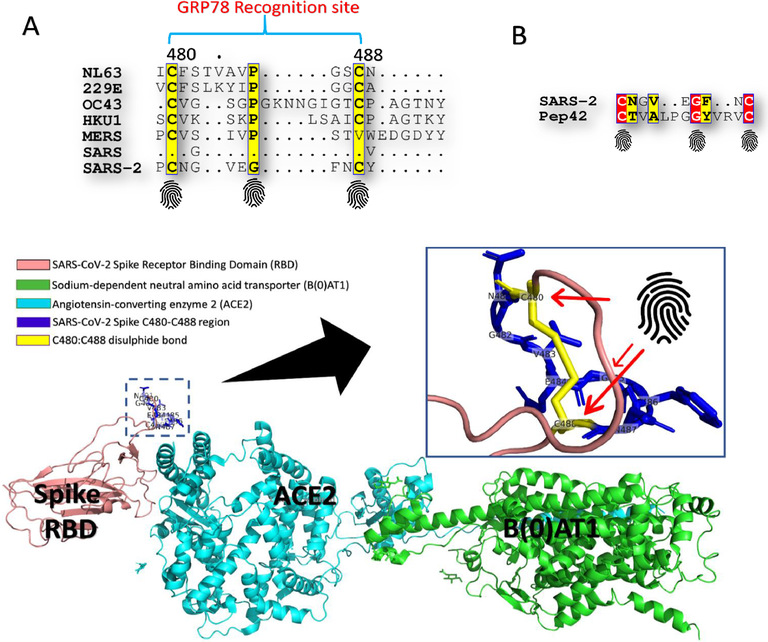
Anvisa autorizou que mais 5 mil voluntários participem da fase 3 do estudo clínico da vacina de Oxford no Brasil. Com essa permissão, o país terá 10 mil voluntários na última etapa de testes do imunizante contra a COVID-19 desenvolvido pela universidade em parceria com a farmacêutica AstraZeneca. De acordo com a líder dos estudos no Brasil, agora será dada prioridade para os testes em idosos acima dos 70 anos porque essa faixa etária foi incluída na pesquisa somente em 21 de agosto, depois de a segurança vacina ser comprovada com os testes nas faixas etárias mais novas (15/09/2020). Fonte: G1
14/09/2020
Os testes da vacina contra COVID-19 desenvolvida por pesquisadores da Universidade de Oxford em parceria com o laboratório sueco AstraZeneca, que estão na última fase, serão retomados no Brasil nesta segunda-feira (14), segundo a farmacêutica. Após avaliar os dados do evento adverso, sua causalidade e o conjunto de dados de segurança gerados no estudo, a Anvisa concluiu que a relação risco/benefício se mantém favorável e, por isso, o estudo poderá ser retomado (14/09/2020). Fonte: G1
11/09/2020
Artigo discute a vacina Russa Sputnik V, desenvolvida pelo Gamaleya National Center of Epidemiology and Microbiology, e as implicações da aprovação prematura da vacina antes mesmo do início da fase 3 dos testes clínicos e da publicação dos resultados de fases I e II (05/09/2020). Fonte: The Lancet
Muitas das vacinas em desenvolvimento para COVID-19 envolvem o uso de vetores virais. O grupo de trabalho preparou um modelo padronizado para descrever as principais considerações para a avaliação de risco-benefício de vacinas de vetores virais. Segundo pesquisadores, este estudo facilitará as principais partes interessadas a prever possíveis problemas de segurança e interpretar ou avaliar os dados de segurança. Isso também ajudaria a melhorar a comunicação e a aceitação pública das vacinas de vetores virais licenciadas (06/09/2020). Fonte: Vaccine
Artigo de revisão apresenta a nova geração de vacinas baseadas em RNA auto-amplificador (saDNA) de alfavírus. Segundo os autores, as vacinas de DNA ou mRNA têm vantagens potenciais sobre as vacinas convencionais, uma vez que são mais fáceis de fabricar e têm perfis de segurança mais elevados. Em particular, o RNA autoamplificador (saRNA) derivado de vetores de expressão de alfavírus tem se mostrado muito eficiente para induzir respostas humorais e celulares contra muitos antígenos em modelos pré-clínicos, sendo superior ao mRNA e DNA não replicantes. Isso se deve principalmente ao fato de que o saRNA pode fornecer níveis de expressão muito elevados e, simultaneamente, induzir fortes respostas inatas, potencializando a imunidade. O alfavírus saRNA pode ter ampla aplicação para vacinar contra patógenos humanos, incluindo os emergentes como o SARS-CoV-2, para o qual os ensaios clínicos foram iniciados recentemente (06/09/2020). Fonte: Current Opinion in Virology

A vacina da tuberculose, a BCG, será testada contra o coronavírus no Brasil. A BCG é conhecida por provocar uma resposta imunológica ampla, e estudos sugeriram que poderia oferecer proteção contra a COVID-19. Os testes no Brasil serão realizados pela Fundação Oswaldo Cruz (Fiocruz) num acordo de pesquisa com o Murdoch Children's Research Institute, instituto australiano de pesquisa médica pediátrica (11/09/2020). O Globo
Reportagem discute o tempo necessário para as aprovações de forma segura das vacinas e os impactos possíveis da suspensão dos estudos da vacina da AstraZeneca/Universidade de Oxford (10/09/2020). O Globo
10/09/2020
Os autores revisam a resposta de anticorpos desencadeada pela infecção pelo SARS-CoV-2 em humanos e como ela pode informar a pesquisa de vacinas. O isolamento e as propriedades da neutralização dos anticorpos monoclonais provenientes de pacientes de COVID-19 fornecem informações adicionais sobre os resultados que devem ser obtidos pelas vacinas. A natureza e a longevidade da resposta de anticorpos aos coronavírus são relevantes para a potência e duração da imunidade induzida pela vacina. O artigo resume a imunogenicidade das principais candidatas à vacina testadas até hoje em animais e humanos e discute os resultados e a interpretação dos experimentos de desafio de vírus em animais. As vacinas candidatas mais imunogênicas para respostas de anticorpos são as proteínas recombinantes. Uma preocupação substancial para as vacinas SARS-CoV-2 são os eventos adversos, apresentados nesta revisão considerando o que foi visto em estudos das vacinas SARS-CoV-1 e MERS-CoV. Por fim, o artigo delineia os possíveis resultados do desenvolvimento acelerado de vacinas, que vão desde o sucesso rápido esperado até uma influência adversa catastrófica na absorção de vacinas em geral (17/08/2020). Fonte: Journal of virology
Pesquisadores discutem os princípios imunológicos que precisam ser levados em consideração no desenvolvimento de estratégias de vacinas COVID-19. Com base nesses princípios, examinaram as vacinas candidatas COVID-19 atuais, seus pontos fortes e deficiências potenciais, e fizeram inferências sobre as chances de sucesso. Finalmente, discutiram os desafios científicos e práticos que serão enfrentados no processo de desenvolvimento de uma vacina bem-sucedida e as maneiras pelas quais as estratégias da vacina COVID-19 podem evoluir nos próximos anos (04/09/2020). Fonte: Nature Reviews Immunology
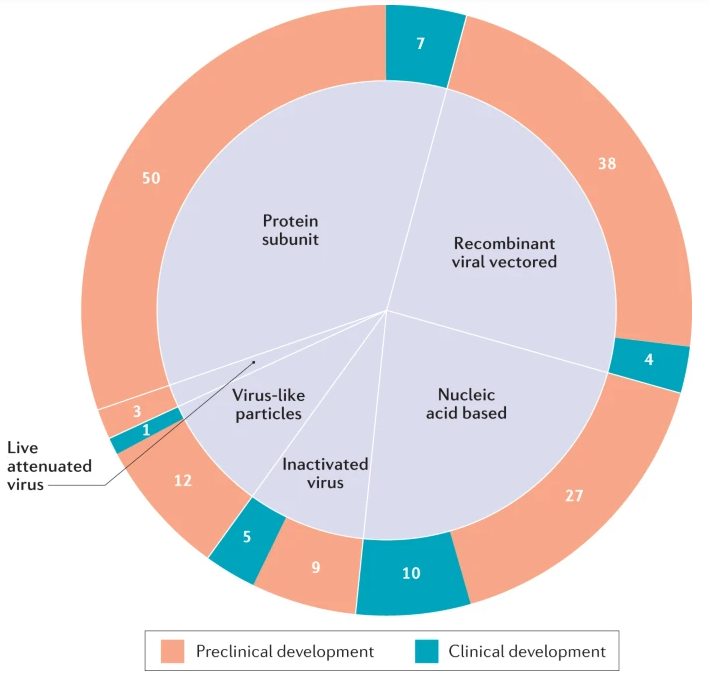
A parceria e a doação de empresas brasileiras foram anunciadas para o desenvolvimento da vacina UB-612 para a COVID-19 produzida pela Covaxx, subsidiária norte-americana da United Biomedical Inc (UBI). A UB-612 é um imunizante baseado em peptídeos, biomoléculas capazes de imitar o vírus para gerar respostas imunológicas celulares, que são mais duradoras, e humorais, ou seja, provocadas por anticorpos. Por ser completamente sintética, a candidata a vacina dispensa o uso e cultivo do SARS-CoV-2 para sua fabricação, diminuindo o risco biológico da fórmula e aumentando a capacidade de ser produzida em alta escala. Em estudos pré-clínicos com animais, o imunizante demonstrou um alto grau de imunogenicidade e neutralização do vírus, provando-se ser uma candidata à altura de outras vacinas que estão sendo testadas ao redor do mundo (09/09/2020). Fonte: Galileu
09/09/2020
Em comunicado a farmacêutica AstraZeneca suspendeu os testes de estágio final de sua candidata a vacina contra a COVID-19 após uma suspeita de "reação adversa séria" em um participante do estudo. A informação foi confirmada ao UOL. A vacina, que é desenvolvida em parceria com a Universidade de Oxford, é testada no Brasil e em outros países. “Como parte dos estudos clínicos randomizados e controlados da vacina de Oxford contra o coronavírus em andamento, nosso procedimento padrão de revisão foi acionado e voluntariamente pausamos a vacinação para permitir a revisão dos dados de segurança por um comitê independente” (08/09/2020). Fonte: UOL
Os testes da vacina CoronaVac vem demonstrando que é segura e tem taxa de eficiência de 98% na imunização de idosos. Estudos da segunda fase de testagem vem demonstrando que pessoas com mais de 60 anos, que representam um dos grupos de risco receberam mais de uma dose da vacina e a resposta imune chegou a 98%. Os testes de eficácia da vacina no Brasil deverão ser conhecidos até 15 de outubro (08/09/2020). Fonte: Agência Brasil
Estudo demostra que a infecção intranasal com alta dose de SARS-CoV-2 em hamsters resulta em doença clínica grave, incluindo altos níveis de replicação do vírus em tecidos, pneumonia extensa, perda de peso e mortalidade em um subconjunto de animais. Uma única imunização com uma vacina baseada em vetor de adenovírus sorotipo 26 expressando uma proteína S do SARS-CoV-2 estabilizada (Ad26.COV2.S) induziu respostas de anticorpos neutralizantes e de ligação e protegeu contra perda de peso induzida por SARS-CoV-2, pneumonia e mortalidade. Esses dados demonstram a proteção da vacina contra a doença clínica SARS-CoV-2. Este modelo deve ser útil para estudos pré-clínicos de vacinas SARS-CoV-2, terapêutica e patogênese. (03/09/2020). Fonte: Nature Medicine
08/09/2020
O Ministério de Saúde russo comunica que o primeiro lote de vacina Sputnik V, desenvolvida pelo Instituto Gamaleya de Epidemiologia e Microbiologia, passou nos testes de qualidade e foi liberada para a população civil russa (08/09/2020). Fonte: G1
Revisão tem como objetivo destacar os estágios atuais de desenvolvimento de vacinas e discutir os desafios que podem ser enfrentados com as mais de 164 vacinas candidatas em processo de desenvolvimento e, entre elas, 24 vacinas estão em estágio avançado de desenvolvimento (03/09/2020). Fonte: The Indian Journal of Pediatrics
Estudo desenvolveu um banco de dados chamado CoV3D que disponibiliza conjuntos abrangentes de estruturas de proteínas de coronavírus e seus complexos com anticorpos, receptores e pequenas moléculas de proteínas de coronavírus, que é atualizado semanalmente. Os visualizadores moleculares integrados permitem que os usuários visualizem estruturas da glicoproteína S, que é o principal alvo de anticorpos neutralizantes e esforços de design de vacina, bem como conjuntos de complexos de anticorpo de proteína S, variabilidade da sequência da proteína S e polimorfismos conhecidos (05/09/2020). Fonte: Nucleic Acids Research

04/09/2020
Estudo evidencia que uma vacina candidata SARS-CoV-2 provavelmente corresponderia a todas as variantes atualmente em circulação. Foram realizadas análises filogenéticas, de genética populacional e bioinformática estrutural de 18.514 sequências do vírus SARS-CoV-2 e comparadas com a sequência na qual a maioria das vacinas candidatas se baseia. Os autores encontraram diversidade limitada nos genomas do SARS-CoV-2: apenas 11 locais mostram polimorfismos em> 5% das sequências; no entanto, duas mutações, incluindo a mutação D614G na proteina Spike, já se tornaram consenso. Embora a rápida disseminação da mutação D614G justifique um estudo mais aprofundado, os resultados do estudo indicam uma diversidade mínima encontrada entre as sequências SARS-CoV-2, geralmente não em pontos essenciais do código genético. Essas descobertas sugerem que uma única vacina candidata deve ser eficaz contra linhagens circulantes atualmente (31/08/2020). Fonte: PNAS
Artigo apresenta os resultados de segurança e imunogenicidade, referentes às fases I e II de testes clínicos, da vacina Russa contra o SARS-CoV-2. A vacina heteróloga foi desenvolvida utilizando dois componentes, um vetor de adenovírus recombinante tipo 26 (rAd26) e um vetor de adenovírus recombinante tipo 5 (rAd5), ambos carregando o gene para a glicoproteína S do SARS-CoV-2 (rAd26-S e rAd5-S). O estudo avaliou ainda duas formulações (congelada e liofilizada) desta vacina. O estudo foi realizado entre junho e agosto de 2020 com 76 participantes (38 em cada fase). A vacina apresentou bom perfil de segurança e induziu fortes respostas imunes humorais e celulares nos participantes. O estudo está agora em fase 3 (04/08/2020). Fonte: Lancet
Artigo apresenta o panorama atual do desenvolvimento de vacinas para a COVID-19. Em 2 de setembro de 2020, o cenário global de P&D da vacina COVID-19 inclui 321 vacinas candidatas. Destas, 32 vacinas candidatas estão em ensaios clínicos, com planos de inscrever mais de 280.000 participantes de pelo menos 470 locais em 34 países diferentes (04/08/2020). Fonte: Nature Reviews Drug Discover
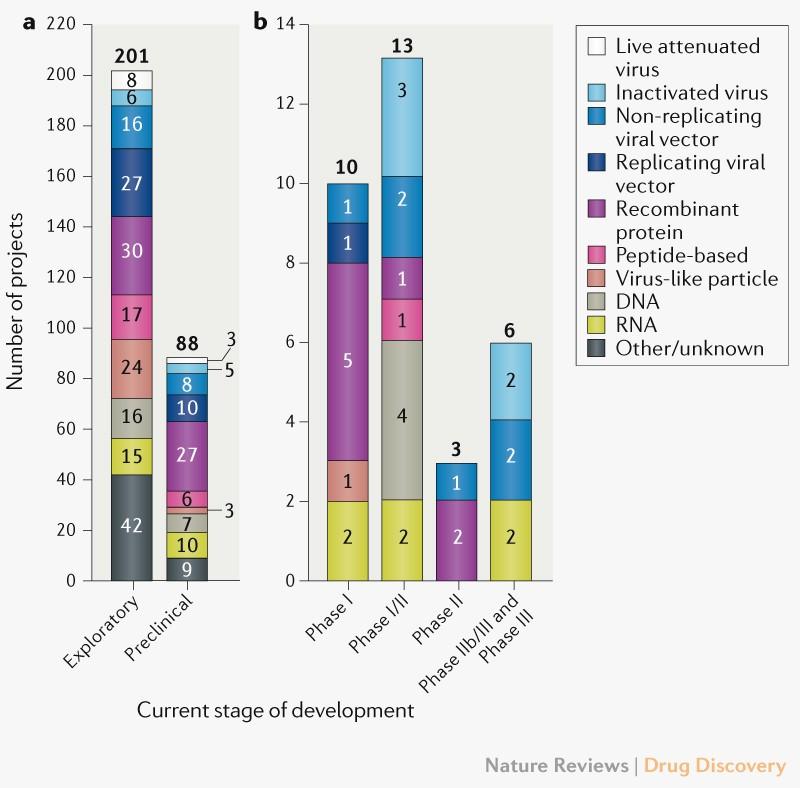
A Pfizer anunciou que pretende divulgar o resultado dos testes da vacina de RNAm contra COVID-19 já em outubro. A última fase de testes da proteção ainda está acontecendo e já foi realizada com 23.000 voluntários com idades entre 18 e 85 anos. Desse total, 1.000 serão testados no Brasil, com voluntários na Bahia e em São Paulo. Os demais participantes estão distribuídos em 39 estados dos Estados Unidos, e também na Argentina e na Alemanha. A empresa espera chegar a um total de 30.000 voluntários. (03/08/2020). Fonte: Exame
Através da aplicação de imunoinformática, foram identificadas sequências de epítopos de múltiplas glicoproteínas que desempenham papel crucial na patogênese da COVID-19. Particularmente, os epítopos foram mapeados a partir do domínio de ligação ao receptor conservado da proteína spike, que foram validados experimentalmente em SARS-CoV-1 como um alvo promissor para o desenvolvimento de vacinas. Uma construção de vacina com múltiplos epítopos compreendendo epítopos de células B, CTL e HTL foi desenvolvida juntamente com a fusão de adjuvantes e ligantes. Os epítopos identificados foram considerados altamente antigênicos, estáveis, não alergênicos, não tóxicos e com conservação exibida em vários isolados de SARS-CoV-2 de diferentes países (01/09/2020). Fonte: Expert Rev Vaccines.
Em entrevista, o Diretor Médico da Moderna Therapeutics, explica a tecnologia envolvida na vacina de mRNA em desenvolvimento pela startup. Além da vacina para a COVID-19, a empresa também emprega a tecnologia no estudo de vacinas para doenças tropicais, como Chikungunya e Ebola. O Diretor explica que, ao invés de administrar a proteína, a administração do mRNA permite ensinar as células do corpo a produzir proteínas codificadas pelo código do mRNA. No caso da vacina contra SARS-CoV-2, o mRNA deve determinar que as células do hospedeiro produzam a proteína spike, reconhecida pelo sistema imune, que passa a produzir os anticorpos específicos contra esta proteína. Como a proteína spike é responsável pela entrada do vírus na célula, os anticorpos que a reconhecem são chamados de neutralizantes. Como vantagens do emprego desta tecnologia, é citada a maior facilidade de produção e o fato do processo de imunização ter maior similaridade com o processo biológico. (02/09/2020). Fonte: Health Policy Watch
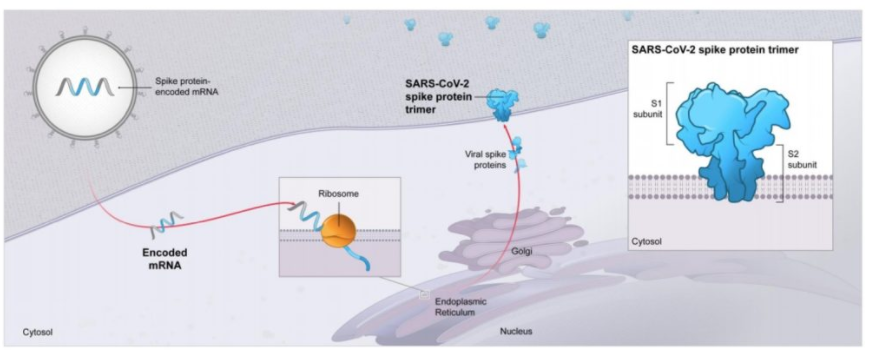
03/09/2020
Em uma instalação de nível de biossegurança 3, SARS-CoV-2 foi inoculado em células epiteliais brônquicas humanas. A inoculação gerou uma multiplicidade de infecção (indicando a proporção de partículas de vírus em relação às vias aéreas alvo células) de 3: 1. Essas células foram então examinadas 96 horas após a infecção com o uso de microscopia eletrônica de varredura. Uma imagem facial (Painel A) mostra uma célula infectada ciliada com filamentos de muco aderidos às pontas dos cílios. Com maior ampliação, uma imagem (Painel B) mostra a estrutura e a densidade dos vírions SARS-CoV-2 produzido por células epiteliais das vias aéreas humanas. A produção de vírus foi de aproximadamente 3 × 106 unidades formadoras de placa por cultura, um achado que é consistente com um alto número de vírions produzidos e liberados por célula (03/09/2020). Fonte: The New England Journal of Medicine.

A farmacêutica francesa Sanofi iniciará testes em humanos da vacina potencial contra o coronavírus, desenvolvida com a empresa britânica GSK, após testes preliminares com resultados promissores. A vacina à base de proteína, de propriedade da Sanofi e usada para tratar a gripe, foi combinada com um complemento desenvolvido pela GSK, conhecido como adjuvante, que aumenta a resposta imunológica do receptor (03/09/2020). Fonte: G1
Editorial discorre sobre os resultados de testes clínicos das candidatas às vacinas para COVID-19, mencionando as vacinas de mRNA e aquelas baseadas em vetores virais que estão em estágio avançado de testes clínicos. Os altos níveis de anticorpos neutralizantes induzidos por essas candidatas à vacina sugerem eficácia, mas não garantem que as vacinas conferem imunidade ou proteção contra doenças graves, nem que os efeitos benéficos durarão. As vacinas que provocam atividade substancial de células T podem ajudar a elevar a imunidade protetora. Como elas estão prestes a ser testados em dezenas de milhares de pessoas em ensaios da fase III, eventos adversos graves em uma pequena porcentagem de pessoas são uma possibilidade e a frequência em que ocorrerão afetará o grau de adesão à vacinação pela fração da população suscetível a argumentos anti-vacinas não científicos (10/08/2020). Fonte: Nature Biomedical Engineering
Como as vacinas para COVID-19 estão sendo desenvolvidas em um ritmo acelerado sem precedentes e como sua revisão também ocorrerá durante uma pandemia e em um ano de eleição presidencial, as lições da autorização de hidroxicloroquina, que foi concedida e, em seguida, revogada, podem se aplicar à regulamentação dessas vacinas. Neste contexto, são levantadas questões sobre o rigor e a velocidade com que a Agência de Regulação de Medicamentos e Alimentos dos Estados Unidos (FDA) está avaliando a segurança e eficácia para concessão de autorização de comercialização das vacinas. O artigo sugere aprimoramentos para a autorização emergencial da vacina pelo FDA e ressalta que os reguladores devem se empenhar em garantir que os medicamentos e vacinas que salvam vidas cheguem ao público o mais rápido possível. Mas também devem garantir que esses esforços não prejudiquem a segurança pública ou a confiança nas instituições reguladoras (31/08/2020). Fonte: JAMA (editorial)
Menos de 10 dos cerca de 170 projetos de vacinas contra o SARS-CoV-2, o vírus que causa a COVID-19, estão na fase 3 de seus testes. Assim, os governos estão sob pressão para garantir o abastecimento de suas populações daquelas vacinas que tiverem sucesso. Segundo a OMS, se os governos competirem, a maioria dos países pode ficar de fora. Em meio a essa disputa, pelo menos 165 países manifestaram interesse em fazer parte de uma coalizão que visa garantir o acesso igualitário a uma vacina que funcione. A iniciativa foi batizada de Covax. Dos 165 países, pelo menos 75 já se apresentaram como financiadores para desenvolver um "portfólio" de vacinas com as melhores chances de sucesso. Essas nações concordaram em compartilhar o possível sucesso de uma ou mais dessas vacinas com 90 outros países com menos possibilidades econômicas ou sistemas de saúde mais fracos. No total, 60% da população mundial teria acesso à vacinação. Argentina, Brasil e México estão entre os países latino-americanos que se manifestaram a favor da aliança Covax. No entanto, grandes economias como Estados Unidos, China, União Europeia e Rússia indicaram que não farão parte da coalizão por enquanto (01/09/2020). Fonte: BBC
01/09/2020
UFRJ investe em pesquisa para ter a vacina brasileira contra a COVID-19. A nova plataforma combina a forma mais antiga e reconhecidamente eficiente de imunização (vírus vivos atenuados), a mecanismos de segurança gerados por engenharia genética (Crispr/Cas). Assim, a essência da vacina está na criação de uma cepa (variante) do SARS-CoV-2 atenuada. Os pesquisadores consideram que, a vacina atenuada, por conter o vírus inteiro, estimularia a resposta imune mais completa e, possivelmente, mais robusta e prolongada. Foi observado que em relação às vacinas de uso veterinário contra o coronavirus, as únicas eficientes são com vírus atenuado (30/08/2020). Fonte: O Globo
Uma vacina em desenvolvimento na Coppe/UFRJ tem como base a proteína S do SARS-CoV-2 sintetizada em células humanas. A proteína recombinante produzida em células humanas tem maior semelhança estrutural com a do próprio coronavírus, o que ajudaria a treinar melhor o organismo a reconhecer e atacar o vírus (a maior parte das vacinas contra a COVID-19 em estudo no mundo se baseia em proteínas recombinantes, produzidas artificialmente, com genes clonados). O imunizante em desenvolvimento combina a proteína S com moléculas adjuvantes. Camundongos vacinados pelo imunizante da UFRJ produziram anticorpos neutralizantes e resposta celular protetoras (30/08/2020). Fonte: O Globo
Pesquisadores revisaram as intervenções terapêuticas e vacinas para COVID-19 com base no conhecimento e compreensão existentes de coronavírus semelhantes, incluindo MERS-CoV e SARS-CoV. As informações constituem uma base intelectual fundamental para sustentar pesquisas em andamento para a descoberta de vacinas e agentes terapêuticos. Esta revisão representa as fronteiras mais disponíveis nas abordagens de desenvolvimento de vacinas virais para combater o SARS-CoV-2 (26/08/2020). Fonte: Human Vaccines & Immunotherapeutics

31/08/2020
O ministro da Saúde russo, Mikhail Murashko, anunciou nesta segunda-feira (31) que a entrega do primeiro lote da vacina contra a Covid-19 "Sputnik V", aprovada pelo país este mês, está prevista para setembro. Os testes de fase 3 da vacina contra o novo coronavírus, com 40 mil voluntários, têm previsão de começar nesta semana, segundo o cronograma publicado on-line. Nesta etapa, a eficácia e a segurança de uma imunização são testadas em larga escala (31/08/2020).. Fonte: G1
Os EUA são o país mais atingido no mundo pela pandemia em valores absolutos, por isso o chefe da Agência americana de medicamentos (FDA), Stephen Hahn, anunciou que uma vacina poderia ser autorizada nos Estados Unidos de acordo com um protocolo de urgência (31/08/2020). Fonte: G1
Artigo compara os ensaios clinicos individuais das vacinas versus um ensaio global multivacinas com um grupo controle compartilhado que segundo os autores poderia fornecer resultados mais rápidos e confiáveis. Os autores citam que o uso contínuo da infraestrutura de ensaios clínicos multivacinas pode economizar tempo e esforço, acelerando a descoberta necessária de várias vacinas seguras e eficazes. Altas taxas de inscrição facilitadas por um desenho de ensaio flexível e centenas de locais de estudo em locais de alta incidência podem produzir resultados sobre a eficácia de curto prazo para cada vacina em apenas alguns meses após sua inclusão. O ensaio clinico da Solidarity Vaccines Trial gerenciado pela OMS visa avaliar de forma eficiente e rápida (dentro de 3-6 meses após a introdução de cada vacina no estudo) a eficácia de várias vacinas, ajudando a garantir que vacinas pouco eficazes não sejam distribuídas (27/08/2020). Fonte: The Lancet
28/08/2020
Instituto Butantan prevê que seja possível fornecer 45 milhões de doses da vacina CoronaVac ao SUS (Sistema Único de Saúde) até dezembro deste ano. O Butantan, que é um órgão do governo do estado de São Paulo, desenvolve e testa a vacina contra o SARS-CoV2 em parceria com um laboratório chinês. – (28/08/2020). Fonte: UOL Notícias.
Revisão sistemática, com base em 50 estudos atuais selecionados das principais bases de dados de ensaios clínicos, resume a corrida global para o desenvolvimento de vacinas contra COVID-19. Para cada estudo, são destacadas as principais características da intervenção, o desenho utilizado e as parcerias de centros locais ou globais criadas. A maioria dos desenvolvimentos de vacinas ocorreu na Ásia, usando um método de vetor viral. Duas vacinas candidatas purificadas de SARS-CoV-2 inativadas, uma vacina baseada em mRNA mRNA1273 e a vacina adenoviral de chimpanzé ChAdOx1 estão atualmente em ensaios clínicos de fase III nos respectivos países Brasil, Emirados Árabes Unidos, EUA e Reino Unido (25/08/2020). Fonte: Vaccines
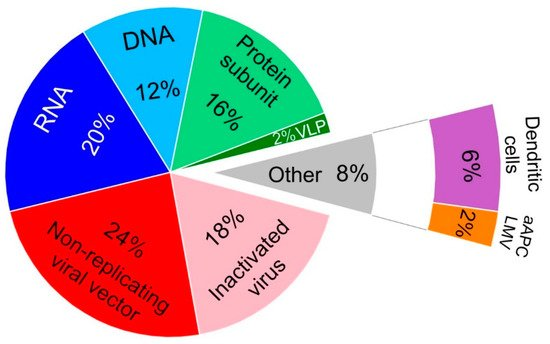
27/08/2020
O presente estudo tem como objetivo avaliar se as vacinas contra gripe e pneumocócicas estão associadas a testes positivos de swab nasofaríngeo (NPS) para detectar SARS-CoV-2. Foram considerados dados da pesquisa transversal EPICOVID19, com base em uma amostra de autoseleção de indivíduos com idade ≥18 anos. A probabilidade de um teste de NPS SARS-CoV-2 positivo em função da gripe ou da vacinação anti-pneumocócica foi avaliada por meio de regressão logística multivariável, estratificando a análise por idade. Como resultados, observou-se que as vacinas anti-pneumocócicas e de influenza estiveram associadas à diminuição da probabilidade de um teste positivo SARS-CoV-2 NPS nos participantes mais jovens. Uma probabilidade significativamente menor de um resultado positivo foi detectada nos indivíduos ≥65 anos que receberam vacinação anti-pneumocócica. Esses resultados precisam ser confirmados por investigações posteriores, mas são relevantes dada a provável coexistência da gripe, infecções bacterianas e COVID-19 (23/08/2020). Vaccines
Artigo discute a disputa desigual por vacinas contra o coronavírus no mundo. Os países ricos já encomendaram mais de dois bilhões de doses, enquanto que um esforço internacional para adquirir vacinas para países de baixa e média renda está lutando para ganhar força (24/08/2020). Fonte: Nature
26/08/2020
Pesquisadores resumem diferentes abordagens usando a proteína S para gerar uma vacina, terapêutica ou anticorpos neutralizantes direcionados ao SARS-CoV-2. Vários anticorpos neutralizantes que agem contra SARS-CoV ou MERS-CoV foram detectados, mas com sucesso limitado. Muitos dos anticorpos neutralizantes ou vacinas já identificados causam antibody-dependent enhancement (ADE) ou doença intensificada por vacina. Há uma preocupação crescente sobre o efeito ADE por anticorpos subótimos gerados pela vacina em desenvolvimento contra SARS-CoV-2. Por causa desses riscos, acredita-se ser crucial realizar ensaios clínicos em larga escala para avaliar a eficácia e segurança da vacina ou terapêutica antes de aprovar qualquer produto para uso generalizado. Também é essencial encontrar um anticorpo neutralizante que possa neutralizar diferentes cepas de vírus e não causar aumento induzido por anticorpos. O uso de nanocorpos é uma das opções que pode evitar com sucesso o efeito ADE. Desenvolvimento, testes e ensaios clínicos estão em andamento com foco na identificação de um medicamento / vacina em potencial para prevenir ou tratar a doença associada ao SARS-CoV-2 (23/08/2020). Fonte: Virus Research
A Farmacêutica Moderna testou sua vacina em dez adultos com idades entre 56 e 70 anos e em dez adultos com 71 anos ou mais, e descobriu que os voluntários mais velhos desenvolveram anticorpos de maneira semelhante aos voluntários mais jovens. A farmacêutica ainda disse que a vacina foi bem tolerada, sem relatos de efeitos colaterais graves. Os dados foram anunciados durante um comitê de especialistas externos para aconselhar os Centros de Controle e Prevenção de Doenças dos Estados Unidos sobre as práticas de vacinação (26/08/2020). Fonte: Forbes
24/08/2020
Vacina de RNA formulada em nanopartícula lipídica, BNT162b2, contra COVID-19 selecionada para estudo de Fase 2/3 de segurança e eficácia. Os dados provisórios de segurança e imunogenicidade da vacina BNT162b2 em adultos jovens foram previamente divulgados a partir de testes nos EUA e na Alemanha. Agora são apresentados dados adicionais de segurança e imunogenicidade do estudo de Fase 1 dos EUA que apoiou a seleção da vacina candidata para a avaliação em fase mais avançada. Tanto em adultos jovens quanto mais velhos, vacinas candidatas desencadearam respostas imunológicas satisfatórias, com a BNT162b2 associada a menos reatogenicidade sistêmica, principalmente em idosos (20/08/2020). Fonte: MedRxiv
Cuba começa hoje testes em humanos da sua vacina contra coronavirus, a SOBERANA 01, cerca de 700 pessoas serão voluntárias na etapa inicial. Se todas as fases de testes forem concluídas e se sua segurança e eficiência puderem ser provadas, essa pode ser a primeira vacina contra o coronavírus desenvolvida na América Latina (24/08/2020). Fonte: Época
A Itália iniciou testes de uma candidata a vacina contra COVID-19 em humanos nesta segunda-feira, juntando-se a um esforço global em busca de uma reação ao vírus, que deu sinais de estar ressurgindo na Europa. A vacina em potencial, chamada GRAd-COV2, foi desenvolvida pela ReiThera, e será testada inicialmente em 90 voluntários (24/08/2020). Fonte: UOL Noticias
21/08/2020
Portal interativo que congrega informações sobre vacinas nas diferentes fases de desenvolvimento: pesquisa pré-clínica, clínica e fase de mercado. As vacinas são divididas também pelas diferentes plataformas de desenvolvimento, com apresentação dos atores envolvidos e países onde a tecnologia está sendo avaliada (21/08/2020). Fonte: NYT
Pesquisadores criaram uma vacina candidata, baseada em adenovírus, codificando a proteína S de SARS-CoV-2, que o vírus usa para invadir células e testaram a vacina a camundongos bioengenheirados que tinham receptores humanos para a proteína. Depois de serem injetados com a vacina e expostos ao SARS-CoV-2, os camundongos não mostraram nenhum vírus infeccioso em seus pulmões — apesar de seus pulmões abrigarem pequenas quantidades de RNA viral. Em contrapartida, os camundongos que tinham a vacina inserida no nariz antes da exposição não tinham RNA viral mensurável em seus pulmões. Esta e outras evidências sugerem que a vacina ChAd-SARS-CoV-2 intranasal afastou totalmente a infecção (19/08/2020). Fonte: Cell
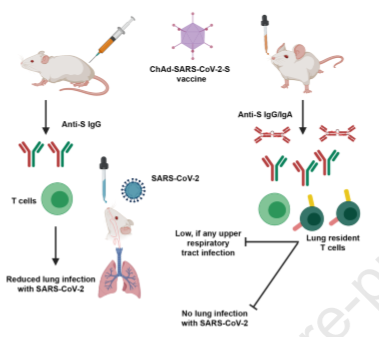
Estudo projeta três candidatas a vacina de mRNA para COVID-19 e verifica que elas codificam várias formas de antígenos em hospedeiros vacinados. A vacina RQ3011-RBD codifica o domínio de ligação ao receptor da glicoproteína S (resíduos 331–524) do SARS-CoV-2 com um peptídeo sinal N-terminal e uma hélice de ancoragem à membrana C-terminal. A vacina RQ3012-Spike codifica a proteína S de tipo selvagem completo, enquanto a vacina RQ3013-VLP é formulada a partir de um coquetel de mRNAs que codificam três proteínas estruturais: S, M (membrana) e E (envelope) para formar o vírus SARS-CoV-2 e partículas semelhantes (VLPs). Para aumentar a capacidade de expressão das vacinas de mRNA, todos os mRNAs foram submetidos a um procedimento de otimização de sequência em profundidade de dois parâmetros: códons no molde de DNA e nucleotídeos modificados incorporados ao mRNA. Foi projetado dez sequências de codificação do gene S (3822 nucleotídeos de comprimento) com conteúdo de GC variável, mantendo o índice de adaptação de códon máximo. Para cada molde de DNA, foram testados seis espécies de mRNA com vários nucleotídeos modificados. Os candidatos a mRNA (total de 60) exibiram uma variação considerável em suas habilidades para expressar S em células HEK 293ª. Notavelmente, a incorporação de pseudouridina melhora consistentemente a expressão de S, independentemente da sequência de códons usada. Para M e E, que são proteínas relativamente pequenas, foi projetdo uma sequência otimizada por códons para cada uma e rastreada quanto à escolha ideal de nucleotídeos modificados. Os mRNAs finais em vacinas têm uma combinação ideal de códon e nucleotídeos modificados que fornecem a expressão mais robusta (17/08/2020). Fonte: Nature
Pesquisa do Datafolha divulgada no dia 15 de agosto revela que nove a cada 10 brasileiros querem se vacinar contra o SARS-CoV-2 assim que o produto estiver disponível. Neste cenário, três dos seis imunizantes em fase final de estudos já estão sendo testados no Brasil. A presente reportagem explica o mecanismo de cada um deles: a AZD 1222 (da AstraZeneca/Oxford e, caso aprovada, será produzida pela Fiocruz); a Coronavac (da Sinovac, em parceria com o Instituto Butantan) e a BNT162b2 (da coalizão de farmacêuticas Pfizer/ BioNTech/Fosun Pharma) (21/08/2020). Fonte: Galileu
20/08/2020
Estudo desenvolve uma série de candidatos a vacinas de DNA que expressam diferentes formas da proteína spike (S) do SARS-CoV-2 e avalia a proteção contra COVID-19 em 35 macacos rhesus. Os animais vacinados desenvolveram respostas imunes humorais e celulares, incluindo títulos de anticorpos neutralizantes em níveis comparáveis aos encontrados em humanos convalescentes e macacos infectados com SARS-CoV-2. Após a vacinação, todos os animais foram desafiados com SARS-CoV-2, e a vacina que codifica a proteína S completa resultou em reduções> 3,1 e> 3,7 log10 nas cargas virais medianas no lavado broncoalveolar e na mucosa nasal, respectivamente, em comparação com o controle. Os títulos de anticorpos neutralizantes induzidos pela vacina se correlacionaram com a eficácia protetora, sugerindo um correlato imunológico de proteção. Esses dados demonstram a proteção da vacina contra SARS-CoV-2 em primatas não humanos (14/08/2020). Fonte: Science.
19/08/2020
Artigo revela que a vacinação em dose única intranasal com um adenovírus tipo 5 humano não replicante que codifica a proteína spike do SARS-CoV-2 (Ad5-nCoV) protege camundongos completamente contra infecção por SARS-CoV-2. Além disso, uma única vacinação com Ad5-nCoV protege os furões da infecção por SARS-CoV-2 do tipo selvagem no trato respiratório superior. Foi verificada forte resposta humoral e celular. Este estudo sugere que a vacinação da mucosa pode fornecer uma eficácia protetora desejável e este modo de entrega vale a pena investigações adicionais em ensaios clínicos humanos (14/08/2020). Fonte: Nature Communications
18/08/2020
Anvisa autoriza testes para nova vacina da Johnson & Johnson. A anuência ao quarto estudo clínico de vacina relacionado à pandemia foi publicada no Diário Oficial da União (DOU) desta terça-feira (18/8). Estudo pode incluir até 60 mil voluntários, sendo 7 mil no Brasil, distribuídos nos estados de São Paulo, Rio Grande do Sul, Rio de Janeiro, Paraná, Minas Gerais, Bahia e Rio Grande do Norte. Este é o quarto estudo de vacina contra o novo coronavírus autorizado pela Anvisa no Brasil. A potencial vacina da Jansen-Cilag, denominada Ad26.COV2.S, é composta de um vetor recombinante, não replicante, de adenovírus tipo 26 (Ad26), construído para codificar a proteína S (Spike) do vírus Sars-CoV-2 (o novo coronavírus). O ensaio clínico aprovado é um estudo de fase 3, randomizado, duplo cego, controlado por placebo, para avaliar a eficácia e a segurança de Ad26.COV2.S na prevenção de COVID-19 (18/08/2020). Fonte: Agencia Brasil
17/08/2020
Revisão demonstra a contribuição do sistema imunológico (inato e adaptativo) durante a infecção e o controle do vírus SARS-CoV-2 destacando que o desenvolvimento de vacinas está associado a modulação do sistema imunológico (06/08/2020). Fonte: Vaccines

Artigo aponta os riscos da aprovação precoce da vacina da Gamaleya pela da Rússia. Pesquisadores afirmam que imunização, que é a primeira aprovada para uso generalizado, pode ser perigosa porque não foi testada em grandes ensaios clínicos, (11/08/2020). Fonte: Nature (Lond.)
Pesquisadores apresentam análise de 2 ensaios clínicos randomizados controlados por placebo (fase 1 e 2). O ensaio de fase 1 foi realizado em 96 adultos saudáveis randomizados para hidróxido de alumínio (alúmen) sozinho (placebo) e doses de vacina baixas, médias e altas nos dias 0, 28 e 56. Os títulos médios de anticorpos neutralizantes no dia 14 após a terceira injeção foram 316, 206 e 297 nos grupos de dose baixa, média e alta, respectivamente. A fase 2 dos testes clínicos incluiu 224 adultos saudáveis randomizados para a dose média, reações adversas de 7 dias ocorreram em 6,0% e 14,3% dos participantes que receberam injeções nos dias 0 e 14 vs alúmen apenas, e 19,0% e 17,9% que receberam injeções nos dias 0 e 21 vs alúmen apenas, respectivamente; os títulos médios de anticorpos neutralizantes nos grupos de vacina no dia 14 após a segunda injeção foram de 121 vs 247, respectivamente. Esta vacina COVID-19 inativada teve uma baixa taxa de reações adversas e demonstrou imunogenicidade, mas a avaliação de segurança e eficácia em longo prazo exigirá ensaios de fase 3 (13/08/2020). Fonte: JAMA.
Artigo demonstra que a imunização intranasal com a vacina ChAd-SARS-CoV-2-S, com base em um adenovírus de chimpanzé, confere proteção contra o SARS-CoV-2 em camundongos projetados para expressar ECA2 humana. A administração intramuscular de ChAd-SARS-CoV-2-S protegeu contra a patologia pulmonar, mas não eliminou a infecção do trato respiratório superior após o desafio com SARS-CoV-2. No entanto, quando administrado por via intranasal, induziu anticorpos neutralizantes locais e respostas de células T que forneceram proteção superior para o trato respiratório superior e inferior, sem sinais de replicação viral 8 dias após o desafio viral. A presença de células T de memória residentes em tecidos no pulmão sugere proteção de longa duração. Este trabalho ilustra a importância da rota de entrega para a efetividade da vacina (17/08/2020). Fonte: BioRxiv
USP avança em pesquisa e vacina em spray da COVID-19 pode chegar em 2021. A vacina é mais fácil de ser aplicada, tem custo menor e pode impedir que o Brasil se torne dependente de empresas estrangeiras. Nos últimos testes, os resultados da fórmula da desenvolvida pela USP em parceria com o Instituto do Coração (InCor) foram positivos. Por enquanto, a vacina brasileira ainda está na fase de testagem pré-clínica. Isso significa que os testes das fases 1 e 2 ainda não começaram. A primeira fase de avaliações clínicas deve ser iniciada até o fim de novembro (14/08/2020). Fonte: Exame
China concede primeira patente de vacina contra COVID-19 para CanSino. Candidata é uma das principais entre as tentativas chinesas de encontrar uma vacina para a Covid-19; testes de fase 3 no exterior, inclusive no Brasil, estão sendo discutidos. A vacina da CanSino usa um vírus do resfriado comum, o adenovírus tipo 5 (Ad5), para transportar o material genético do coronavírus para o corpo. Os testes clínicos de fase 1 e 2 demonstraram que a vacina é segura e induz resposta imune (17/08/2020). Fonte: G1
13/08/2020
Nesta revisão, pesquisadores descrevem as vacinas contra a COVID-19 que atualmente são testadas em ensaios clínicos e fornecem uma visão aprofundada dos vários tipos de vacinas, suas composições, vantagens e limitações potenciais. Também são abordados os desafios na distribuição e administração da vacina, que podem ser atenuados pela aplicação de estratégias de estabilização da vacina e o uso de vias de administração não invasivas e indutoras de resposta imunológica da mucosa específica (05/08/2020). Fonte: AAPPS Pharm Sci Tech
Reportagem aborda os diferentes questionamentos realizados pela comunidade científica sobre a vacina russa para o coronavírus, baseada em vetor de adenovírus, desenvolvida pelo Instituto Gamaleyia e o Ministério da Defesa (13/08/2020). Fonte: G1
Pesquisadores desenvolveram um vírus de estomatite vesicular competente para replicação (VSV) que expressa uma forma modificada do gene da proteína S do SARS-CoV-2 no lugar do gene da sua glicoproteína nativa (VSV-eGFP-SARS-CoV-2). Estudo demonstrou que a vacinação com VSV-eGFP-SARS-CoV-2 gera respostas imunes neutralizantes e protege camundongos contra SARS-CoV-2. A imunização de camundongos com VSV-eGFP-SARS-CoV-2 induz altos títulos de anticorpos que neutralizam o SARS-CoV-2 e direcionam o domínio de ligação ao receptor que envolve a enzima conversora de angiotensina humana-2 (ECA2). Após o desafio com um isolado humano de SARS-CoV-2, os camundongos que expressam ECA2 humano e imunizados com VSV-eGFP-SARS-CoV-2 mostram infecção viral e inflamação profundamente reduzidas no pulmão, indicando proteção contra pneumonia. A transferência passiva de soros de animais imunizados com VSV-eGFP-SARS-CoV-2 também protege os camundongos do desafio com SARS-CoV-2. Esses dados apoiam o desenvolvimento de VSV-eGFP-SARS-CoV-2 como uma vacina atenuada e competente para replicação contra SARS-CoV-2 (30/07/2020). Fonte: Cell Host & Microbe
12/08/2020
Estruturas de nível atômico direcionaram a aplicação de mutações estabilizadoras de pré-fusão que melhoraram a expressão e imunogenicidade da proteína S do SARS-CoV-2. Com base neste conhecimento, a revelação de sequências de SARS-CoV-2 levou à imediata obtenção de uma vacina de mRNA que expressa o trímero da proteína S de SARS-CoV-2 pré-fusão estabilizada (mRNA-1273). O estudo demonstra que o mRNA-1273 induz as respostas de anticorpos neutralizantes potentes para o tipo selvagem (D614) e as respostas das células T CD8 e SARS-CoV-2 mutantes D614G2 e protege contra a infecção por SARS-CoV-2 nos pulmões e nariz de camundongos sem evidência de imunopatologia. O mRNA-1273 está atualmente em avaliação de eficácia de Fase 3. (05/08/2020). Fonte: Nature
Artigo apresenta os resultados dos testes clínicos de fase I e II da vacina para COVID-19 da BioNTech e Pfizer, que induziu uma resposta imune robusta e não gerou efeitos colaterais graves nos 45 voluntários adultos. A vacina, BNT162b1, é constituída de mRNA modificado que codifica o RDB da glicoproteina spike trimerizada de SARS-CoV-2, formulada em nanopartículas lipídicas. Os níveis de anticorpos neutralizantes dos participantes foram de 1,9 a 4,6 vezes maiores do que os de pacientes em recuperação da COVID-19 (12/08/2020). Fonte: Nature
O objetivo do estudo era compreender melhor a biologia da infecção e a resposta imune contra o vírus na população brasileira, foi analisado os peptídeos da proteína S do SARS-CoV-2 a fim de identificar epítopos capazes de desencadear uma resposta imune mediada pelo MHC-I e os mais frequentes alelos usando em métodos in silico. Cientes das limitações intrínsecas da análise in silico (principalmente as diferenças entre a estrutura real e o Protein Data Bank (PDB); e a precisão dos métodos para simular a clivagem do proteassoma), foi identificado 24 epítopos capazes de interagir com 17 alelos MHC-I mais frequentes na população brasileira que podem ser úteis para o desenvolvimento de métodos estratégicos de vacinas contra a SARS-CoV-2 (05/08/2020). Fonte: Journal Clinical Pathology
11/08/2020
Estudo caracterizou a imunidade de células T folicular circulantes (cTFH) contra a proteína S em pacientes recuperados da COVID-19. Foi descoberto que anticorpos específicos para proteina S, células B de memória e cTFH são consistentemente provocados após a infecção pelo SARS-CoV-2, demarcando imunidade humoral robusta e positivamente associada à atividade neutralizante do plasma. Comparativamente baixas frequências de células B ou cTFH específicas para o RDB da proteína S foram provocadas. Notavelmente, o fenótipo de S-específico cTFH diferenciava pacientes com respostas neutralizantes potentes, fornecendo um potencial biomarcador de potência para vacinas baseadas na proteina S. No geral, embora os pacientes que se recuperaram do COVID-19 tenham apresentado múltiplas marcas de reconhecimento imunológico eficaz da proteína S, o amplo espectro de atividade neutralizante observado sugere que as vacinas podem exigir estratégias para atingir seletivamente os epítopos neutralizantes mais potentes (13/07/2020). Fonte: Nature Medicine
Revisão apresenta a estrutura do coronavírus e as diferentes estratégias de desenvolvimento de vacinas para COVID-19. São resumidos também os dados sobre interações de receptores celulares e dados sobre perspectivas de novas vacinas voltadas para o ácido desoxiribonucleico (DNA), ácido ribonucleico mensageiro (mRNA) e minigenes virais. São tabulados os dados disponíveis dos vários ensaios clínicos em andamento testando diferentes aspectos das vacinas COVID-19(27/06/2020). Fonte: Cureus
Revisão discute o longo caminho rumo à imunidade de rebanho frente a COVID-19, as diferentes plataformas tecnológicas de vacinas e estratégias de imunização em massa. Autores discorrem ainda sobre a estrutura, genética e replicação do vírus, modo de transmissão e características clínicas da doença, imunopatologia e resposta imunológica do hospedeiro e modelos animais (21/07/2020). Fonte: Frontiers Immunology.
O Ministério da Saúde da Rússia concedeu aprovação regulatória para a primeira vacina COVID-19 do mundo após menos de dois meses de testes em humanos. A vacina, desenvolvida pelo Instituto Gamaleya de Moscou, se mostrou eficiente durante os testes e promete oferecer "imunidade sustentável" contra o coronavírus, segundo informações governamentais (11/08/2020). DW
O governo do Paraná anunciou que vai assinar um convênio com a Rússia para produzir a vacina Sputnik V. O Instituto de Tecnologia do Paraná (Tecpar) será responsável por todas as etapas, desde a pesquisa até a distribuição das doses da vacina russa. Previsão é que distribuição no Brasil não comece antes do segundo semestre de 2021. A Anvisa ainda precisa liberar realização dos procedimentos necessários para os testes (11/08/2020). Fonte: G1
10/08/2020
A vacinação com Bacillus Calmette-Guérin (BCG) pode reduzir o risco de uma série de doenças infecciosas e, se assim for, pode proteger contra a COVID-19. Neste estudo, os pesquisadores comparam países que exigiam a vacinação BCG até pelo menos o ano 2000 com países que não o faziam. Para minimizar quaisquer efeitos sistemáticos de vieses de notificação, analisaram a taxa de aumento diário em casos confirmados (134 países) e mortes (135 países) no primeiro período de 30 dias de surtos por país. A janela de 30 dias foi ajustada para começar no início da pandemia no país. Modelos lineares mistos revelaram um efeito significativo das políticas obrigatórias de BCG na taxa de crescimento de casos e mortes após o controle da idade média, produto interno bruto per capita, densidade populacional, tamanho da população, taxa de migração líquida e várias dimensões culturais. A análise sugere que a vacinação BCG obrigatória pode ser eficaz na luta contra COVID-19 (05/08/2020). Fonte: Science Advances
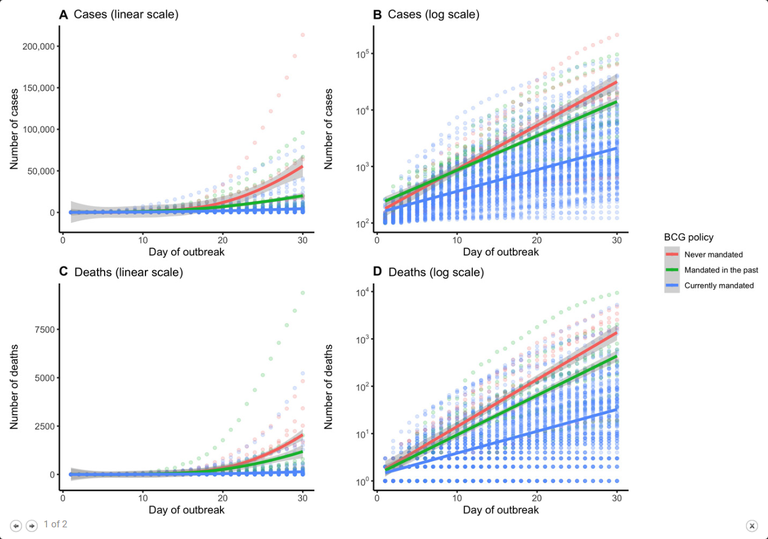
Pesquisadores afirmam que o número de mortes registradas por COVID-19 no Brasil poderia ser 14 vezes maior do que o atual se a vacina contra o bacilo Calmette-Guérin (BCG), que causa a tuberculose, não fosse obrigatória no País. A conclusão é de um estudo da Universidade de Michigan, nos Estados Unidos, publicado na Science. Nesta reportagem, o principal autor do estudo foi entrevistado e esclareceu vários pontos sobre a BCG e a COVID-19 (10/08/2020). Fonte: Estadão
Vacinas para muitos patógenos foram desenvolvidas com base na exposição de epítopos nas regiões variáveis do adenovírus humano (HAdV). Através do perfil imunoinformático das principais proteínas capsidicas de HAdVs de diferentes espécies, desenvolvemos um conceito modular que pode ser usado no desenvolvimento de bases de vacinas de vetores HAdV. Os dados sugerem que diferentes potenciais imunomodulatórios podem ser observados nas regiões conservadas, presentes nas proteínas hexon e penton do HAdV de diferentes espécies. Usando uma abordagem modular, foi desenvolvida uma estratégia de vacina baseada em HAdV-5 para SARS-CoV-2, construída através da exibição de epítopos SARS-CoV-2 selecionados na análise de previsão como imunologicamente relevantes. As sequências do vetor HAdV também foram editadas para melhorar a indução do IFN-gama e a ativação de células de apresentação de antígenos. Este estudo propõe uma plataforma modular HAdV desenvolvida para auxiliar o design de novas vacinas, induzindo uma resposta imune mais adequada para os epítopos em exposição(03/08/2020). Fonte: Infection, Genetics and Evolution
07/08/2020
A glicoproteína S promove a fixação do SARS-CoV-2 à superfície da célula hospedeira e a fusão das membranas viral e hospedeira e é o principal alvo dos anticorpos neutralizantes, sendo foco do design de vacinas. No entanto, sua estabilidade e dinâmica conformacional são fatores limitantes para o desenvolvimento de contramedidas contra esse vírus. Artigo relata um projeto de construção correspondente ao trímero do ectodomínio da proteína S de SARS-CoV-2 pré-fusão, covalentemente estabilizado por uma ligação dissulfeto na conformação fechada. Análises estruturais e de antigenicidade mostraram que a proteína S foi mantida com sucesso no estado fechado sem alteração da sua arquitetura. Os autores demonstraram que essa estratégia é aplicável a outros β-coronavírus, como SARS-CoV e MERS-CoV, e pode se tornar uma ferramenta importante para estudos de biologia estrutural, sorologia, desenho de vacinas e imunologia (04/08/2020). Fonte: Nature
Estudo explora a proteína S de SARS-CoV-2 para potenciais epítopos imunogênicos para projetar construtos de vacinas multi-epítopo. Foram analisados os domínios S1 e S2 da proteína S, e dois construtos de vacinas foram priorizados com epítopos de células T e células B. Os epítopos priorizados foram então modelados por meio de linkers e adjuvantes, e os respectivos modelos 3D foram construídos para avaliar suas propriedades fisioquímicas e suas possíveis interações com ECA2, alelos da superfamília de HLA, e os receptores toll-like TLR2 e TLR4. A cobertura populacional dos epítopos foi determinada utilizando-se a ferramenta IEDB e todos os epítopos apresentaram uma pontuação de cobertura média de classe I e classe 2 combinada de 94% da população mundial (10/07/2020). Fonte: Frontiers in Immunology
Pesquisadores elaboram a hipótese de considerar o vírus da doença de Newcastle (NDV), um vírus aviário, como um vetor de vacina para SARS-CoV-2. Segundo os autores, estudos anteriores de outros coronavírus patogênicos de humanos (SARS e MERS) indicaram o potencial do NDV como vetor de vacina e existem dados excelentes sobre a segurança do NDV em humanos e também definem os correlatos e a durabilidade da proteção (29/07/2020). Fonte: Pathogens
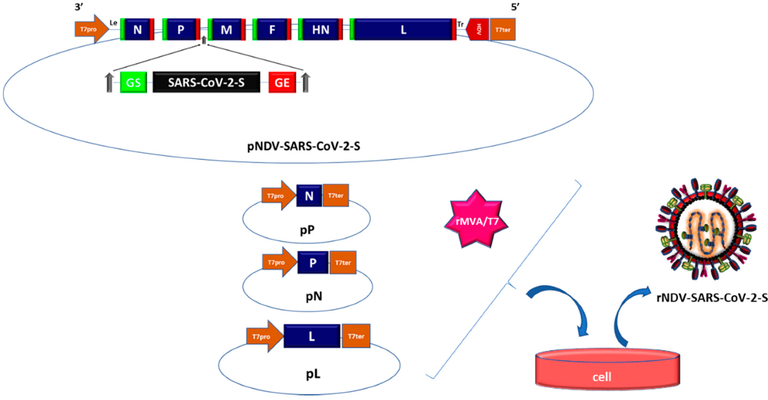
06/08/2020
Estudo utilizou métodos de bioinformática para prever os epítopos protetores para o desenvolvimento de novas vacinas. Um total de 63 epítopos sequenciais de células B na proteína S foram previstos e 4 peptídeos exibiram alta pontuação de antigenicidade e boa acessibilidade superficial. A análise por bioinformática dos peptídeos de ligação à HLA na proteína N produziram 81 e 64 peptídeos que podem ligar moléculas MHC classe I e MHC classe II, Dois peptídeos foram previstos se ligar a um amplo espectro de moléculas HLA-1 e HLA-2. Os Epitotopos identificados e recomendados para o desenvolvimento de uma vacina protetora contra SARS-CoV-2 (10/07/2020). Fonte: Infectious Diseases of Poverty
Os autores apontam que estudos sugeriram menos morbidades e mortalidade por COVID-19 em países vacinados com Bacillus Calmette – Guérin (BCG) do que em países não vacinados com BCG. Esses estudos obtiveram dados durante a fase inicial da pandemia e não se ajustaram a possíveis fatores de confusão, incluindo números de testes de PCR por população (testes de PCR). Mais de quatro meses após a declaração da pandemia os autores realizaram um estudo através da obtenção de dados de 61 fatores em 173 países, incluindo a cobertura da vacina BCG. A cobertura recente da vacina BCG foi associada negativamente à mortalidade, mas não à morbidade, mesmo com ajuste para porcentagem da população ≥ 60 anos, morbidade, testes de PCR e outros fatores. Os resultados deste estudo geraram a hipótese de que um programa nacional de vacinação com BCG parece estar associado à mortalidade reduzida de COVID-19 (04/07/2020). Fonte: International Journal of Environmental Research and Public Health
05/08/2020
Pesquisadores apresentam resultados sobre a imunogenicidade e a eficácia protetora de uma vacina de dose única baseada em vetores do sorotipo 26 do adenovírus (Ad26) que expressa a proteína spike (S) de SARS-CoV-2 em primatas não humanos. Cinquenta e dois Macacos rhesus foram imunizados com vetores Ad26 que codificam variantes S ou controle simulado e foram desafiados com SARS-CoV-2 pelas vias intranasal e intratraqueal. A vacina Ad26 induziu respostas robustas de anticorpos neutralizantes e forneceu proteção completa ou quase completa na lavagem broncoalveolar e nas swabs nasais após o desafio com SARS-CoV-2. Os títulos de anticorpos neutralizantes induzidos pela vacina correlacionaram-se com a eficácia protetora, sugerindo um correlato imune de proteção. Esses dados demonstram proteção robusta da vacina de dose única contra SARS-CoV-2 em primatas não humanos. A vacina baseada em vetor Ad26 para SARS-CoV-2, denominada Ad26.COV2.S, está atualmente sendo avaliada em ensaios clínicos (30/07/2020). Fonte: Nature
Um estudo pré-clínico publicado recentemente na Nature mostra que a vacina experimental da Johnson & Johnson (Ad26.COV2.S) mostrou dados iniciais positivos para provocar uma resposta imune contra o SARS-CoV-2, o vírus que causa o COVID-19. Compartilhamos mais sobre as descobertas do recente estudo pré-clínico, além de outras informações atualizadas sobre o potencial candidato a vacina (30/07/2020). Fonte: Johnson & Johnson
Artigo discute as limitações potenciais do desenvolvimento de vacina para o SARS-CoV-2 baseada na predição (in silico) de epítopos de células T. Entre outras questões, o artigo relata que os algoritmos de previsão de epítopos de células T são uma ferramenta eficaz, no entanto, abordagens exclusivamente baseadas na previsão de epítopos de 9-mer potencialmente perderão respostas criticamente importantes, visto que o comprimento dos epítopos é altamente variável e não é adequadamente capturado por algoritmos de previsão (04/06/2020) PLOS Pathogens.
Vacina chinesa, desenvolvida pelo laboratório Sinovac Biotech contra o novo coronavírus, começará a ser testada em Brasília nesta quarta-feira (5/8) pela Universidade de Brasília (UnB) e pelo Hospital Universitário de Brasília (HUB). Os primeiros a participar do estudo-teste são profissionais da saúde que atuam no atendimento de infectados e não tiveram ainda a doença. A vacina que eles receberão é inativada e será aplicada em duas doses, com intervalo de 14 dias. Serão acompanhados 850 voluntários. O HUB é um dos 12 centros no Brasil que participam da fase 3 do ensaio clínico nacional, coordenado pelo Instituto Butantan (01/08/2020). Fonte: Metropoles
Para avaliar o efeito das imunizações históricas e atuais com BCG foram comparados os números notificados de casos e óbitos de COVID-19 para 18 países (14 na Europa Ocidental, mais Austrália, Brasil, Israel e EUA). Tendo em vista a alta taxa de mortalidade de pacientes com mais de 70 anos de idade, e dado o fato de que a vacinação BCG é tipicamente dada no início da vida, comparamos países que introduziram a BCG na década de 1950 com aqueles que não tinham. Nenhum efeito sobre a taxa de letalidade de casos COVID-19 ou número de mortes por população pôde ser demonstrado. Uma vez que alguns países testam para COVID-19 mais do que outros, o efeito dos testes realizados por milhão de população em óbitos relatados por milhão também foi avaliado, mas não demonstrou um efeito da vacinação BCG na década de 1950. O estudo conclui que atualmente não há evidências para um efeito benéfico da vacinação BCG em casos ou fatalidades relatadas pelo COVID-19 (30/07/2020). Fonte: Letters in Applied Microbiology
04/08/2020
Novavax apresenta resultados da fase 1, ensaio randomizado, controlado por placebo de sua vacina para a COVID-19 com e sem adjuvante Matrix-M™ em adultos saudáveis de 18 a 59 anos de idade. A vacina candidata recombinante, NVX-CoV2373, foi geralmente bem tolerada e provocou respostas robustas de anticorpos numericamente superiores às encontradas em soro convalescente humano (04/08/2020). Fonte: Novavax
O artigo mostra que a vacina ChAdOx1 nCoV-19, vetorizada por adenovírus, que codifica a proteína spike de SARS-CoV-2, é imunogênica em camundongos, provocando uma resposta humoral e mediada por células robusta. Esta resposta foi predominantemente Th1, como demonstrado pela subclasse de IgG e perfil de expressão de citocinas. A vacinação com ChAdOx1 nCoV-19 induziu uma resposta imune humoral e celular Th1 / Th2 equilibrada em Macacos rhesus. Observou-se uma carga viral significativamente reduzida no líquido de lavagem broncoalveolar e no tecido do trato respiratório inferior de Macacos rhesus vacinados desafiados com SARS-CoV-2 em comparação com animais controle, e nenhuma pneumonia foi observada em animais vacinados (30/07/2020). Fonte: Nature
Estudo aplica ferramentas de vacinologia reversa Vaxign e Vaxign-ML, baseadas em machine learning, para prever candidatos a vacinas contra COVID-19. A análise descobriu que a sequência da proteína N da SARS-CoV-2 é conservada com SARS-CoV e MERS-CoV. Ao investigar todo o proteoma de SARS-CoV-2, previu-se que seis proteínas, incluindo a proteína S e cinco proteínas não estruturais (nsp3, 3CL-pro e nsp8-10), são cruciais para a infecção viral, aderência e invasão do hospedeiro. Observou-se que as proteínas S, nsp3 e nsp8 induzem alta antigenicidade protetora. Ao contrário da proteína S, comumente usada, a proteína nsp3 não foi testada em nenhum estudo de vacina contra o coronavírus e foi selecionada para investigação adicional. Verificou-se que a nsp3 é mais conservada entre SARS-CoV-2, SARS-CoV e MERS-CoV do que entre os 15 coronavírus que infectam humanos e outros animais. A proteína também contém epítopos heterogêneos MHC-I e MHC-II de células T, e epítopos lineares previstos de células B estavam localizados na superfície da proteína. Os pesquisadores indicam que “vacina de coquetel Sp / Nsp” contendo proteína (s) estrutural (s) e proteína (s) não estrutural (s) (Nsp) estimularia respostas imunológicas complementares eficazes (10/07/2020). Fonte: Frontiers in Immunology
Pesquisadores estão desenvolvendo uma abordagem dupla para o avanço de vacinas recombinantes baseadas em proteínas para prevenir COVID-19 causado por SARS-CoV-2 e outras infecções por coronavírus. A vacina é baseada em uma proteína recombinante derivada de levedura (Pichia pastoris) composta pelo domínio de ligação ao receptor (RBD) do SARS-CoV formulado em alume e referido como vacina CoV RBD219-N1. Pesquisadores citam que potencialmente, esta vacina poderia ser usada como uma vacina heteróloga contra o COVID-19. Uma segunda vacina específica para COVID-19 também está sendo avançada usando o RBD correspondente de SARS-CoV-2. As evidências de sua potencial eficácia na proteção cruzada contra SARS-CoV-2 incluem estudos de neutralização cruzada e ligação usando anticorpos policlonais e monoclonais (29/07/2020). Fonte: Plos Neglected Tropical Diseases

Vacinas chinesas estão em fase avançada de desenvolvimento. Artigo discute os desafios das empresas chinesas para testar as vacinas em número suficiente de participantes e atingir o padrão de segurança e eficácia exigido pelas agências reguladoras internacionais (31/07/2020). Fonte: Nature. https://doi.org/10.1038/d41586-020-02244-1
03/08/2020
O SARS-CoV-2 usa seu domínio de ligação ao receptor de proteína Spike (S-RBD) para se ligar ao receptor da célula hospedeira (ECA2). Estudo apresenta uma vacina recombinante compreendendo os resíduos 319-545 do S-RBD capaz de induzir uma resposta potente de anticorpos funcionais em camundongos imunizados, coelhos e primatas não humanos (Macaca mulatta) entre 7 e 14 dias após uma injeção em dose única. Os soros dos animais imunizados bloquearam a ligação da RBD à ECA2 expressa na superfície celular e neutralizaram a infecção pelo pseudovírus SARS-CoV-2 e SARS-CoV-2 vivo in vitro. É importante ressaltar que a vacinação também forneceu proteção em primatas não humanos contra o desafio SARS-CoV-2 in vivo. Os anticorpos específicos para RBD elevados também foram encontrados nos soros de pacientes com COVID-19. Várias vias imunes e linfócitos T CD4 foram observados na indução da resposta de anticorpos da vacina. O artigo destaca a importância do domínio RBD no projeto da vacina SARS-CoV-2 e fornece a justificativa para o desenvolvimento de uma vacina protetora através da indução de anticorpo contra o domínio RBD (29/07/2020). Fonte: Nature
A pandemia de COVID-19 em andamento priorizou o desenvolvimento de modelos de pequenos animais para estudar SARS-CoV-2. Artigo apresenta adaptação de um isolado clínico de SARS-CoV-2 por passagem em série no trato respiratório de camundongos BALB/c idosos. A cepa resultante adaptada a camundongo na passagem 6 (denominada MASCp6) mostrou maior infectividade no pulmão de camundongo e levou a pneumonia intersticial e respostas inflamatórias em camundongos jovens e idosos após inoculação intranasal. Análise de sequenciamento revelou um painel de mutações adaptativas potencialmente associadas ao aumento da virulência. Em particular, a mutação N501Y está localizada no domínio de ligação ao receptor (RBD) da proteína spike. A eficácia protetora de uma candidata a vacina RBD recombinante foi validada usando este modelo. Assim, esta cepa adaptada a camundongos e o modelo de desafio associado devem ter valor na avaliação de vacinas e antivirais contra SARS-CoV-2. (30/07/2020) Fonte: Science
Os autores discutem o efeito protetor da vacinação com BCG, principalmente em pacientes com idade inferior a 38 anos. Apontam que o contato prévio com o Mycobacterium tuberculosis geram uma resposta inespecífica independente do agente infeccioso. Para determinar o mecanismo da imunidade gerada apontam vários estudos em camundongos e humanos em que a vacinação provoca uma reprogramação epigenética em macrófagos derivados de monócitos, com produção de citocinas como IFN-γ, TNF-α, IL- 1β, IL-10 e IL-12. E discutem os possíveis mecanismo envolvidos nos efeitos na COVID-19 (09/07/2020). Fonte: Frontiers in Pharmacology
30/07/2020
O número de óbitos da COVID-19 correlaciona-se inversamente com a taxa de vacinação Bacille Calmette-Guérin (BCG) em 61 países. O presente estudo sugere que a vacina BCG pode ser protetora contra a infecção por SARS-CoV-2 (16/07/2020) Pre proof. Fonte: Research Square
29/07/2020
Artigo discute como a pandemia da COVID-19 acelerou o desenvolvimento de plataformas de vacinas distintas das vacinas clássicas; essas novas plataformas também podem encurtar o tempo de resposta quando novos vírus surgirem no futuro. Seis meses após a descoberta do SARS-CoV-2, antivirais e vacinas estão em desenvolvimento, com muitas opções de tratamento e vacinas em ensaios clínicos em todo o mundo (23/07/2020). Fonte: Nature Materials
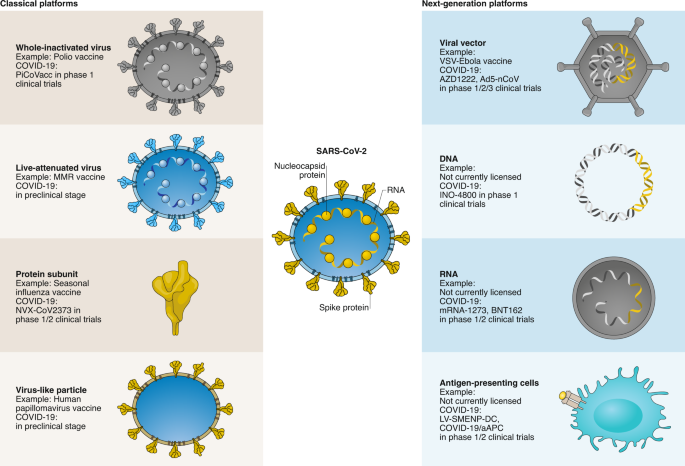
A empresa farmacêutica chinesa Sinopharm e o governo do Paraná esperam enviar dentro de 15 dias pedido à Agência Nacional de Vigilância Sanitária (Anvisa) para a realização do quarto teste de uma potencial vacina para COVID-19 no Brasil, após assinatura de acordo entre a estatal chinesa e o Estado do Paraná. O acordo prevê a transferência de tecnologia para a produção da vacina caso ela seja aprovada para uso. A vacina será a quarta a entrar em fase III de testes clínicos no Brasil (29/07/2020). Fonte: Extra
Rússia anuncia produção de vacina contra coronavírus para outubro, mesmo antes de teste em larga escala. No Brasil, ao menos dois estados já manifestaram interesse. Representante do governo estadual do Paraná esteve nesta semana com o embaixador russo para discutir uma possível parceria e ofereceu a estrutura do Instituto de Tecnologia do Paraná (Tecpar) para a produção. Os envolvidos ainda não chegaram a um acordo. Em São Paulo, o presidente do Instituto Butantan afirmou que o governo da Rússia procurou o governo de São Paulo para se associarem na produção da vacina (29/07/2020). Fonte: G1
28/07/2020
Considerando que a eficácia das vacinas à base de ácido nucleico de SARS-CoV-2 pode ser limitada pela proteólise do produto traduzido devido ao dobramento anômalo de proteínas, estudo identifica e analisa epítopos lineares do SARS-CoV-2 para estimular células B, com potencial para desenvolvimento de vacina. Autores identificaram 20 epítopos lineares das proteínas S, M e N que podem facilitar o desenvolvimento de produtos biomédicos para o SARS-CoV-2. Foram feitas análises filogenéticas para identificar possíveis variações que pudessem levar à falta de proteção frente as cepas da pandemia (20/07/2020). Fonte: Vaccines
27/07/2020
A farmacêutica Moderna anunciou nesta segunda-feira que, apoiada pelo governo dos Estados Unidos, sua vacina passará para a fase III, última fase de testes para avaliar os resultados contra COVID-19. Cerca de 30 mil voluntários adultos sem o novo coronavírus participarão inicialmente do estudo. Esta é a quinta vacina a entrar nos estágios avançados de testes (27/07/2020). Fonte: NIH
Estudo analisa os prós e contras das plataformas e opções de vacinas disponíveis para acelerar o desenvolvimento da vacina em direção à imunização segura da população mundial contra o SARS-CoV-2. Vacinas favoráveis, usadas em estratégias de vacinação bem como as projetadas, podem ser críticas para limitar os danos (22/07/2020). Fonte: Vaccines
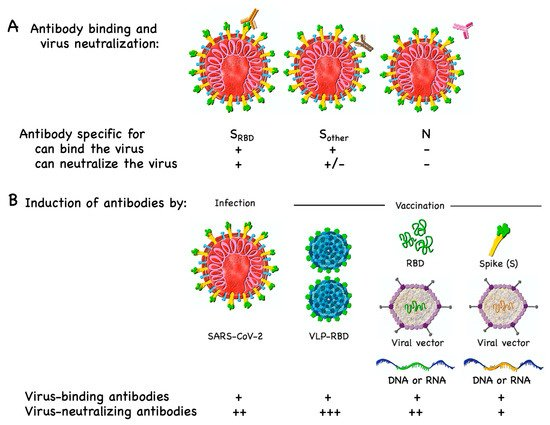
24/07/2020
Os autores comentam sobre o esforço para o desenvolvimento de vacinas, mostrando que na prática as primeiras a chegarem aos testes clínicos partiram de plataformas já existentes e da rápida adaptação de pesquisas direcionadas para outros vírus. Citam como exemplo a vacina da Moderna, baseada em RNA, que surgiu de uma adaptação das pesquisas direcionadas ao vírus Nipah, que também provoca Síndrome Respiratória. Eles apontam que as vacinas baseadas em RNA permitem uma rápida adaptação da pesquisa e produção. As outras plataformas de desenvolvimento também são abordadas no artigo (21/07/2020). Fonte: Nature
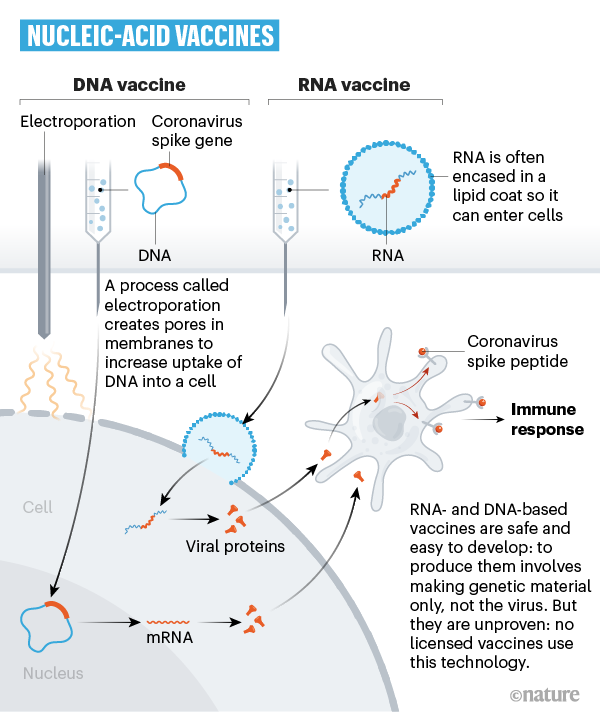
Revisão sobre a literatura (2003 até o presente) relacionada ao desenvolvimento de vacinas para coronavirus, principais antígenos e a resposta imunogênica. São discutidos os possíveis alvos, o cenário atual de pesquisa e os fatores que afetam o desenvolvimento da vacina COVID-19. São apontadas também várias oportunidades e desafios necessários para o rápido desenvolvimento de uma vacina eficaz. (21/07/2020) Fonte: Diabetes & Metabolic Syndrome: Clinical Research & Reviews
23/07/2020
Estudo para avaliar a imunogenicidade dos antígenos à base da proteína S conclui que quando imunizado em camundongos, o domínio S1 do SARS-CoV-2 é mais imunogênico do que o domínio de ligação ao receptor (RBD), induzindo anticorpos IgG e IgA mais elevados e também anticorpos neutralizantes mais eficientes. Infere-se que uma grande proporção dos epítopos de neutralização estão localizados no domínio S1, mas fora do RBD e que alguns deles são epítopos espaciais. Este achado indica que sistemas de expressão com habilidades de modificação pós-translacional são importantes para manter as configurações naturais dos antígenos de proteína S recombinante e são fundamentais para vacinas eficazes para a COVID-19. Além disso, os adjuvantes propensos a uma resposta Th1 devem ser considerados para vacinas de subunidade baseadas em S1 para reduzir o risco potencial de aumento dependente de anticorpos (ADE) (21/07/2020). Fonte: Journal of Medical Virology
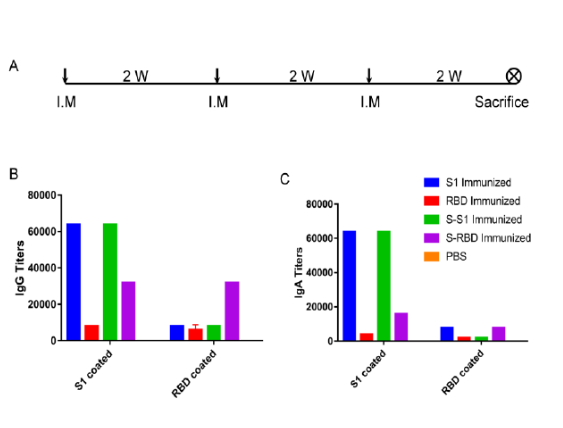
Em geral, a proteína S do coronavírus é o principal antígeno para o design de vacinas, pois pode induzir anticorpos neutralizantes e imunidade protetora, considerando a alta semelhança genética entre SARS-CoV e SARS-CoV-2 , no artigo a imunidade protetora contra os candidatos à subunidade SARS-COV em modelos animais foi revisada para obter avanços que podem facilitar o desenvolvimento de vacinas para coronavírus em um futuro próximo (18/07/2020). Fonte:Journal of Immunology Research
22/07/2020
Os autores avaliam por meio de imunoinformática peptídeos antigênicos de SARS-CoV-2 para a concepção da vacina COVID-19. Os epítopos das células T e B da proteína S foram previstos e rastreados com base na antigenicidade, toxicidade, alergenicidade e reatividade cruzada com proteomas humanos. A estrutura secundária e 3D da vacina foi prevista. A afinidade de ligação da vacina proposta à molécula HLA-A11: 01 e HLA-DRB1_01: 01 foi avaliada por acoplamento molecular. Utilizando dinâmica molecular, também foi avaliada a estabilidade dos complexos vacina-HLA. A clonagem do gene in silico foi realizada no vetor pET30a (15/07/2020). Fonte: International Journal of Biological Macromolecules
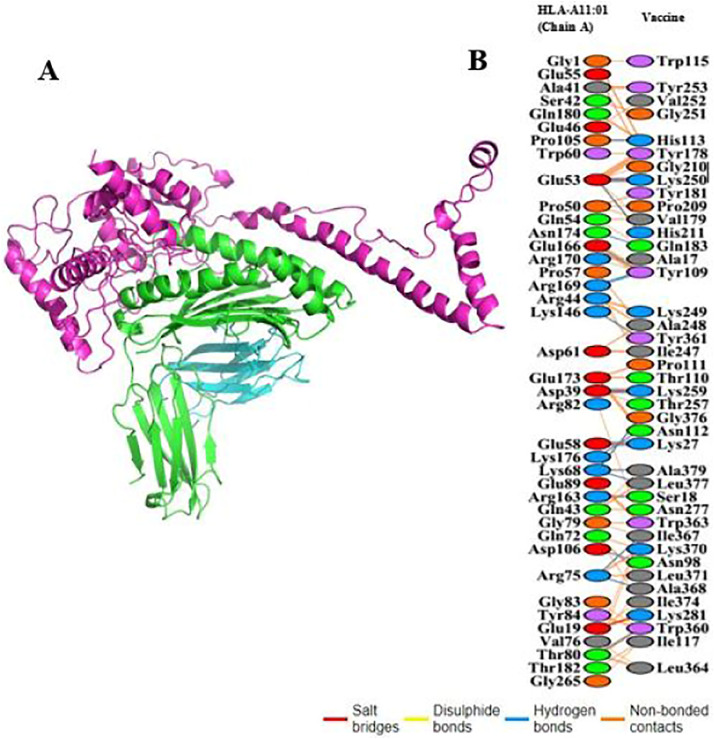
O mais recente balanço da Organização Mundial da Saúde (OMS) indica que 166 vacinas estão em desenvolvimento contra a COVID-19 em todo o mundo. Segundo a agência de saúde da ONU, de todas as vacinas em desenvolvimento, cinco já estão em sua terceira e última fase de estudo (22/07/2020). Fonte: G1
21/07/2020
Estudo sugere que vacina BCG tem potencial na prevenção de COVID-19 mais grave. Através do estudo com 120 pacientes adultos consecutivos (≥18 anos) com COVID-19 em um grande centro de saúde qualificado em Rhode Island, Estados Unidos tiveram como resultados 82 dos pacientes (68,3%) que foram vacinados com BCG apresentaram menor probabilidade de necessitar de internação hospitalar durante o curso da doença (3,7% vs. 15,8%, P = 0,019) (06/07/2020). Fonte: Epidemiology & Infection
Artigo correlaciona vacinação com BCG, utilização de fármacos antimalária, idade e gênero com o espalhamento e mortalidade da COVID-19. (31/07/2020) Fonte: Vaccine

A Anvisa publicou, nesta terça-feira (21/7), a aprovação para condução de um ensaio clínico que estudará dois tipos de vacinas para COVID-19: BNT162b1 e BNT162b2. Essas vacinas estão sendo desenvolvidas pelas empresas BioNTech e Pfizer (Wyeth). As vacinas em estudo são baseadas em ácido ribonucleico (RNA), que codifica um antígeno específico do vírus Sars-CoV-2. O RNA é traduzido pelo organismo humano em proteínas que irão então induzir uma resposta imunológica. O estudo prevê a inclusão de cerca de 29 mil voluntários, sendo 1.000 deles no Brasil, distribuídos nos estados de São Paulo e Bahia. O recrutamento dos voluntários é de responsabilidade dos centros que conduzem a pesquisa. O ensaio clínico aprovado é um estudo fase 1/2/3, controlado com placebo, randomizado, cego para o observador, de determinação de dose, para avaliar a segurança, a tolerabilidade, a imunogenicidade e a eficácia das vacinas candidatas de RNA de Sars-CoV-2 contra COVID-19 em adultos. O ensaio clínico é composto por três estágios e o Brasil participará do estágio 3, que corresponde à fase 2/3 do estudo (21/07/2020). Fonte: ANVISA
Revisão sugere evidências de que a replicação de SARS-CoV-2 em células de mamíferos não primatas, se empregada como vacinas vivas ou inativadas, pode induzir maior imunidade contra COVID-19, com a ajuda de anticorpos anti-Gal abundantes em humanos. A segurança da vacina viva poderia ser aumentada através da inoculação intramuscular para contornar os pulmões frágeis. As novas estratégias de vacinas, se confirmadas com experimentos e ensaios clínicos, fornecem uma abordagem simples, rápida contra o COVID-19 e lançam novas idéias sobre a prevenção de outras doenças infecciosas virais (18/07/2020). Fonte: Journal Medical Virology
Os autores abordam o tema da necessidade de desenvolvimento de vacinas para a COVID-19 e o pouco conhecimento existente sobre a resposta imune provocada pelo diferentes epítopos da proteína S. Sendo importante o aprendizado da resposta imunológica dos pacientes positivos. Analisam a correlação entre os níveis de anticorpos específicos para proteínas S ou nucleocapsídeo (N). Além disso, de identificar os locais imunodominantes lineares (ID) de células B lineares na proteína S por análise Pepscan com uma série de peptídeos sobrepostos contra os soros de pacientes com COVID-19 (01/07/2020). Fonte: Cell Research
Resultados do primeiro teste clínico de fase II da vacina de vetor viral Ad5 não-replicante da CanSino Biologics mostra que a vacina em uma dose de 5 × 1010 partículas virais/ml é segura, e induz respostas imunes significativas na maioria dos receptores após uma única imunização. O estudo randomizado, duplo-cego, controlado por placebo foi realizado em um único centro em Wuhan na China em 508 participantes que foram aleatoriamente designados para receber a vacina com dose de 1 × 1011 partículas virais/ml ou 5 × 1010 partículas virais/ml ou placebo. Ambas as doses testadas da vacina induziram respostas significativas de anticorpos neutralizantes ao SARS-CoV-2 in vivo. Parte dos pacientes relataram efeitos adversos. Reações adversas graves foram relatadas por 24 (9%) participantes do grupo de dose de partículas 1 × 1011 e um (1%) participante no grupo de dose de partículas virais 5 × 1010. Nenhuma reação adversa gravíssima foi documentada (20/07/2020). Fonte: Lancet
Resultados de testes clínicos de fase 1/2 da vacina ChAdOx1 nCoV-19 da Universidade de Oxford indicam que a vacina apresenta um perfil de segurança aceitável com o aumento homólogo das respostas de anticorpos. Esses resultados, juntamente com a indução de respostas imunes humorais e celulares, apoiam a avaliação de fase 3 em larga escala desta vacina já em curso. O estudo é single-blind, controlado randomizado em cinco locais de teste no Reino Unido em comparação com a vacina conjugada meningocócica (MenACWY) como controle. Foram recrutados 1077 participantes para receber a chAdOx1 nCoV-19 (n=543) ou MenACWY (n=534). Reações locais e sistêmicas foram mais comuns no grupo ChAdOx1 nCoV-19. Não houve eventos adversos graves relacionados ao ChAdOx1 nCoV-19 (20/07/2020). Fonte: Lancet
20/07/2020
Após poucas horas das autoridades chinesas publicarem a sequência genética do SARS-CoV-2, em 10 de janeiro de 2020, os fabricantes de vacinas já haviam desenvolvido alvos potenciais para uma vacina. Esta velocidade foi possível em virtude da adoção de abordagens computacionais e de informática e modelos matemáticos que se tornaram tão sofisticados que puderam prever regiões do novo patógeno como potencial de reconhecimento pelas células B e T humanas. Os esforços de anos de trabalho nesses modelos permitiram aos cientistas responder imediatamente ao aparecimento de um novo patógeno. Particularmente, ao serem capazes de prever as partes exatas do SARS-CoV-2 que provocariam uma resposta imune, os pesquisadores puderam acelerar os estágios iniciais do desenvolvimento da vacina e iniciar testes com animais (15/07/2020). Fonte: Nature.
A empresa alemã de biotecnologia BioNTech e a farmacêutica americana Pfizer divulgaram dados adicionais de sua vacina experimental contra o coronavírus que provam que ela é segura e foi capaz de induzir resposta imunológica nos pacientes. Os resultados referem-se a um teste feito na Alemanha com 60 voluntários saudáveis que, após tomarem duas doses da vacina, produziram anticorpos. De acordo com as empresas, foram verificadas respostas imunes “fortes” e em velocidade anterior ao prazo estimado das chamadas células T, consideradas fundamentais para protegerem um organismo do novo coronavírus. Esses dados deverão ser revisados para sua publicação oficial (20/07/2020). Fonte: OGlobo
Estudo apresenta as evidências disponíveis na literatura que levaram à sugestão dos possíveis efeitos de dois fatores, a vacinação com BCG e a exposição à cloroquina (CQ) e hidroxicloroquina (HCQ), na suscetibilidade à infecção por COVID-19. Os dados sugerem que a imunização com BCG se correlaciona com menor incidência e gravidade da doença de COVID-19 em diferentes países, mesmo quando a imunização com BCG foi realizada na infância. Embora a questão de CQ e HCQ não possua o grau de sofisticação numérica da vacinação com BCG, ela ainda merece ser considerada. Os autores discutem ainda o possível papel quimioprofilático da CQ e da HCQ (08/07/2020). Fonte: Cell Death & Disease
Pesquisadores afirmam que existem razões para cautela em relação às vacinas contra a COVID-19: 1) As mutações substanciais (embora raras) na proteína spike (alvo de muitas vacinas) são descritas juntamente com outras variantes de desvio. O efeito dessas mutações na expressão proteica e na antigenicidade necessária para provocar uma resposta de anticorpos não é clara. 2) Ao longo de uma década, as tentativas de desenvolver vacinas contra outros vírus de RNA, tais como SARS, MERS e dengue, resultaram em candidatos que não eram protetores e em alguma doença exacerbada por meio de anticorpos. 3) A COVID-19 afeta desproporcionalmente as faixas etárias mais velhas, onde a senescência imunológica leva a respostas imunes de qualidade inferior, podendo ser menos eficazes nesses grupos com maior necessidade (09/07/2020). Fonte: BMJ
17/07/2020
A nanotecnologia beneficia o design moderno de vacinas, uma vez que os nanomateriais são ideais para a entrega de antígenos, como adjuvantes, e como imitadores de estruturas virais. Artigo revisa as abordagens atuais para o desenvolvimento de vacinas COVID-19 e destaca o papel da nanotecnologia e da manufatura avançada nas vacinas modernas (15/07/2020). Fonte: Nature Nanotechnology

16/07/2020
A UFMG abriu as inscrições para seleção de 800 mineiros que desejam ser voluntários nos testes da fase 3 da vacina contra o coronavírus, a CoronaVac, desenvolvida pela biofarmacêutica chinesa Sinovac Biotech (16/0/2020). Fonte: UFMG
O Grupo de Trabalho para a Segurança de Vacinas com Vetor Viral de Colaboração da Brighton (V3SWG) preparou um modelo padronizado para descrever as principais considerações para a avaliação risco-benefício de vacinas proteicas. Isso ajudará as principais partes interessadas a avaliar possíveis problemas de segurança e a entender o risco-benefício dessa plataforma de vacina. A avaliação estruturada e padronizada fornecida pelo modelo também ajudaria a melhorar a aceitação e a comunicação pública das vacinas de proteína licenciadas (09/07/2020). Fonte: Vaccine
15/07/2020
Artigo apresenta os resultados de Fase I dos testes clínicos com a candidata a vacina de mRNA da empresa norte americana Moderna. Os ensaios incluíram 45 adultos saudáveis entre 18 e 55 anos de idade, que receberam duas doses da vacina, com 28 dias de intervalo, com mRNA-1273 em uma dose de 25 μg, 100 μg ou 250 μg. Cada dose foi testada em um grupo de 15 participantes. A vacina mRNA-1273 induziu respostas imunes anti-SARS-CoV-2 em todos os participantes, e não foram identificadas preocupações de segurança que limitassem o teste. Os achados apoiam a continuação do desenvolvimento desta vacina. (14/07/2020) Fonte: The new England Journal of Medicine
14/07/2020
Através da análise de imunoinformática e das estruturas tridimensionais (3D) recém-resolvidas das proteínas triméricas S do SARS-CoV-2, juntamente com análises dos perfis imunogênicos do SARS-CoV-2, foram investigados possíveis epítopos de células B e T para proteína S do SARS-CoV-2. A análise de imunoinformática baseada em estrutura da proteína S do SARS-CoV-2 neste estudo pode contribuir para o planejamento de vacinas, o diagnóstico e a imunoterapia contra a pandemia de COVID-19 (03/07/2020). Fonte: Vaccines.
A tendência dos benefícios do efeito da vacinação BCG na mortalidade por COVID-19 são influenciados por diferenças sociais, econômicas e demográficas entre os países. Após atenuar múltiplos fatores passíveis de causar imprecisões, foram observadas várias associações significativas entre a vacinação com BCG e a redução de óbitos por COVID-19. O estudo destaca a necessidade de mais investigações por trás do efeito da vacinação BCG no COVID-19 e de avaliação clínica da eficácia da vacinação BCG na proteção contra COVID-19 grave (09/07/2020). Fonte: Proc. Natl. Acad. Sci. U. S. A
Revisão explora novas estratégias de tratamento e terapias que estão sendo exploradas e estão em estágios clínicos e pré-clínicos de pesquisa como terapias com células-tronco, vacinas baseadas em DNA ou RNA contra COVID-19 em desenvolvimento por várias universidades, institutos ou empresas farmacêuticas (10/07/2020). Fonte: Indian Journal of Clinical Biochemistry
A Universidade de Queensland, na Austrália, começou a administrar sua candidata à vacina contra a COVID-19 em participantes adultos saudáveis em um ensaio clínico de Fase I. O estudo visa avaliar a segurança da vacina, juntamente com sua capacidade de induzir a resposta imune em voluntários saudáveis. Durante o estudo da Fase I, aproximadamente 120 participantes com idades entre 18 e 55 anos serão inscritos. Alguns participantes serão administrados com um placebo. Espera-se que os dados preliminares estejam disponíveis em cerca de três meses. Se resultados positivos forem obtidos, os pesquisadores da universidade pretendem realizar um estudo maior com uma população mais ampla. O objetivo é que a empresa de biotecnologia CSL acelere rapidamente a fabricação de milhões de doses da vacina e avance o programa para testes clínicos em estágio posterior, aprovação regulatória, produção e distribuição em larga escala (13/07/2020). Fonte: Clinical Trials ARENA
A empresa Moderna anunciou que estudo de fase 2 da sua candidata à vacina de mRNA-1273 contra a COVID-19, com coorte de adultos jovens saudáveis com idades entre 18 e 55 anos (n = 300) e o grupo sentinela de idosos com 55 anos ou mais (n = 50), foi concluído. O estudo de confirmação de dose, controlado por placebo, de Fase 2, está avaliando a segurança, reatogenicidade e imunogenicidade de duas vacinas de mRNA-1273 com 28 dias de intervalo. A Moderna finalizou o protocolo de estudo da Fase 3 (que deve iniciar ainda em julho/2020) com base no feedback da Food and Drug Administration (FDA) dos EUA: estudo randomizado, controlado por placebo, 1: 1 incluindo aproximadamente 30.000 participantes nos EUA. A Moderna concluiu a fabricação da vacina necessária para iniciar o estudo da Fase 3 com a dose da Fase 3 em 100 μg, e possivelmente fabricará até 1 bilhão de doses por ano, começando em 2021 (08/07/2020). Fonte: Moderna
13/07/2020
Autores utilizaram a vacina contra a febre amarela atenuada (YF17D) como vetor para expressar a forma de pré-fusão da proteína S do SARS-CoV-2. Em camundongos, a candidata à vacina, chamado provisoriamente de YF-S0, induz altos níveis de anticorpos neutralizantes contra o SARS-CoV-2 e uma resposta imune mediada por células Th1 favoráveis, prevenindo a infecção com SARS-CoV-2. Além disso, uma única dose confere proteção na maioria dos animais vacinados mesmo dentro de 10 dias. (09/07/2020) Fonte: bioRxiv
A Rússia irá iniciar a distribuição de uma vacina contra o coronavírus para a sua população entre 12-24 de agosto, numa distribuição equivalente a um teste de fase 3 (que testa a eficácia), já que quem receber a vacina ficará sobre supervisão. O país anunciou hoje que concluiu parte dos testes clínicos necessários para comprovar a eficácia da imunização (fases 1 e 2) desenvolvida por iniciativa do governo russo e concluiu que a vacina é segura. (13/07/2020) Fonte: UOL
Carta de pesquisadores brasileiros ao editor discute as limitações das evidências em torno de BCG e COVID-19 e argumentam a necessidade de evidências de maior qualidade para entender se existe o efeito protetor da vacina BCG, enquanto aguarda-se resultados de ensaios clínicos em diferentes configurações (11/07/2020). Fonte: Respiratory Research
Artigo propõe vacina para SARS-CoV-2 baseada em uma construção de um oligonucleotídeo contendo motivos CpG e o antígeno apresentando uma sequência de genoma exclusiva contendo ACG de SARS-CoV-2. As cepas de vírus sequenciadas na China (Wuhan) em fevereiro de 2020 continham em média um dinucleotídeo CpG a mais em seu genoma do que as cepas posteriores dos EUA (Nova York) sequenciadas em maio de 2020. Observa-se que a seleção natural tende a selecionar genomas virais contendo menos motivos de CpG que não desencadeiam uma forte resposta imune inata, de modo que a pessoa infectada tem sintomas moderados e espalha SARS-CoV-2 mais facilmente. No entanto, os autores do artigo acreditam que os dinucleotídeos CpG não metilados também são capazes de preparar o sistema imunológico hospedeiro para a infecção pelo coronavírus e devem estar presentes nas vacinas SARS-CoV-2 (12/07/2020). Fonte: Inflammation Research
CanSino Biologics publicou os primeiros dados para sua a vacina que expressa proteína S COVID-19. A vacina gerou anticorpos neutralizantes em muitos receptores e pareceu segura, mas a empresa, assim como outras empresas nesse setor, permanece alerta para um fenômeno perigoso conhecido como aprimoramento dependente de anticorpos (ADA). Existem crescentes preocupações teóricas de que as vacinas que geram anticorpos contra o SARS-CoV-2 podem se ligar ao vírus sem neutralizá-lo. Caso isso aconteça, os anticorpos não neutralizantes podem melhorar a entrada viral nas células e a replicação viral e acabar agravando a infecção em vez de oferecer proteção, por meio do fenômeno pouco conhecido da ADA (05/06/2020). Fonte: Nature Biotechnology

Estudo apresenta um RNA auto-amplificador que codifica a proteína S SARS-CoV-2 encapsulada dentro de uma nanopartícula lipídica (LNP) como vacina. Eles observaram que títulos de anticorpos específicos para SARS-CoV-2 eram notavelmente altos e dependentes da dose nos soros de camundongos, bem como uma neutralização robusta de um pseudo-vírus e um vírus do tipo selvagem. Após uma caracterização adicional, descobriram que a neutralização é proporcional à quantidade de IgG específica e de maior magnitude que os pacientes recuperados com COVID-19. Eles observaram altas respostas celulares, caracterizadas pela produção de IFN-γ, após re-estimulação com peptídeos SARS-CoV-2. Esses dados fornecem informações sobre o design da vacina e a avaliação da imunogenicidade para permitir a tradução rápida para a clínica. Logo, a vacina saRNA LNP apresentada nesses estudos suscitou respostas robustas de anticorpos e células, com um viés de Th1 que, segundo a hipótese, permitirá a imunogenicidade em humanos (09/07/2020). Fonte: Nature Comunications
Os autores apresentam um estudo de convolução de nanopartículas lipídicas simples e multilamelares utilizadas para liberação de RNA mensageiro (20/06/2020). Fonte: Nano Letters
10/07/2020
O Vaccinia Ankara modificada (MVA) é um vetor de poxvírus altamente atenuado que é amplamente utilizado para desenvolver vacinas para doenças infecciosas e câncer. Pesquisadores desenvolveram uma nova plataforma de vacina baseada em um sistema único de três plasmídeos para gerar vetores MVA recombinantes a partir de DNA quimicamente sintetizado. A nova plataforma de vacina produziu rapidamente vetores MVA (sMVA) totalmente sintéticos que co-expressam proteína S de SARS-CoV-2 e antígenos nucleocapsídeos, dois antígenos imunodominantes implicados na imunidade protetora. Os ratinhos imunizados com estes vetores sMVA desenvolveram respostas imunitárias humorais e imunológicas específicas para o antigénio SARS-CoV-2, incluindo anticorpos neutralizantes (02/07/2020). Fonte: bioRxiv
09/07/2020
Artigo discute a ordem das pessoas que seriam imunizadas caso uma vacina para COVID-19 seja aprovada e chegue no mercado (03/07/2020). Fonte: Science
Departamento de Saúde e Serviços Humanos (HHS) dos EUA lançou a Operação Warp Speed - uma parceria entre governo e indústria - com o objetivo de fornecer 300 milhões de doses de uma vacina segura e eficaz até janeiro de 2021. Inicialmente focado em 125 potenciais candidatos a vacina, mas foi rapidamente reduzido para 5 candidatas (06/07/2020). Fonte: JAMA
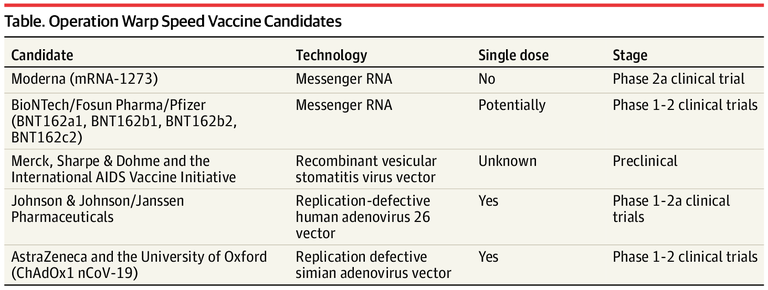
07/07/2020
Anvisa autoriza novo teste para vacina desenvolvida pela empresa Sinovac Research & Development Co., Ltd (Sinovac Biotech Co., Ltd), sediada na China. O pedido de autorização foi realizado pelo Instituto Butantan (SP) e os testes devem ser desenvolvidos em diferentes locais do Brasil. A vacina CoronaVac será estudada com o objetivo de avaliar sua segurança e eficácia na imunização ativa contra a doença causada pelo SARS-CoV-2. O estudo aprovado é um ensaio clínico fase III duplo-cego, randomizado, controlado com placebo para avaliação de eficácia e segurança em profissionais da saúde da vacina adsorvida Covid-19 (inativada) produzida pela Sinovac (03/07/2020). Fonte: ANVISA
O domínio de ligação ao receptor (RBD) é um alvo atraente da vacina, mas é prejudicado por limitações imunogenicidade. Estudo descreve uma forma dimérica de MERS-CoV RBD que supera essa limitação. O dímero RBD aumentou significativamente os títulos de anticorpos neutralizantes (NAb) em comparação com a forma monomérica convencional e camundongos protegidos contra a infecção por MERS-CoV. A estrutura cristalina mostrou motivos de ligação dupla ao receptor, totalmente expostos ao dímero RBD, os principais alvo para NAbs. O projeto guiado por estrutura produziu uma versão estável do dímero RBD como cadeia dupla repetida (dímero RBD-sc) que retém a potência da vacina. Essa estratégia está sendo usada para projetar vacinas contra COVID-19 e SARS, alcançando aumento de 10 a 100 vezes nos títulos de NAb. Os dímeros RBD-sc na produção em escala piloto produziram altos rendimentos (23/06/2020). Fonte: Cell
Autores apresentam uma candidata a vacina multi-epítopos contra o SARS-CoV-2 capaz de induzir tanto resposta humoral como celular. A uma vacina multi-epítopo utilizando a glicoproteína S de SARS-CoV-2 foi projetada computacionalmente. Estudos de acoplamento revelaram interações estáveis da vacina com receptores toll-like e receptores MHC. A clonagem in silico propiciou uma expressão eficiente da vacina no sistema de expressão E. coli. As análises computacionais sugerem que a vacina multi-epítope projetada é estruturalmente estável, o que pode induzir respostas imunes específicas e, portanto, pode ser um potencial candidato à vacina contra o SARS-CoV-2. (02/07/2020) Fonte: Scientific Reports
03/07/2020
Pesquisadores relatam que uma proteína de fusão recombinante, contendo um domínio de 457 aminoácidos de ligação ao SARS-CoV-2 (RBD, resíduos 319-541) e um domínio Fc de IgG1 de camundongo, pode induzir anticorpos neutralizantes altamente potentes e estimular a imunidade celular e humoral em ratos. Os anticorpos também suprimem efetivamente a ligação do RBD do SARS-CoV-2 ao ECA2 solúvel, indicando que o RBD-mFc pode ser desenvolvido como uma vacina segura e eficaz contra o SARS-CoV-2 (02/07/2020). Fonte: Chemical Communications
02/07/2020
Estudo examina uma das proteínas codificadas pelo SARS-CoV-2 mais diferente do vírus SARS original, um macrodomínio da proteína não estrutural 3 (nsp3). Embora 26% dos aminoácidos neste macrodomínio de SARS-CoV-2 sejam diferentes dos observados em outros coronavírus, dados bioquímicos e estruturais revelam que a proteína mantém a capacidade de se ligar à ADP-ribose, que é uma característica importante dos coronavírus beta e alvo terapêutico potencial; uma vez que estudos com outros vírus de RNA(+) sugerem que os macrodomínios são essenciais para a virulência. A proteína recombinante relatada no estudo, juntamente com informações estruturais detalhadas, também pode ser útil ao desenvolvimento de métodos de diagnósticos e / ou terapêuticos para SARS-CoV-2 (24/06/2020). Fonte: Biochemistry
Estudo de caso sobre transmissão do coronavirus envolvendo 3 famílias vizinhas (um total de 30 pessoas) em isolamento em casas de campo na França durante o lockdown discute possíveis fatores envolvidos na transmissão do vírus. Após o surgimento dos primeiros sintomas em um dos indivíduos, as famílias foram monitoradas por PCR, IgM e IgG. Nenhuma das 9 crianças presentes foi infectada, embora tivesse contatos com seus pais infectados. Entre os 9 casais presentes, todos compartilhavam a mesma cama pelo menos alguns dias após o início dos sintomas ou durante todo o tempo da doença. Estudo sugere que (i) as crianças não participaram da rede de transmissão viral, dentro ou entre casas. Isso sustenta a hipótese de que, geralmente, as crianças não são portadoras assintomáticas que transmitem o SARS-CoV-2, e (ii) houve uma transmissão limitada de SARS-CoV-2 entre os casais, embora os casais continuassem a ser sexualmente ativos durante o período contagioso do parceiro infectado (28/06/2020). Fonte: Journal of Infection
Artigo discute os modelos controlados de infecção humana (CHIMs) que têm sido propostos como estratégia para acelerar o desenvolvimento de vacinas contra o SARS-CoV-2. São feitas considerações éticas levantadas por tais modelos, observando seus benefícios sociais e articulando uma série de opiniões sobre se o risco é justificado. Os esforços atuais encurtam os cronogramas de desenvolvimento comprimindo e sobrepondo os estágios, acelerando a transição entre fases clínicas, alimentando estudos de eficácia para produzir resultados em um curto espaço de tempo e buscando a fabricação em larga escala de vacinas antes da aprovação pelas agências regulatórias. (01/07/2020) Fonte: The New England Journal of Medicine
01/07/2020
Estudo sugere que a vacina inativada contra influenza trivalente está associada a menor mortalidade entre pacientes COVID-19 no Brasil. Foram analisados dados de 92.664 casos de COVID-19 no Brasil confirmados clínica e molecularmente para entender as possíveis associações entre a vacinação contra influenza e os resultados de COVID-19. Controlando as instalações de tratamento, as comorbidades e uma ampla variedade de fatores sociodemográficos, foi demonstrado que os pacientes que receberam uma vacina recente contra a influenza tiveram, em média, 8% menos chance de precisar de tratamento intensivo, 18% menos chance de exigir suporte respiratório invasivo e 17% menos chance de morte. A promoção em larga escala de vacinas contra influenza parece aconselhável, especialmente em populações com alto risco de infecção grave por SARS-CoV-2. (01/07/2020) Fonte: MedRxiv
30/06/2020
Revisão aborda questões relacionadas ao rápido desenvolvimento de “Warp Speed” de vacinas para combater a COVID-19. Foram discutidos aspectos relacionados à potência e duração da imunidade da vacina, tais como a produção de anticorpos induzida pelo SARS-CoV-2, o isolamento e propriedades dos anticorpos monoclonais neutralizantes e a natureza e longevidade do anticorpo. Foram discutidas a imunogenicidade dos principais candidatos a vacinas testados até o momento em animais e humanos, particularmente das vacinas de proteínas recombinantes (30/06/2020). Fonte: Journal of Virology
UFMG pesquisa uso da vacina BCG como base para imunização contra COVID-19. Intenção é fazer com que a bactéria utilizada na vacina contra tuberculose produza também a proteína do vírus SARS-CoV-2, gerando uma vacina dupla para proteger contra tuberculose e contra a COVID-19. O estudo está em fase inicial e conta com a parceria da Universidade Federal de Santa Catarina (UFSC) e do Instituto Butantan. A próxima fase é o teste em animais, que deve ser iniciado até o fim do ano. De acordo com o professor, ainda não há previsão para a testagem em humanos. (30/06/2020) Fonte: G1
Este artigo visa entender por que as crianças constituem um grupo menor entre os pacientes internados de COVID-19. Hipóteses de que a vacina contra sarampo, caxumba e rubéola (RMM) poderia fornecer um anticorpo neutralizante amplo contra o número de doenças, incluindo COVID-19. A hipótese é baseada na homologia entre a sequência de 30 aminoácidos do glicoproteína S do SARS-CoV-2 e tanto a glicoproteína do vírus de fusão do sarampo (F1) e a glicoproteína do envelope do vírus da rubeola. Análise computacional da região homóloga detectou a sequência de epítopos antigênicos tanto no sarampo quanto na rubéola. Portanto, acredita-se que a imunidade humoral, criada através da vacinação da RMM, fornece às crianças uma proteção vantajosa contra o COVID-19, no entanto, uma análise experimental é necessária (05/06/2020). Front Mol Biosci
A vacina da Sinopharm foi considerada segura e capaz de gerar altos níveis de anticorpos entre os participantes dos ensaios clínicos de fase I e II, de acordo com uma publicação da própria Sinopharm. Todos os participantes recebem 2 doses em intervalos de 3 ou 4 semanas, gerando anticorpos neutralizantes, uma medida da capacidade da vacina de estimular uma resposta imune específica ao coronavírus. A vacina é desenvolvida em conjunto pelo instituto de pesquisa de Sinopharm em Pequim e pelo Centro Chinês de Controle e Prevenção de Doenças (28/06/2020). Fonte: Bloomberg Business
29/06/2020
Cientistas da América Latina na corrida pela vacina contra COVID-19. O artigo discute o potencial de desenvolvimento de vacinas por grupos de pesquisa da USP e Instituto Butantan, no Brasil, Argentina, México, Chile e Peru (12/06/2020). Fonte: Nature.
Artigo apresenta técnica para o desenvolvimento de vacinas baseado na criação de formas e padrões em nanoescala, conhecida como “origami de DNA”, onde o DNA é “dobrado” formando uma estrutura semelhante ao vírus, revestidas de proteínas e antígenos em padrões precisos. Nesta técnica, a eficácia da vacina é aumentada por meio da matriz de imunógenos em forma multivalente carreados em nanopartículas semelhantes a vírus para melhorar a ativação das células B. Os efeitos do número de cópia de antígeno, espaçamento e afinidade, bem como a dimensionalidade e rigidez da estrutura são importantes na maximização da ativação das células B. A técnica funcionou em laboratório para partículas semelhantes ao HIV e o grupo agora trabalha na adaptação do “origami de DNA” para um formato de vacina contra o SARS-CoV-2. Os autores antecipam que a técnica é promissora para uma grande variedade de doenças virais. (29/06/2020) Fonte: Nature Nanotechnology
O Grupo Nacional Biotec da China (CNBG), que desenvolve uma das candidatas chinesas à vacina contra o coronavírus, informou que os primeiros resultados dos ensaios clínicos com mais de 1.100 voluntários (fase I e II dos testes clínicos) sugerem que a imunização seja segura e eficaz. O estudo apresentando os resultados ainda não foi divulgado mas a farmacêutica afirma que a vacina induziu a produção de altos níveis de anticorpos em todos os participantes. (28/06/2020) Fonte: G1
A candidata a vacina Ad5-nCoV da empresa CanSino Biologics, uma das vacinas chinesas em testes clínicos, foi aprovada para testes em humanos na china e no Canadá para tratar a doença respiratória causada pelo novo coronavírus. Os testes clínicos de Fase 1 e Fase 2 da candidata a vacina da CanSino mostraram que ela tem potencial de prevenir doenças provocadas pelo coronavírus, mas segundo a empresa, seu sucesso comercial não pode ser garantido. (29/06/2020) Fonte: G1
Pesquisadores formulam hipótese de que vacinas peptídicas contendo epitopos otimizadas para estimulação simultânea de células B, células T CD4+ e células T CD8+ conduziriam à imunidade humoral e celular com alta especificidade, potencialmente evitando efeitos indesejados, como o aumento dependente de anticorpos (ADE). Além disso, essas vacinas podem ser fabricadas rapidamente. Neste estudo, os pesquisadores combinam estudo computacional de epítopos de células T, estudos de mapeamento de epítopos de células B e acessibilidade de epítopos para selecionar vacinas de peptídeos candidatas para SARS-CoV-2 (04/06/2020) (Pre Print). Fonte: BioRxiv
26/06/2020
OMS afirmou nesta sexta-feira que vacina produzida pela Universidade de Oxford, e que está em teste no Brasil, é a "mais avançada" do mundo e lidera a corrida por um imunizante contra o novo coronavírus (26/06/2020) O Globo
Estudo demonstra que a maioria das vacinas em desenvolvimento para COVID-19 tem como alvo a proteína spike ou epítopos. Técnicas alternativas foram desenvolvidas para administrar o DNA ou RNA que codifica a proteína antigênica. Existem dois métodos comuns de introdução de DNA / RNA nas células imunológicas do hospedeiro, a saber: (1) usando vetores virais ou (2) usando um sistema de entrega para transportar DNA / RNA através da membrana celular e promover a síntese da proteína spike ambos e ambos podem incluir nanopoarticulas de sílica. Um terceiro método, a eletroporação, também pode ser considerado (24/06/2020). Fonte: Drug Discovery Today

Pesquisadores examinam a imunogenicidade em camundongos, coelhos e macacos da proteína recombinante de fusão S1-Fc SARS-CoV-2 expressa em CHO como potencial candidata a uma vacina para a COVID-19. Demonstrou-se que a proteína de fusão S1-Fc é extremamente imunogênica, como evidenciado anteriormente. Foi observada forte atividade de neutralização do vírus em coelhos imunizados com a proteína de fusão S1-Fc usando um ensaio de neutralização de pseudovírus. Mais importante ainda, em menos de 20 dias e três injeções da proteína de fusão S1-Fc, dois macacos desenvolveram altos títulos neutralizadores de vírus, sendo mais altos do que aqueles de um paciente recuperado com COVID-19 em um ensaio de infecção por SARS-CoV-2. Os dados sugerem fortemente que a proteína recombinante S1-Fc SARS-CoV-2 expressa em CHO poderia ser uma forte candidata ao desenvolvimento de vacinas contra COVID-19 (24/06/2020). Fonte: Vaccine
25/06/2020
A Genexine Inc., com sede na Coréia, começou o recutamento de um estudo de fase I / II para uma vacina de DNA direcionada ao COVID-19, chamada GX-19. Os gerentes da empresa esperam dados preliminares do teste inicial em setembro e esperam concluir todas as etapas até o final de 2021. O estudo da fase I incluirá 40 participantes saudáveis no Gangnam Severance Hospital, enquanto um estudo subsequente da fase IIa, se for merecido, será realizado na segunda metade do ano com participantes de países como Indonésia e Tailândia (23/06/2020). Fonte: Bioworld
A análise de dados do COVID-19 de 190 países com status conhecido de vacinação com BCG revelou que as taxas de morbidade e mortalidade e positividade percentual entre os indivíduos testados para SARS-CoV-2 mostrou correlações negativas significativas com o uso obrigatório da vacina BCG. Esta observação indicou a eficácia protetora da vacinação infantil com BCG na proteção da morbimortalidade e COVID-19. Segundo pesquisadores, a razão plausível pode ser a indução de imunidade inespecífica e de proteção cruzada pela vacinação com BCG mesmo contra infecções virais (23/04/2020). Fonte: Journal of Pure and Applied Microbiology
Em carta ao editor, pesquisadores comunicam que desenvolveram o COVIDep (COVIDep.ust.hk), uma plataforma Web que reúne dados genéticos para SARS-CoV-2 e dados imunológicos para o vírus SARS 2003, SARS -CoV, para identificar epítopos de células B e células T para servir como recomendações de alvo de vacina para SARS-CoV-2. O COVIDep também inclui exibições para cada uma das proteínas SARS-CoV-2, mostrando as localizações dos epítopos identificados na estrutura primária. Apresentações gráficas são fornecidas para ajudar na interpretação dos dados, incluindo uma discriminação temporal e geográfica das sequências analisadas e uma exibição da variação genética observada (frequências de mutação de aminoácidos) para cada proteína SARS-CoV-2. A plataforma é atualizada diariamente (www.gisaid.org), o que é importante porque as sequências de SARS-CoV-2 estão sendo disponibilizadas a uma taxa crescente por meio de esforços internacionais de compartilhamento de dados, e a identificação dos alvos da vacina é influenciada pela variação genética recentemente observada (17/06/2020). Fonte: Nature Protocols
Pesquisadores mexicanos desenvolvem possível vacina com tecnologia genômica contra a COVID-19 e planejam testes em humanos para setembro. A candidata a vacina, já em testes pré-clínicos, pode ser a primeira desenvolvida na América Latina a ser testada em humanos. A pesquisa, liderada pela Universidade Autônoma da Baixa California (UABC), chamou a atenção de outras organizações e 17 universidades e instituições de saúde, que se uniram para consolidar o projeto (25/06/2020), Fonte: G1
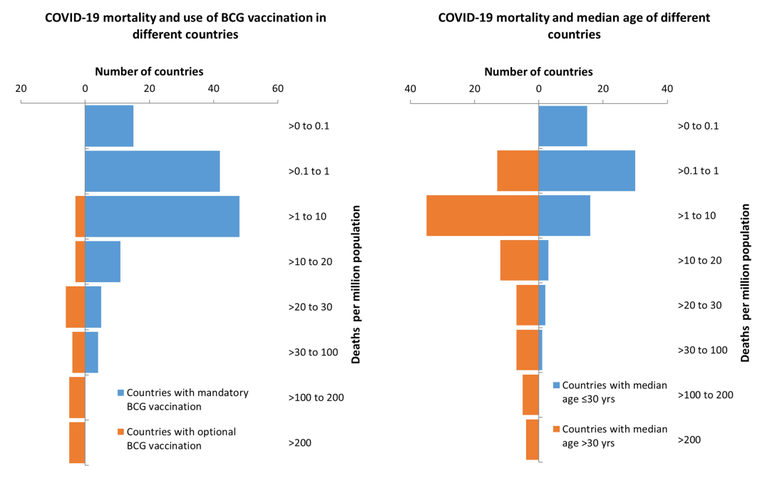
24/06/2020
Caso os testes com a vacina da Universidade de Oxford, que estão sendo realizados no Brasil pela Universidade Federal de São Paulo (Unifesp) com mais de duas mil pessoas forem bem-sucedidos, a Fundação Lemann tem planos para construir no Brasil uma fábrica para produção de vacina contra a COVID-19. Segundo informações da fundação, a articulação para a vinda dos testes ao Brasil contou com a liderança da Professora Doutora Sue Ann Costa Clemens, diretora do Instituto para a Saúde Global da Universidade de Siena e pesquisadora brasileira especialista em doenças infecciosas e prevenção por vacinas, investigadora do estudo (22/06/2020). Fonte: InfoMoney
23/06/2020
Em carta para editor autores comparam a morbidade e mortalidade da COVID-19 na Alemanha ocidental e oriental, que possuem históricos e políticas de vacinação com BCG diferentes e concluem que na região com política de vacinação mas antiga o segmento na população idosa parece mais protegido contra a COVID-19. (18/06/2020) Fonte: Leukemia
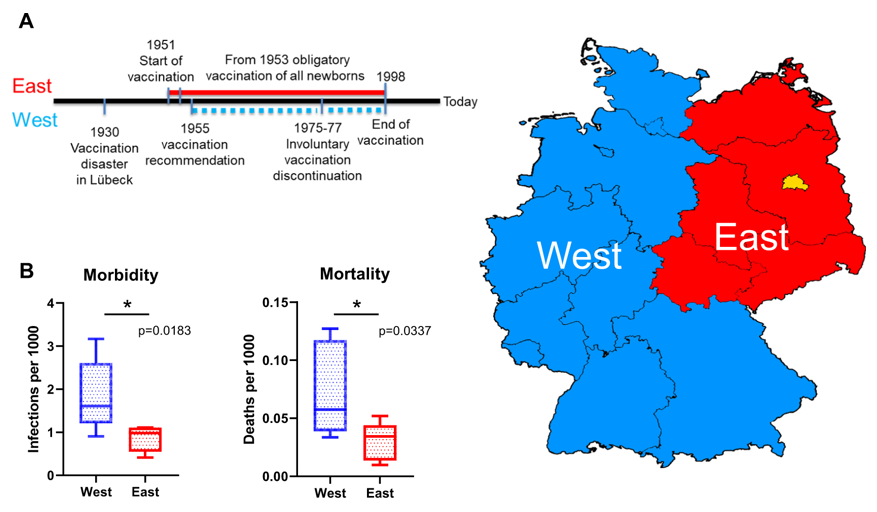
19/06/2020
O laboratório brasileiro Farmacore, em parceria com a norte-americana PDS Biotechnology, testará uma vacina experimental produzida para combater o coronavírus (COVID-19). O financiamento da primeira fase de testes será feito pelo Ministério da Ciência e Tecnologia, mas ainda está sendo discutido. A vacina é denominada “Versamune-CoV-2FC” e está sendo feita com uma combinação de uma proteína desenvolvida pela Farmacore em aliança com o auxílio tecnológico de ferramentas da PDS (18/06/2020). Fonte: Sunoresearch
18/06/2020
Autores apresentam uma pequena revisão sobre o desenvolvimento de vacinas de RNAm e suas vantagens frente a outras vacinas, inclusive vacinas de DNA. O artigo fala ainda da importância do desenvolvimento de métodos para aumentar a estabilidade, a produção intracelular da proteína e o sistema de direcionamento do RNAm (drug delivery). (18/06/2020) Fonte: The New England Journal of Medicine
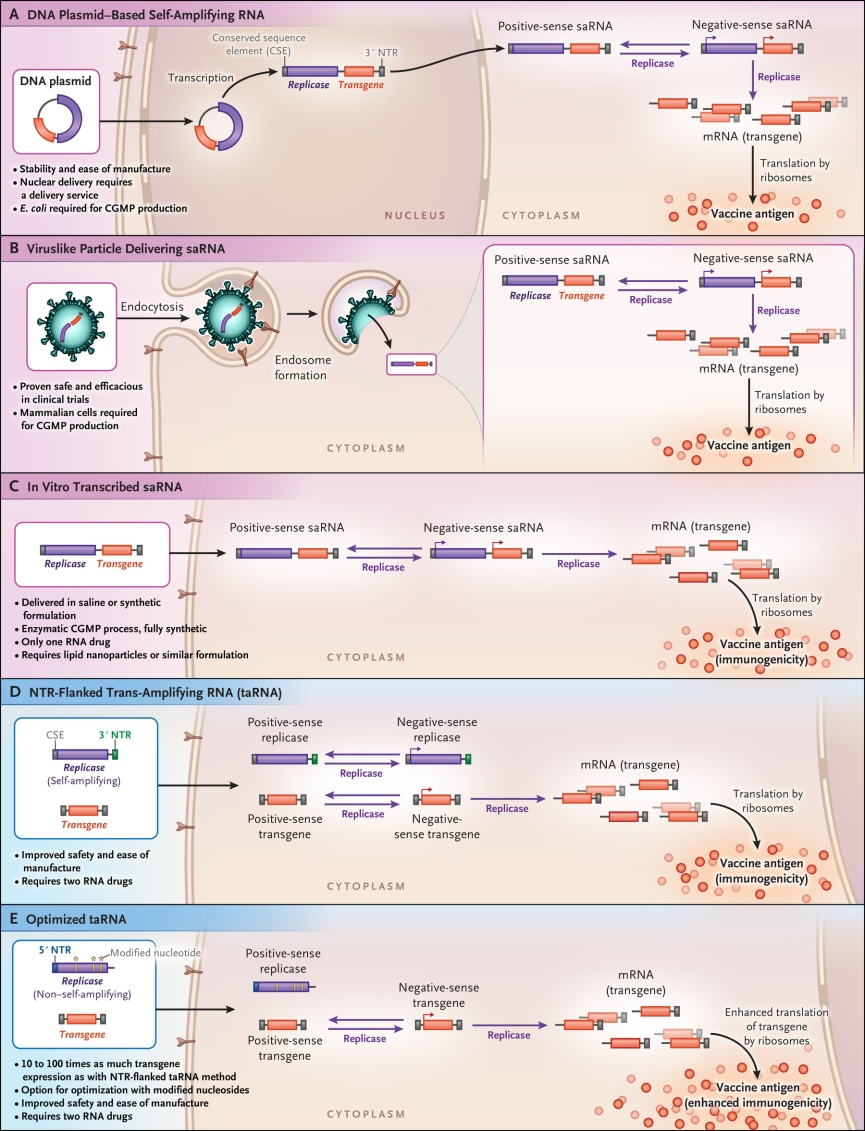
Artigo apresenta uma extensa revisão da literatura médica relativa a candidatos a vacina para os principais coronavírus responsáveis por epidemias em humanos, incluindo avanços recentes no desenvolvimento de uma vacina contra o COVID-19. As candidatas a vacinas dos principais coronavírus epidêmicos do passado mostrou que os estudos em modelos animais sugerem uma alta eficácia de possíveis vacinas na proteção contra desafios virais. Estudos em humanos semelhantes ainda não foram realizados, pois os principais estudos têm como objetivo avaliar principalmente a segurança e a imunogenicidade das vacinas. (17/06/2020) Fonte: Vaccines
16/06/2020
Pesquisadores do Instituto de Ciências Biomédicas (ICB) da USP estão desenvolvendo uma vacina baseada em nanotecnologia para o novo coronavírus. A nanovacina, segundo os pesquisadores, pode gerar respostas mais contundentes dos anticorpos do organismo no combate à doença, frente aos estudos vacinais que utilizam apenas a proteína do vírus (15/06/2020). Fonte: Jornal da USP
15/06/2020
Efeitos benéficos não específicos contra doenças infecciosas já foram descritos para vacinas como vacina contra vírus da poliomelite (OPV, oral poliovirus vaccine), vacina contra enterovírus (live enterovirus vaccine), vacina contra sarampo e varíola e Bacillus Calmette–Guérin (BCG), contra tuberculose. Em estudo de 2014 sobre os efeitos não específicos de vacinas vivas, a Organização Mundial da Saúde concluiu que a redução da mortalidade infantil era maior do que aquela esperada pela prevenção da doença para qual era orientada. Importa salientar que vacinas inativadas não parecem causar os mesmos efeitos, o que sugere que patógenos atenuados induzem resposta imune mais ampla. Estudos recentes indicam que a COVID-19 pode inibir a resposta imune inata. Portanto, a estimulação por vacinas vivas atenuadas pode aumentar a resistência à infecção pelo SARS-CoV-2. Ensaios clínicos com BCG já foram iniciados pela imunização dos profissionais de saúde (NCT04327206, NCT04328441). Sugere-se que o uso da OPV para melhorar ou prevenir a COVID-19, ressaltando-se algumas características vantajosa em relação à BCG: maior segurança, existência de mais de um sorotipo, baixo custo, facilidade de administração e disponibilidade (12/06/2020). Fonte: Science.
Autores analisaram a relação entre a glicólise e a replicação SARS-CoV-2 em monócitos. A glicose aumentou a carga viral SARS-CoV-2 e a expressão mRNA de citocinas pró-inflamatórias e interferons tipo I/III nessas células de forma dependente de dose. Foi demonstrado que os efeitos da glicose dependem de mtROS e HIF1α. A transição para a glicólise aeróbica em monócitos infectados pelo SARS-CoV-2 facilitou a replicação viral e a produção de mediadores solúveis que podem contribuir para danos pulmonares. Os autores sugerem investigar o potencial de direcionamento terapêutico de mtROS, HIF1α e sinalização de glicólise, mantendo interferons antivirais tipo I/III. (12/06/2020) Fonte: Nature Reviews Immunology
12/06/2020
O Butantan firmou parceria com a empresa farmacêutica chinesa Sinovac para produção e testes em estágio avançado de uma vacina contra o coronavírus. O acordo prevê um ensaio clínico de fase III com 9.000 voluntários no Brasil e fornecimento de doses até junho de 2021, caso a imunização se prove eficaz e segura. A vacina CoronaVac teve sucesso em testes de laboratório em macacos e nas fases clínicas I e II. (12/06/2020). Fonte: Butantan
Johnson & Johnson iniciará os testes clínicos em humanos para sua vacina experimental contra o SARS-CoV-2 (Ad26.COV2-S, recombinante). A empresa, que iniciaria os testes em setembro de 2020 irá testar a segurança e os primeiros sinais de eficácia em 1045 voluntários saudáveis nos Estados Unidos e na Bélgica (Fase I e IIa dos testes clínicos) a partir de segunda metade de julho (10/06/2020). Fonte: J&J
A farmacêutica britânica AstraZeneca espera entregar dois bilhões de doses de sua potencial vacina contra coronavírus este ano e em 2021, o dobro de previsões anteriores, graças a acordos com o Serum Institute of India e duas organizações globais de saúde apoiadas por Bill Gates. (12/06/2020) Fonte: Exame
Artigo faz uma revisão sobre as vacinas em desenvolvimento para COVID-19 e discute as preocupações sobre as formas de acelerar os testes clínicos que tem sido utilizadas como realizar testes clínicos de fase I e II em paralelo e fazer experimentos de “desafio” em humanos para confirmar a eficácia, indicando que a busca por uma solução rápida pode levar a erros com consequências desastrosas (10/06/2020). Fonte: Journal of Clinical and Experimental Hepatology
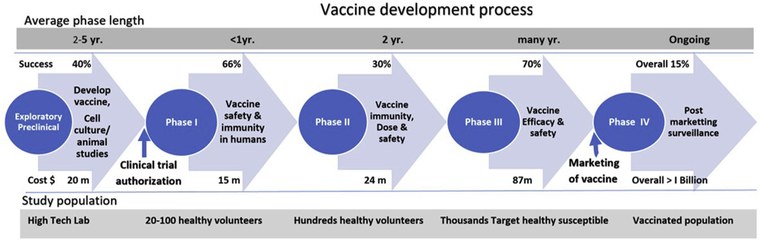

Artigo apresenta as possibilidades de utilização das vacinas de mRNA no combate ao SASR-CoV-2. Os autores falam que existem pelo menos 14 projetos de vacinas de mRNA para o SARS-CoV-2 anunciados pela OMS e explicam o mecanismo de ação deste tipo de vacina, ressaltando que é uma plataforma muito nova, que ainda precisa de estudos que comprovem a eficiência como profilaxia em humanos (10/06/2020). Fonte: Virologica Sinica
10/06/2020
A Universidade de Oxford e a AstraZeneca, estão desenvolvendo a candidata mais avançada à vacina para COVID-19, AZD1222, que consiste em um vetor de adenovírus de chimpanzé projetado para transportar a proteína spike SARS-CoV-2. Dentre as outras 10 candidatas, destaca-se a vacina de mRNA da farmacêutica Moderna que está em estudo clínico de fase II (08/06/2020). Fonte: Nature Reviews
O Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz) está pronto para testar uma vacina autóctone para o novo coronavírus em modelo animal, fase de desenvolvimento chamada de “estudos pré-clínicos”. A abordagem do projeto é de uma vacina sintética, com base em peptídeos antigênicos de células B e T, ou seja, com pequenas partes de proteínas do vírus capazes de induzir a produção de anticorpos específicos para defender o organismo contra agentes desconhecidos – neste caso, o SARS-CoV-2. As biomoléculas, identificadas em modelo in silico, foram produzidas por síntese química e validadas in vitro. Os peptídeos foram acoplados em nanopartículas, que funcionam como uma forma de “entrega”, para apresentar essas biomoléculas para o sistema imune com melhor imunogenicidade e ativar sua defesa. (10/06/2020). Fonte: Bio-Manguinhos
Os anticorpos conduzem uma miríade de funções que interrompem direta e indiretamente a infecção, cada uma com diferentes consequências (ver figura). Avaliar de forma completa as funções de anticorpos no controle da infecção por SARS-CoV-2 abrirá o caminho para o design racional de vacinas e terapias eficazes. Dada a preocupação com a piora da patologia e com a notável função potencialmente imune-protetora dos anticorpos no controle da inflamação, é importante que as vacinas sejam avaliadas quanto ao seu perfil funcional antiviral pró-inflamatório e anti-inflamatório para maximizar o potencial do sistema imunológico humoral (08/06/2020). Fonte: Nature Reviews Immunology
A Moderna Therapeutics ingressou na fase dois de seus ensaios clínicos. A conquista sinaliza que a vacina à base de RNAm da empresa foi aprovada nas verificações iniciais de segurança. O estudo de fase dois envolverá cerca de 600 participantes de 10 centros e oito estados. (09062020) Fonte: National Geographic Brasil
08/06/2020
Artigo cita as 10 candidatas à vacina que estão com seus ensaios clinicos mais avançados e cita que o desenvolvimento de uma vacina é muito longo. Embora muitos especialistas em doenças infecciosas argumentem que até 18 meses para uma primeira vacina é um cronograma incrivelmente agressivo, uns poucos otimistas acreditam que centenas milhões de doses da vacina podem estar prontas para o lançamento até o final de 2020. Apesar dos riscos com os resultados clínicos, as instituições já estão começando a aumentar a produção (06/06/2020). Fonte: The Lancet
O artigo faz um apanhado das principais vacinas em teste clínico e aborda o uso potencial do alúmen como adjuvante farmacotécnico para seu desenvolvimento, discorrendo sobre sua segurança e efetividade baseado no seu uso em outras vacinas já comercializadas (04/06/2020). Fonte: Nature Reviews Immunology
Os autores propõem conceitos para o desenvolvimento de vacinas baseados na identificação de regiões altamente conservadas do genoma viral para gerar epítopos apresentados no MHC classe I e II. Priorizando regiões genômicas que geram peptídeos altamente diferentes do proteoma humano. O estudo apresenta 65 peptídeos candidatos a vacina. (08/06/2020) Cell Reports Medicine

Artigo apresenta o desenvolvimento de um candidato a vacina inativada, BBIBP-CorV, com potente proteção contra SARS-CoV-2. O estudo demonstrou que a vacina parece segura e induziu altos níveis de anticorpos protetores contra SARS-CoV-2 em vários modelos animais (rato, camundongo, coelho, primatas não humanos) (05/06/2020). Fonte: Cell.
05/06/2020
Pesquisadores do Brasil que desenvolvem uma vacina contra o coronavírus Sars-Cov-2 anunciaram que o estudo entrou em uma nova fase pré-clinica. A imunização, que segue um modelo diferente do empregado em outros países será testada em camundongos. O projeto é liderado por cientistas da Faculdade de Medicina da USP e pelo Laboratório de Imunologia do Instituto do Coração (Incor) que já desenvolveram três formulações de vacinas que estão sendo testadas em animais para identificar a melhor candidata. As partículas usadas na vacina são induzidas a carregar fragmentos do novo coronavírus e, assim, gerar uma resposta do corpo humano com segurança. (04/06/2020) Fonte: G1
A Universidade de Oxford anunciou recentemente o início de um teste de Fase II / III da vacina em cerca de 10.000 voluntários adultos, com outros testes em estágio avançado que devem começar em vários países ao redor do mundo (05/06/2020). Fonte: Oxford
Autores argumentam que os estudos de desafio de vacinas poderiam ser conduzidos eticamente sem diminuir os padrões científicos e éticos e merecem séria consideração na pandemia da COVID-19, na qual o número de mortes continua a crescer (04/06/2020). Fonte: Vaccine.
Estudo usando conjuntos de peptídeos lineares de células B sobrepostos, foram relatadas duas regiões imunodominantes de IgG na glicoproteína S de SARS-CoV-2 que são reconhecidas pelos soros de pacientes convalescentes da COVID-19 (S14P5 e S21P2). Um deles é específico para SARS-CoV-2, e está localizado próximo ao domínio de ligação ao receptor. A outra região, localizada no peptídeo de fusão, poderia funcionar potencialmente como um alvo pan-SARS. A identificação e a validação desses epítopos neutralizantes de células B fornecem insights sobre o design de diagnósticos e candidatos a vacina contra esse coronavírus. (01/06/2020) Fonte: Nature Communications
Estudo apresenta as potenciais limitações para o desenvolvimento da vacina SARS-CoV-2 com base na previsão de epítopos de células T in silico. Os autores discutem que os algoritmos de previsão de epítopos de células T são uma ferramenta eficaz para diminuir a carga potencial de imunogênico em uma futura vacina SARS-CoV-2 a partir do proteoma viral total. No entanto, o tamanho os epítopos analisados é altamente variável e os algoritimos provavelmente perdem respostas importantes (04/06/2020). Fonte: PLoS Pathogens
04/06/2020
Artigo descreve as estratégias e metas adotadas atualmente no desenvolvimento de uma vacina contra a SARS-CoV-2. Com base em evidências e experiência anteriores com SARS e MERS, o foco principal tem sido a proteína Spike, considerada como o alvo ideal para imunoterapias com COVID-19(03/06/2020). Fonte: Journal of Translational Medicine
Uma vez que a imunidade treinada tem sido demonstrada para conferir proteção contra uma grande variedade de patógenos, incluindo bactérias, fungos, vírus e protozoários, artigo faz análise do número de casos positivos e óbitos em diferentes países e correlaciona com a inclusão da vacinação BCG ao nascer em seus programas nacionais de vacinação. Curiosamente, os países onde a vacinação BCG é dada ao nascimento têm mostrado uma menor taxa de contágio e menos mortes relacionadas ao COVID-19, sugerindo que esta vacina pode induzir imunidade treinada que poderia conferir alguma proteção para SARS-CoV-2. (08/05/2020) Fonte: Frontiers in immunology
03/06/2020
O Brasil foi um dos países escolhidos para testar a eficácia da vacina desenvolvida pela Universidade de Oxford contra a Covid-19. A aprovação do procedimento por parte da Anvisa (Agência Nacional de Vigilância Sanitária) foi publicada no Diário Oficial. Para a etapa dos testes em São Paulo, a Unifesp irá recrutar mil voluntários que estejam na linha de frente do combate à COVID-19, uma vez que estão mais expostos à contaminação. Eles precisam ser soronegativo, ou seja, pessoas que não tenham contraído a doença anteriormente (03/06/2020). Fonte: ANVISA, Unifesp
02/06/2020
Inicia-se a fase II/III de testes clínicos da vacina OXFORD para a COVID-19. Os pesquisadores estão recrutando voluntários para a nova fase de pesquisa, em que pelo menos 10 mil pessoas serão vacinadas em todo o país para averiguar a eficácia do produto (22/05/2020). Fonte: Oxford
Nova candidata a vacina, Biovacc-19, desenvolvida por pesquisadores noruegueses e ingleses, está em estágio pré-clínico avançado, já tendo sido aprovada nos testes de toxicidade. A vacina é baseada em uma proteína quimérica do vírus (proteína S) associada a um adjuvante capaz de ativar a resposta imune inata bem como a resposta imune mediada por células (02/06/2020) Fonte: QRB Discovery
01/06/2020
Equipe da Fiocruz MG, em parceria com outras instituições, como a UFMG, o Instituto Butantã, a USP e a Faculdade de Medicina de Ribeirão Preto, trabalha em vacina brasileira para COVID-19. A Vacina em desenvolvimento usa como base o vírus influenza recombinante, apresentando uma proteína imunogênica do SARS-CoV-2. A vacina deve entrar em testes clínicos somente no ano que vem (31/05/2020). Fonte: Agencia Brasil
Artigo apresenta a bactéria pertencente ao grupo de bactérias do ácido láctico (BAL) Lactobacillus plantarum modificada geneticamente de modo a expressar a proteína S do SARS-CoV-2. Foi demonstrado que a proteína expressa é estável em altas temperaturas e em pH baixo, sugerindo que a cepa recombinante construída poderia funcionar como uma vacina oral contra o coronavirus. (30/05/2020) Fonte: International Journal of Biological Macromolecules
29/05/2020
Artigo apresenta o desenho de uma vacina multiepítopos baseada na proteína E (proteína do envelope viral) do SARS-CoV-2 através de técnicas de bioinformática. Foram selecionados 10 peptídios que se ligam a MHC classe I e MHC classe II com cobertura populacional de 88.5 e 99.99% respectivamente. A vacina precisa ainda ser validade clinicamente para identificar a segurança e perfil imunogênico. (11/05/2020) Fonte: BioMed Research International
O estudo apresenta a hipótese de desenvolvimento de uma nova vacina RABV não replicante projetada para conter proteínas quiméricas do capsídeo como a proteína S contendo domínios que poderiam ter efeito de neutralizar especificamente a entrada do SARS-CoV-2 nas áreas do SNC (28/05/2020).Fonte: MEDICAL SCIENCE MONITOR
28/05/2020
A Merck®, uma das maiores empresas farmacêuticas anunciou que fechou acordos para desenvolver e fabricar duas vacinas diferentes para COVID-19 e um composto antiviral experimental muito discutido que já está em testes clínicos iniciais (26/05/2020). Fonte: Science
27/05/2020
Estudo identifica uma resposta de linfócitos CD4 e CD8 em indivíduos não expostos ao Sars-Cov-2, o que sugere que a resposta está numa reação cruzada aos outros quatro coronavírus comuns na população mundial, e que representam cerca de 20% dos casos de resfriados comuns. Os achados reforçam a hipótese de que a defesa não está relacionada a anticorpos e sim à ação de células “de memória” do sistema imunológico, os linfócitos CD4 e CD8. (20/05/2020) Fonte: Cell
Revisão traz as novas descobertas e os principais desafios para o tratamento da COVID-19. Além de detalhar a doença em termos de transmissão, sintomas, genômica e virologia; também traz informações sobre algumas opções terapêuticas proeminentes e seus alvos, assim como sobre as vacinas que estão sendo desenvolvidas (26/05/2020). Fonte: Applied Sciences

26/05/2020
Revisão, sobre as vantagens e desvantagens dos candidatos à vacina para SARS-CoV prospecção de estratégias para o desenvolvimento de vacinas seguras para coronavírus, eficazes e de amplo espectro para prevenção de infecção pela circulação atual de SARS-CoV-2 e outros coronavírus que podem causar futuras epidemias ou pandemias (11/05/2020). Fonte: Microbes and Infection
25/05/2020
Artigo apresenta testes de vacinas contra o coronavírus que apresentaram seus primeiros resultados. Segundo autores, à medida que as vacinas contra o coronavírus avançam no desenvolvimento, os cientistas estão analisando pela primeira vez os dados que sugerem sobre a eficácia das diferentes vacinas. Por fim, o artigo revela que a equipe de Oxford já inscreveu mais de 1.000 pessoas em seu teste no Reino Unido. Alguns voluntários receberam um placebo e o estudo pode permitir que, nos próximos meses, os pesquisadores determinem se a vacina funciona em humanos. No primeiro momento, não houve problemas relacionados à segurança desta vacina no estudo anterior com macacos realizada pela equipe (19/05/2020). Fonte: Nature
22/05/2020
Estudo descreve que vacina para COVID-19 com vetor Ad5 apresenta boa tolerância e é imunogênica em 28 dias após a vacinação. As respostas humorais contra a SARS-CoV-2 atingiram o pico no dia 28 após a vacinação em adultos saudáveis e as respostas rápidas específicas das células T foram observadas a partir do dia 14 após a vacinação. Os resultados sugerem que a vacina COVID-19 com vetor Ad5 merece mais investigação (22/05/2020). Fonte: The Lancet
Artigo discute desenvolvimento de vacinas e o que pode ser aprendido com exemplos de desenvolvimento de vacinas no passado. O artigo é otimista em relação ao rápido desenvolvimento de uma vacina contra COVID-19. (21/05/2020) Fonte: European Journal of Immunology
21/05/2020
Pesquisadores projetam uma vacina sintética para gerar uma vacina sintética à base de DNA direcionada à proteína Spike (S) do coronavírus. A construção projetada, INO-4800, resulta em expressão robusta da proteína S in vitro. Após a imunização de camundongos e porquinhos-da-índia com INO-4800, mediu-se as respostas de células T específicas ao antígeno, anticorpos funcionais que neutralizam a infecção por SARS-CoV-2 e bloqueiam a ligação da proteína Spike ao receptor ACE2 e biodistribuição de anticorpos para o SARS-CoV-2 para os pulmões. Este conjunto de dados preliminar identifica o INO-4800 como um potencial candidato à vacina contra a COVID-19 (20/05/2020). Fonte: Nature Communications
20/05/2020
Estudo que utiliza método de vacinologia reversa e imunoinformática para desenvolver uma vacina de sub-unidade baseada em epítopo contra o vírus SARS-CoV-2. Três possíveis vacinas foram desenhada e uma foi selecionada como a melhor. Para a vacina selecionada foi realizada a simulação da dinâmica molecular e os experimentos de adaptação do códon in silico para verificar a estabilidade biológica e encontrar uma estratégia eficaz de produção em massa (11/05/2020). Immunobiology
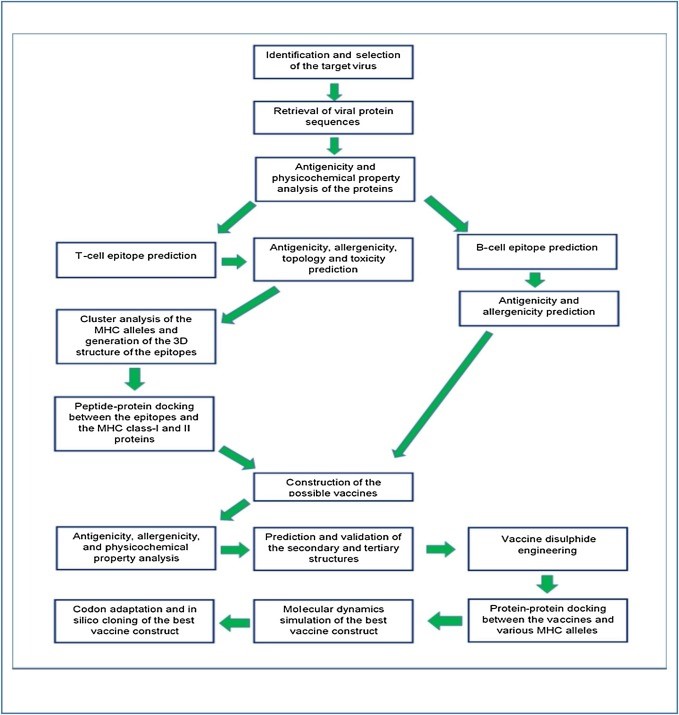
19/05/2020
Estudos de modelagem delimitaram uma candidata a vacina que foi projetada in silico composta de 425 aminoácidos, incluindo o adjuvante da proteína ribossômica 50S onde a construção foi validada computacionalmente em termos de antigenicidade, alergenicidade e estabilidade, considerando todos os parâmetros críticos. Os resultados da simulação imune mostraram uma resposta significativa e confirmaram que a construção final da vacina do peptídeo quimérico poderia melhorar a resposta imune contra o nCoV-19 (18/05/2020). Fonte: Journal of Biomolecular Structure and Dynamics
Estudo investiga os possíveis efeitos da vacinação BCG no curso das pandemias COVID ‐ 19. Pesquisadores analisaram os cronogramas de vacinação de 51 países e compararam com os números confirmados de casos e mortes de COVID ‐ 19 no Relatório de Situação Diária da Organização Mundial da Saúde (OMS) em 16 de abril de 2020. Na análise, a média da proporção de casos por população é estatisticamente significativamente menor nos países vacinados com BCG (n = 138) do que nos países não vacinados com BCG (n = 37) globalmente. Além disso, a taxa média de mortes por população é significativamente menor nos países vacinados com BCG (24/04/2020). Fonte: Allergy
Artigo da Nature Biotechnology discorre sobre novas linhas de combate à COVID-19 e analisa estudos sobre os pontos de contato entre o SARS-CoV-2 e as proteínas humanas e como esses tipos de estudo estão ajudando cientistas a identificar fármacos que poderiam agir sobre essas interações e assim revelar novos alvos terapêuticos e levar a melhor entendimento da resposta do corpo à infecção (15/05/2020). Fonte: Nature Biotechnology
18/05/2020
A empresa americana de biotecnologia Moderna anunciou nesta segunda-feira (18) ter obtido resultados "positivos preliminares" na fase inicial de ensaios clínicos de sua vacina contra o novo coronavírus. Os testes foram feitos em um pequeno número de voluntários.
Segundo a empresa, a vacina produziu resposta imune em oito pacientes que a receberam. A Vacina da Moderna é uma das 8 vacinas em fase de testes clínicos. Segundo a empresa, a vacinação com o mRNA-1273 produz uma resposta imune da mesma magnitude que a provocada por infecção natural. A fase 3, testando mais pessoas, começará em julho. (18/05/2020) Fonte: G1
Artigo revela que o grupo de Oxford que desenvolvia uma vacina para MERS fizeram uma adaptação no que já vinham desenvolvendo para uma adaptação para SARS-CoV-2 recebendo o nome de ChAdOx1 nCoV- 19. O resultado em animais foi muito bem e agora já está sendo testada em Humanos (17/05/2020). Fonte: O Globo
15/05/2020
A análise de patentes de produtos biológicos relacionados ao coronavírus inclui anticorpos terapêuticos, citocinas e terapias baseadas em ácidos nucléicos visando a expressão gênica do vírus, bem como vários tipos de vacinas. Mais de 500 patentes divulgam metodologias desses quatro produtos biológicos com potencial para tratar e prevenir infecções por coronavírus, que podem ser aplicáveis ao COVID-19. As informações incluídas neste relatório fornecem uma forte base intelectual para o desenvolvimento contínuo de agentes terapêuticos e vacinas (12/03/2020). Fonte: ACS Publications
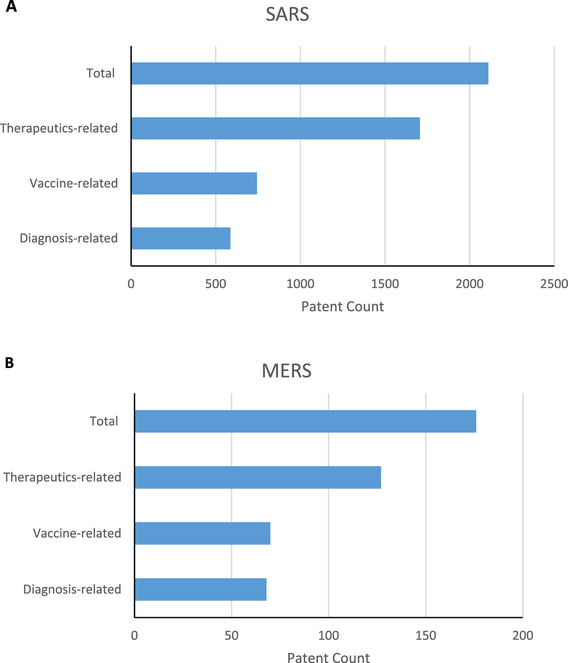
A urgente necessidade do desenvolvimento de uma vacina para a COVID-19 exige a colaboração entre empresas farmacêuticas e biotecnológicas, muitas das quais com abordagens estratégicas diferentes. O caminho a ser percorrido para a obtenção da vacina eficaz para o SARS-CoV-2 exigirá ainda, a colaboração entre indústria, governos e academia de maneira sem precedentes, na qual cada um deverá contribuir com seu potencial. O artigo discute características de plataformas que podem conduzir a estudos que gerem dados eficazes e seguros para diversas candidatas a vacinas em paralelo, de forma a acelerar a sua autorização sanitária e a distribuição (11/05/2020). Fonte: Science.
14/05/2020
Estudo realizado em Israel compara duas populações similares mas diferentes em relação à vacinação por BCG. Indivíduos que nasceram 3 anos antes e indivíduos que nasceram 3 anos depois de interrompido o programa nacional de vacinação de BCG em Israel (que ocorreu em 1982). Foram analisados 72.060 testes não sendo possível observar diferença significativa entre os grupos, indicando que não há indício de que a vacinação por BCG na infância tenha efeitos contra a COVID-19 em adultos. (13/05/2020) Fonte: JAMA
Artigo apresenta uma revisão sobre o desenho racional de novas vacinas, elencando os problemas que podem ser encontrados e discutindo estratégias para vacinas para pan-coronavirus (vacinas capazes de conter múltiplos betacoronavirus, de modo a serem eficientes não só para este surto) com base nas experiências com HIV e influenza. (13/05/2020) Fonte: Cell Host & Microbe
Os autores discutem como estudos anteriores do SARS-CoV do MERS-CoV viabilizaram um rápido desenvolvimento de vacinas candidatas para o SARS-CoV-2, e faz uma análise do pipeline e discute os desafios desse desenvolvimento rápido de vacinas durante a pandemia visto que este ritmo acelerado eclipsou alguns estudos básicos fundamentais e translacionais que guiam o desenvolvimento de novas vacina em circunstâncias não pandêmicas (13/05/2020). Fonte: Cell Host & Microbe
Carta ao editor resume os achados recentes em relação à função, estrutura e imunogenicidade da proteína S, das mutações que estão surgindo e suas implicações para desenvolvimento de vacinas e novos tratamentos (13/05/2020). Fonte: Allergy
12/05/2020
A vacinação com BCG tem sido reportada como capaz de diminuir a suscetibilidade do organismo a infecções do trato respiratório. Uma revisão da revista Nature discute os efeitos benéficos não específicos da BCG contra infecções virais e se a vacina teria a capacidade de proteção frente à COVID-19. (11/05/2020) Fonte: Nature Reviews Immunology
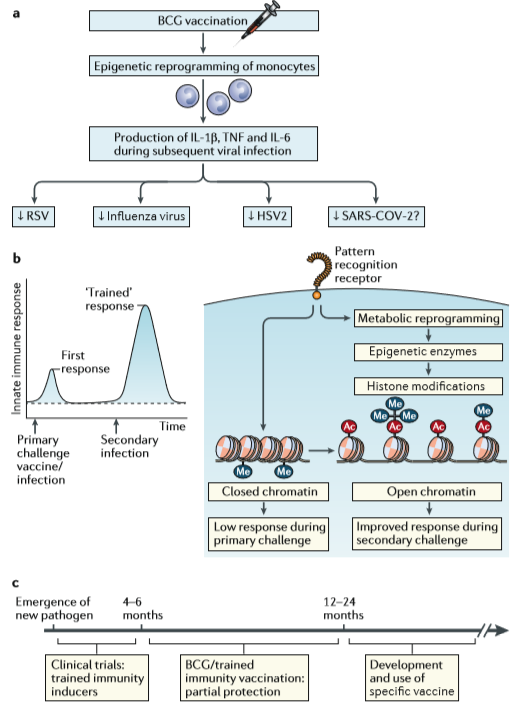
10/05/2020
Panorama do desenvolvimento de vacinas no mundo: empresas e cientistas de Universidades que se empenham em encontrar a cura para a COVID-19 (08/05/2020). Fonte: BloombergBusinessweek.
08/05/2020
Estudo baseado em imunoinformática e estratégias de virologia estrutural propõe a primeira vacina multi-epítope usando a proteína 3CL hidrolase do SARS-CoV-2, essencial para maturação do vírus. A vacina com estrutura 3D de alta qualidade multi-epítope pode estimular o desenvolvimento de uma vacina para o controle da infecção por SARS-CoV-2 (07/05/2020). Fonte: Journal of Medical Virology
Revisão descreve os principais recursos genéticos que estão sendo considerados para gerar candidatos a vacinas, empregando tecnologias inovadoras, contra COVID-19. Também destaca os esforços globais que estão sendo realizados para fornecer vacinas para o COVID-19 por meio de cooperação internacional sem precedentes e desafios futuros após o desenvolvimento (07/05/2020). Fonte: Journal of Biosciences
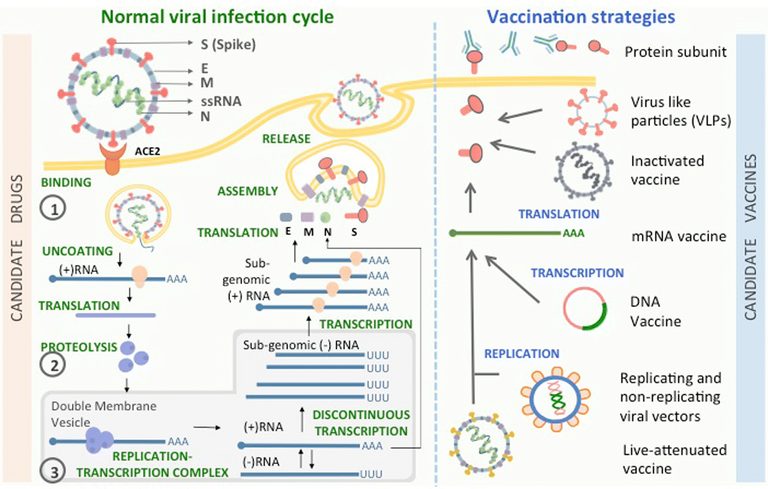
07/05/2020
O estudo revela em escala piloto uma candidata à vacina do SARS-CoV-2 purificada e inativada (PiCoVacc) que induziu anticorpos neutralizantes específicos do SARS-CoV-2 em camundongos e primatas. Estes anticorpos neutralizaram 10 estirpes de SARS-CoV-2 sugerindo uma possível capacidade de neutralização mais ampla (06/05/2020). Fonte: Science
06/05/2020
Pesquisadores do Butantan combinam técnicas de biotecnologia para formular vacina contra COVID-19. A iniciativa visa produzir uma solução acelular, que estimula a resposta imune do organismo por meio da injeção de membranas orgânicas com proteínas da superfície do vírus. (03/05/2020) Fonte: FAPESP
Autores do artigo fazem uma apresentação do racional científico para o desenvolvimento de vacinas baseadas em RNA mensageiro. Apontam a necessidade de cooperação internacional e apresentam o status da vacina mRNA-1273 (05/05/2020) Fonte.: Med Sci Monit
Artigo discute a busca por anticorpos para serem empregados em uma vacina contra o SARS-CoV-2 (05/5/2020). Fonte: Science
Pesquisadores relatam um anticorpo monoclonal humano que neutraliza a SARS-CoV-2 (e SARS-CoV) na cultura de células. Este anticorpo neutralizante cruzado tem como alvo um epítopo comunitário sobre esses vírus e pode oferecer potencial para prevenção e tratamento de COVID-19. Observou-se que o anticorpo 47D11 humano liga-se a células que expressam as proteínas de pico de comprimento total de SARS-CoV e SARS-CoV-2. Os dados mostram que 47D11 neutraliza SARS-CoV e SARS-CoV-2 através de um mecanismo ainda desconhecido que é diferente da interferência de ligação ao receptor (04/05/2020). Fonte: Nature Communications
05/05/2020
Reportagem do NYT discute o tempo real para que uma vacina para a COVID-19 chegue à população. O texto discute as características e os desafios das diferentes etapas do processo, além dos custos de se desprezar os passos necessários para o desenvolvimento de uma vacina segura e eficaz (30/04/2020). Fonte: NYT.
Pfizer anuncia início de testes da vacina para COVID-19 desenvolvida em parceria com a BioNTech. A vacina contém material genético RNA mensageiro e os testes serão realizados nos Estados Unidos (05/05/2020). Fonte: Forbes.
O Instituto de Pesquisa Biológica de Israel (IIBR) concluiu um desenvolvimento científico inovador, identificando um anticorpo que neutraliza o coronavírus, o SARS-CoV-2, abrindo caminho para a vacina contra o COVID-19. O anticorpo é monoclonal, novo e refinado e contém uma proporção excepcionalmente baixa de proteínas nocivas; o instituto demonstrou a capacidade do anticorpo de neutralizar o novo coronavírus; e o anticorpo foi testado especificamente no coronavírus agressivo (05/05/2020). Fonte: The Jerusalem Post
Grupo indiano apresenta uma vacina recombinante baseada em múltiplos epítopos de três proteínas principais do vírus, Proteína do nucleocapsideo, Glicoproteina de membrana e glicoproteína de superfície (proteína Spike). São 33 epítopos altamente antigênicos. Os dados computacionais preveem que a vacina é imunogênica, capaz de estimular a resposta imune humoral bem como a mediada por células. No entanto não foram realizados testes ainda (04/05/2020) Fonte: Microbial Pathogenesis
Artigo faz uma revisão das vacinas em desenvolvimento e os avanços tecnológicos em design de novas vacinas que permitem o desenvolvimento mais rápido de nova vacina para COVID-19 (04/05/2020). The Journal of Infectious Diseases
04/05/2020
As vacinas de células T contra SARS-CoV-2 estão sendo desenvolvidas em ritmo acelerado, mas é imperativo que as proteínas ou peptídeos que eles entregam se liguem a uma grande variedade de haplótipos de HLA na população global. Usando uma ferramenta computacional projetada para prever não-antígenos candidatos a vacinas contra o câncer, a pré-impressão identifica 12 dos epítopos de SARS-CoV-2 correspondentes aos epítopos de SARS-CoV que demonstraram gerar respostas ex vivo e invitro (28/04/2020). Fonte: Nature reviews immunology
Merck e o Jenner Institute anunciam as bases para produção em larga escala de sua candidata a vacina para COVID-19, ChAdOx1 nCoV-19. A velocidade é um grande desafio ao enfrentar um novo surto como esta pandemia sem precedentes do COVID-19. Com os pacientes inscritos em ensaios clínicos para esta vacina, o rápido desenvolvimento do processo de fabricação em larga escala é uma etapa crítica para a entrega rápida e segura do laboratório aos pacientes (14/04/2020). Fonte: Merck.
01/05/2020
Pesquisador afirma que vários estudos estão em andamento para determinar o efeito da vacinação BCG na proteção contra COVID-19, incluindo em duas populações de alto risco. Primeiro, os ensaios clínicos na Austrália, na Holanda e nos EUA visam testar se a vacinação com BCG dos profissionais de saúde pode protegê-los do COVID-19. Segundo, estão em andamento estudos para testar o efeito da vacinação com BCG na prevenção da infecção grave por COVID-19 entre idosos. Finalmente, um estudo na Alemanha está testando se o VPM1002, uma cepa de vacina recombinante derivada do BCG, pode proteger os profissionais de saúde ou pacientes idosos do COVID-1 (27/04/2020). Fonte: Nature Reviews
Os autores avaliam 90 vacinas em estudo e discutem o caminho a ser percorrido para demonstrar sua efetividade e escolha. (30/04/2020). Fonte.: Nature.
Os autores mostram a primeira evidência da eficácia da vacina contra a COVID19 em primatas não humanos. O SARS-CoV-2 isolado de paciente foi expandido e inativado com Beta-propiolactona. Macacus Rhesus foram imunizados e desafiados com o SARS-CoV-2. Os macacos desafiados não apresentaram sintomas e tiveram uma rápida diminuição da carga viral. (30/04/2020) Nature Reviews Immunology.
29/04/2020
Trabalhos anteriores sobre desenvolvimento de vacinas a síndrome do coronavírus respiratório agudo (SARS-CoV) graves identificaram a imunopatologia celular e o aprimoramento dependente de anticorpos como possíveis problemas de segurança no desenvolvimento de novas vacinas. O artigo discute as implicações desses achados para o desenvolvimento da vacina para COVID-19 e cita abordagem para otimizar a segurança e a eficácia (29/04/2020). Nature Reviews Immunology
28/04/2020
Mais de 90 vacinas estão sendo desenvolvidas contra o SARS-CoV-2 por equipes de pesquisa em empresas e universidades de todo o mundo. Os pesquisadores estão testando diferentes tecnologias, algumas das quais nunca foram usadas em uma vacina licenciada antes. Pelo menos seis grupos já começaram a injetar formulações em voluntários em testes de segurança; outros começaram a testar em animais. O guia gráfico da Nature explica cada design de vacina (28/04/2020). Fonte: Nature
23/04/2020
Cientistas Ingleses sugerem que a vacina tríplice pode conferir proteção contra a infecção pelo coronavírus, o mecanismo seria por conta da homologia estrutural das espículas. Casos se confirme o grupo sugere a vacinação de grupos de risco (10/04/2020). Fonte: Medrxviv
A vacina COVID-19 Chinese biotech reports em desenvolvimento protegeu um animal, o macaco rhesus, da infecção pelo novo coronavírus, relatam os cientistas. A vacina, uma formulação antiquada que consiste em uma versão quimicamente inativada do vírus, não produziu efeitos colaterais óbvios nos macacos, e os testes em humanos começaram em 16 de abril (23/04/2020). Fonte: Science
A fim de disponibilizar uma vacina que têm o potencial contra o coronavírus mais rapidamente do que os ensaios padrão, 1daySooner, propõe o estudo controverso da vacina "desafio humano" e centenas de pessoas se voluntariam para serem infectadas com coronavírus. Pesquisadores explicam que os testes típicos de vacinas demoram muito tempo, porque milhares de pessoas recebem uma vacina ou um placebo, e os pesquisadores rastreiam quem fica infectado no decorrer de suas vidas diárias. O estudo de desafio poderia, em teoria, ser muito mais rápido: um grupo muito menor de voluntários receberia uma vacina candidata e depois seria intencionalmente infectado com o vírus, para julgar a eficácia da imunização. (22/04/2020). Fonte: Nature
22/04/2020
OMS publica a lista atualizada das vacinas de COVID-19 em desenvolvimento clínico e pré-clínicos (22/04/2020). Fonte: OMS
A Alemanha deu luz verde para testes de possíveis vacinas contra o coronavírus em humanos desenvolvidas pela empresa de biotecnologia alemã BioNTech, que está disputando com equipes da própria Alemanha, dos Estados Unidos e da China para criar um agente que detenha a pandemia. O teste será feito com 200 pessoas saudáveis. A BioNTech afirmou que está desenvolvendo quatro candidatas a vacina através de um programa batizado de BNT162 com sua parceira, a gigante farmacêutica Pfizer. (22/04/2020) Fonte: Agencia Brasil
21/04/2020
A Vaxart Inc, um laboratório de biotecnologia dos Estados Unidos, que desenvolve vacinas recombinantes orais, administradas por comprimido e por injeção, anunciou nesta terça-feira (21) que obteve resultados clínicos positivos na aplicação da vacina contra a Covid-19 (21/04/2012) Fonte: Vaxart
Vacina contra o Coronavírus será testada no Reino Unido a partir de quinta-feira. A pesquisa foi desenvolvida pela Universidade Oxford. Se for bem-sucedida, a partir de setembro, milhões de doses poderão estar disponíveis. (21/04/2020) Fonte: Reuters
A pandemia da COVID-19 demonstra uma clara necessidade do desenvolvimento de uma vacina. Níveis mais altos de apoio público sustentado, desenvolvimento tecnológico e coordenação com as partes interessadas do setor privado são essenciais para modernizar o processo de desenvolvimento da vacina. Ao mesmo tempo, deve ser garantida a segurança nacional e internacional da saúde, de forma que seja alcançada a proteção populacional o mais rápido possível, uma vez desenvolvida uma vacina segura e eficaz (20/04/20). Fonte: Vaccine
18/04/2020
A Sanofi contribuirá com o antígeno COVID-19 da proteína S, que é baseado na tecnologia de DNA recombinante. Essa tecnologia produziu uma correspondência genética exata com as proteínas encontradas na superfície do vírus, e a sequência de DNA que codifica esse antígeno foi combinada no DNA da plataforma de expressão do baculovírus, a base do produto influenza recombinante licenciado pela Sanofi nos EUA. A GSK disponibilizará sua comprovada tecnologia adjuvante pandêmica. O uso de um adjuvante pode ser de particular importância em uma situação de pandemia, pois pode reduzir a quantidade de proteína da vacina necessária por dose, permitindo que mais doses de vacina sejam produzidas e, portanto, contribuindo para proteger mais pessoas (18/04/2020). Fonte: GSK
17/04/2020
Estudo revela que uma proteína recombinante, conhecida como RBD219-N1, formulada em 2016 como Alhydrogel® tem do domínio de ligação a receptores SARS-CoV (RBD) e induz anticorpos neutralizantes de alto nível e imunidade protetora com o mínimo imunopatologia em camundongos com o vírus homólogo com SARS-CoV (cepa MA15). Os autores sugerem que estas proteínas poderiam ser reaproveitadas como uma vacina heteróloga contra a doença infecciosa do COVID-19 (16/04/2020). Fonte: Journal Human Vaccines & Immunotherapeutics.
15/04/2020
Pesquisadores sugerem que a vacina contra a hepatite A pode ajudar a manter a infecção por COVID-19 nos níveis de colonização da mucosa e impedir o envolvimento e a fatalidade do trato respiratório inferior (09/04/2020). Fonte: Experimental and Clinical Transplantation
13/04/2020
Nature Reviews fornece panorama atualizado dos projetos de desenvolvimento de vacinas para COVID-19 como forma de contribuir com cientistas e autoridades de saúde empenhados em encontrar a solução para a pandemia (09/04/20). Fonte Nature Reviews
Uma vacina contra a COVID-19 desenvolvida por cientistas italianos e britânicos começará a ser testada em seres humanos no fim de abril, no Reino Unido, em um grupo de 550 voluntários saudáveis. O medicamento é fruto de uma parceria entre a empresa italiana Advent-IRBM, de Pomezia e o Instituto Jenner, da Universidade de Oxford. (13/04/2020) Fonte: Estado de Minas
Nature Reviews fornece panorama atualizado dos projetos de desenvolvimento de vacinas para COVID-19 como forma de contribuir com cientistas e autoridades de saúde empenhados em encontrar a solução para a pandemia (09/04/20). Fonte Nature Reviews
Uma vacina contra a COVID-19 desenvolvida por cientistas italianos e britânicos começará a ser testada em seres humanos no fim de abril, no Reino Unido, em um grupo de 550 voluntários saudáveis. O medicamento é fruto de uma parceria entre a empresa italiana Advent-IRBM, de Pomezia e o Instituto Jenner, da Universidade de Oxford. (13/04/2020) Fonte: Estado de Minas
12/04/2020
Estudos epidemiológicos sugerem que em Países nos quais se adota política de vacinação universal de BCG (vacina para controle de tuberculose) a morbidade e mortalidade da COVID-19 é reduzida. Assim, há evidências para o desenvolvimento de testes clínicos controlados para o controle da gravidade da COVID-19 através da vacinação da BCG.Veja em:
Dayal, D & Gupta, S: Connecting BCG Vaccine and COVID-19: Additional Data (Brief Report), 08/04/20.
Miller, A et al: Correlation Between Universal BCG Vaccination Policy and Reduced Morbidity and Mortality for COVID-19: An Epidemiological Study, 28/03/2020.
Hegart, PK et al: BCG Vaccination May Be Protective Against COVID-19, 03/2020.
10/04/2020
O Instituto de Pesquisa de Vacinas e Soro de São Petersburgo da Agência Federal de Biologia Médica disse que sua vacina contra a nova infecção por COVID-19 foi incluída na lista de vacinas promissoras da Organização Mundial da Saúde (07/04/2020). Fonte: The General Digital-Partner
09/04/2020
Cientistas Israelenses estão desenvolvendo vacina oral para o coronavirus. Nos testes pré-clínicos a vacina induziu a formação de altos níveis de anticorpos. (07/04/2020) Fonte: The Jerusalem Post
08/04/2020
Quatro candidatos a vacinas foram aprovados para testes clínicos nos Estados Unidos, China e Reino Unidos (08/04/2020). Fonte: The Scientist
OMS aponta Fiocruz como referência nas Américas e poderá receber amostras de outros países para fazer testes de COVID-19 e aprofundar estudos que podem levar à vacina. Apenas o Centro de Controle de Prevenção de Doenças (CDC), ligado ao Governo dos Estados Unidos, atua como referência da OMS para combate ao novo coronavírus no continente americano. Fonte: OGlobo. Veja em Vacinas
A partir das informações obtidas no estudo publicado pela American Chemical Society, a ABIFINA apresenta um levantamento das patentes correspondentes brasileiras de vacinas que possam ser utilizadas na pandemia de COVID-19 (08/04/2020). Fonte: ABIFINA
07/04/2020
CTNBio aprova estudo do CNPEM com partículas geneticamente modificadas da COVID-19. Trabalho consiste na produção de partículas similares ao vírus com o objetivo de identificar moléculas que possam inibir a infecção pelo novo coronavirus. (07/04/2020) Fonte: MCTIC
06/04/2020
Pesquisadores da Fiocruz Minas estão integrando uma rede do Instituto Nacional de Ciência e Tecnologia em Vacinas (INCTV) para o desenvolvimento de uma vacina contra o novo coronavírus (Sars-CoV-2). O estudo terá como base uma técnica elaborada pelo Grupo de Imunologia de Doenças Virais da Fiocruz Minas, que utiliza o vírus da influenza para gerar resposta imunológica contra o novo coronavírus. (06/04/2020) Fonte: Fiocruz Minas
03/04/2020
Pesquisadores da Universidade de Pittsburg, Pensilvânia (EUA), revelam a mais nova vacina candidata ao combate ao coronavírus. A vacina, aplicada através de uma matriz de microagulhas (MNA), foi capaz de estimular (em camundongos) a produção de anticorpos suficientes para a neutralização do SARS-CoV-2 duas semanas depois da aplicação. O estudo é animador, mas ainda requer acompanhamento a longo prazo dos animais e testes em humanos (03/04/2020). Fonte: EBioMedicine (in Press)
02/04/2020
A ANVISA suspendeu temporariamente os efeitos da RDC 302/2005 que Dispõe sobre Regulamento Técnico para funcionamento de Laboratórios Clínicos, para que os Laboratórios Federais de Defesa Agropecuária possam realizar análises para o diagnóstico da COVID-19 (02/04/2020). Fonte: ANVISA
Fiocruz incluiu dia 31/3 o primeiro paciente no ensaio clínico "Solidarity", da OMS dando início à pesquisa em 18 hospitais de 12 estados. Em um primeiro momento serão testados: a cloroquina, o Remdesivir, a combinação liponavir e ritonavir, isolado ou combinado ao Interferon Beta 1a. (02/04/2020) Fonte: FIOCRUZ
Os pesquisadores Jia Xy e Yunfei Zhang mostram que a China vem utilizando Medicina Tradicional Chinesa (MTC) nos hospitais para apoiar o tratamento do COVID-19. Esses medicamentos fitoterápicos já foram usados para prevenir e tratar a SARS e a infecção causada pelo H1N1 e neste momento mostra reduzir os sintomas de pacientes contaminados pelo COVID19. Como preventivo é usado o Yupingfeng San. No suporte do tratamento clínico dos pacientes com infecção leve são usados o Sangju yin (casos com tosse grave) e Yinqiao san (casos de febre alta). Em casos de infecções graves são usados Maxingshigan tang (decocção) e Baihegujin tang, que ajudam o pulmão na expulsão do catarro e na obtenção de ar. O artigo mostra a composição dos medicamentos (02/04/2020). Fonte: Complementary Therapies in Clinical Practice
Os pesquisadores Yang Yand e colaboradores afirmam que mais de 85% dos pacientes infectados com SARS-CoV-2 na China estão recebendo tratamento com Medicina Tradicional Chinesa (MTC). No estudo, as literaturas relevantes publicadas são cuidadosamente revisadas e as aplicações atuais da MTC no tratamento de pacientes com COVID-19 são analisadas. Estudos experimentais atuais que fornecem uma visão do mecanismo subjacente ao efeito terapêutico da MTC, e esses estudos identificaram novos compostos de ocorrência natural com atividade anti-coronaviral. O estudo destaca que há vários relatos de bons reultados em pacientes que utilizam MTC aliada aos tratamentos convencionais, assim estudos clínicos rigorosos estão sendo realizados. O estudo relata ainda a importância de evitar a toxidade dos fitoterápicos e evitar a interferência na eficácia do tratamento convencional causado pela interação erva-droga (02/04/2020). Fonte: IJBS
01/04/2020
Estudo do pipeline de vacinas em desenvolvimento ( status report) (01/04/2020). Fonte: Cell Press
31/03/2020
O instituto de pesquisa biológica de defesa de Israel fez "progresso significativo" no desenvolvimento de uma vacina contra o COVID-19 e, em breve, começará a realizar testes em animais. A empresa israelense de ciências da vida Pluristem Therapeutics disse que administrou células PLX a três pacientes em um programa de uso compassivo para o tratamento do COVID-19. De acordo com a empresa, as células PLX respondem a sinais de estresse químico de tecidos danificados por isquemia (fluxo sanguíneo inadequado), trauma muscular ou inflamação, secretando uma gama de proteínas terapêuticas que acionam os próprios mecanismos de reparo do corpo. O instituto Migal Galilee, financiado pelo Estado, declarou que estava a caminho para início dos testes dentro de algumas semanas (31/03/2020). Fonte: Times of Irael
A empresa Moderna e a CanSino Biologics, da China iniciaram pequeno estudo clínico da vacina contra a COVID-19 para avaliação de segurança e eficácia. Os testes estão sendo realizados na cidade de Seattle (EUA). Este produto ainda não foi lançado no mercado (31/03/2020). Fonte: Science Magazine
30/03/2020
Artigo da The New England Journal of Medicine discute os desafios do longo e caro processo de desenvolvimento de uma vacina, que exige uma sequência linear de etapas, com pausas para análise de dados ou verificações do processo de fabricação. O artigo destaca a necessidade da manutenção de uma rede de investimento global capaz de financiar todo o desenvolvimento e manufatura em larga escala de uma vacina, particularmente em caso de urgência, como numa pandemia. Vários candidatos a vacina para COVID-19 estão sendo testados, como aqueles baseados em DNA e RNA em com subunidades recombinantes (30/03/2020). Fonte: The New England Journal of Medicine
27/03/2020
Empresas em máximo esforço para acelerar o desenvolvimento dos medicamentos experimentais e vacinas para COVID-19. Artigo da Nature apresenta novos tratamentos e vacinas em desenvolvimento e os desafios de cada. Entretanto, o que fica bem claro é que os caminhos convencionais de desenvolvimento clínico são muito longos e árduos para lidar com a atual ameaça à saúde pública. Vários grupos estão em fase de exploração de novas alternativas para encontrar soluções. Fonte: Nature Biotechnology (27/03/2020).
Artigo sobre medicamentos em fase de testes clínicos: Rosa, SGV e Santos, WC identificaram 24 estudos clínicos empregando mais de 20 medicamentos para o tamento da COVID-19. Utilizando a base de dados clinicaltrials.gov, foram listados os estudos que empregavam medicamentos já estudados ou aprovados para outra doença, o que pode representar uma estratégia atraente para se determinar um tratamento eficaz para a doença que, particularmente, exige rapidez. Dentre as vantagens que o estudo de reposicionamento de medicamentos fornece, foram salientadas as seguintes: a) menores custos e menor tempo para se alcançar o mercado, pois as fases I e II dos testes são dispensadas; b) disponibilidade de cadeias de abastecimento para formulação e distribuição do medicamento; c) possibilidade da combinação entre medicamentos (27/03/2020). Fonte: PAHO - ORGANIZAÇÃO PAN-AMERICANA DE SAÚDE
Fiocruz coordenará no Brasil os ensaios clínicos no âmbito do Solidariedade (Solidarity) da OMS. O projeto é uma conjugação de esforços no mundo todo para ajudar os países a prevenir, detectar e responder à pandemia. A meta do Solidariedade é alcançar o maior número de pessoas no tempo mais curto possível. (27/03/2020). Fonte: Fiocruz, OMS, Science Magazine
A ANVISA liberou a pesquisa com a hidroxicloroquina para o tratamento da COVID-19. A licença permite ao Hospital Israelita Albert Einstein e colaboradores avançarem nas pesquisas clínicas em busca da cura dessa doença, com segurança e rapidez. A Agência irá acompanhar os desfechos dos estudos, bem como o cumprimento das Boas Práticas Clínicas. (27/03/2020) Fonte: ANVISA
26/03/2020
OMS publica um cenário da vacinas em desenvolvimento (26/03/2020). Fonte: OMS
24/03/2020
Estratégia usada para desenvolver uma candidata à vacina contra o ebola, elaborada pela farmacêutica americana Flow Pharma em parceria com pesquisadores brasileiros, pode orientar a criação de um imunizante contra o novo coronavírus SARS-CoV-2, causador da COVID-19. Fonte: FAPESP (24/03/2020).
Para ajudar a combater coronavírus a IBM disponibilizou gratuitamente o sistema IBM Clinical Development (IDC), uma plataforma desenvolvida para reduzir o tempo e o custo dos ensaios clínicos, Fonte: COMPUTERWORLD
As respostas de células T para SARS-CoV-2 são fortes e enviesadas em Th1 podem conduzir as respostas imunes humorais protetoras e mediadas por células e podem reduzir o potencial de aumento da COVID-19. As células T citotóxicas eliminam as células hospedeiras infectadas por vírus e contribuem para o controle da infecção. Estudos de pacientes infectados com SARS-CoV-2 sugeriram um papel protetor para as respostas imunes humorais e mediadas por células na recuperação de COVID-19. A vacina ChAdOx1 nCoV-19 (AZD1222) candidata contra SARS-CoV-2 que compreende um adenovírus símio deficiente para replicação que expressa a proteína de pico SARS-CoV-2 de comprimento total. Recentemente, foram relatados dados preliminares de segurança e imunogenicidade de um ensaio de fase 1/2 da vacina ChAdOx1 nCoV-19 (NCT04400838) administrada em regime de uma ou duas doses. A vacina foi tolerada, com indução de anticorpos neutralizantes e células T antígeno-específicas contra a proteína spike do SARS-CoV-2. Estudo descreve análises exploratórias das respostas imunes em adultos, com idade entre 18-55 anos, até 8 semanas após a vacinação com uma dose única de ChAdOx1 nCoV-19 neste estudo, demonstrando uma indução de uma resposta tendenciosa de Th1 caracterizado por interferon-γ e secreção de citocinas do fator de necrose tumoral-α por células T CD4 + e produção de anticorpos predominantemente de subclasses IgG1 e IgG3. Células T CD8 +, de fenótipos monofuncionais, polifuncionais e citotóxicos, também foram induzidas. Tomados em conjunto, esses resultados sugerem um perfil imunológico favorável induzido pela vacina ChAdOx1 nCoV-19, apoiando a progressão desta vacina candidata para estudos de fase 2/3 em andamento para avaliar a eficácia da vacina(17/12/2020). Fonte: Nature Medicine
A agência sanitária dos Estados Unidos, a Food and Drug Administration (FDA), aprovou na última sexta-feira (18/11) uma segunda vacina contra a COVID-19 para aplicação no país, desta vez produzida pela empresa Moderna. Antes da decisão da agência, um painel de consultores do FDA votou na quinta-feira (17/11), por 20 votos a 0 e uma abstenção, pela aprovação desta segunda vacina em território americano, avaliando que os benefícios da vacina superam os risco (18/12/2020). Fonte: BBC
OUTROS TRATAMENTOS
O Instituto Butantan concluiu o desenvolvimento do processo de produção de um soro contra o SARS-CoV-2, o vírus causador da COVID-19. Mais de 2 mil frascos estão prontos para o início dos testes de segurança e eficácia em pessoas. Se apresentar a eficácia esperada na próxima etapa de testes, o soro poderá ser usado para tratar pessoas que apresentem os primeiros sintomas da doença e para bloquear o avanço da infecção. O soro é feito a partir de vírus inativado por radiação, por meio de uma técnica desenvolvida com o Instituto Nacional de Pesquisas Energéticas e Nucleares (Ipen), aplicado em cavalos. Em resposta ao vírus, os animais produzem anticorpos do tipo imunoglobulina G (IgG), extraídos do sangue e purificados de acordo com uma técnica usada no instituto há décadas para produção de outros soros (14/12/2020). Fonte: FAPESP
Resumo de alguns dos principais mAbs atualmente em desenvolvimento e suas evidências que sustentam a administração por inalação de mAb antiviral como intervenção precoce contra COVID-19 que poderia prevenir morbidades pulmonares importantes associadas à infecção (01/12/2020). Fonte: Advanced Drug Delivery Reviews
Em comentário pesquisadores descrevem que os anticorpos neutralizantes (nAbs) podem ser transferidos passivamente para os indivíduos antes ou depois da infecção viral para prevenir ou tratar doenças (as vacinas, por outro lado, estimulam ativamente o sistema imunológico a produzir nAbs específicos do antígeno para prevenir doenças). Os nAbs terapêuticos geralmente existem no corpo por um curto período de tempo e sua eficácia de tratamento depende de uma variedade de fatores, incluindo título do nAb, quantidade total, especificidade e meia-vida. Os pesquisadores descrevem quais os anticorpos neutralizantes, incluindo anticorpos monoclonais (mAbs) e nanocorpos, para SARS-CoV-2 estão atualmente em desenvolvimento pré-clínico e em ensaios clínicos, os mecanismos potenciais dos anticorpos de ação, e as prováveis aplicações clínicas dos mAbs e de soros convalescentes de pacientes que se recuperaram da infecção por SARS-CoV-2 para a prevenção e tratamento da COVID-19 (08/12/2020). Fonte: Nature Biomedical Engineering