Notícias
MEDICAMENTOS
Anvisa disponibiliza consulta de rótulos de medicamentos
A Anvisa acaba de disponibilizar a consulta de rótulos de medicamentos. A iniciativa tem como objetivo facilitar a identificação e o uso seguro de medicamentos. Ao realizar a pesquisa na página de Consultas , o usuário poderá visualizar o s rótulo s atualizado s d os medicamentos registrados pela Agência.
Nesse sentido, é importante esclarecer que as empresas poderão disponibilizar, por meio de peticionamento no Sistema Solicita, os rótulos dos medicamentos registrados e comercializados por elas . A nova funcionalidade do sistema seguirá a mesma lógica utilizada para a inclusão dos textos de bulas e folhetos informativos do Bulário Eletrônico.
Destaca-se que, no momento, esse peticionamento é facultativo. Contudo, a pós a publicação da minuta de revisão da Resolução da Diretoria Colegiada (RDC) 71/2009, ele será obrigatório.
Como incluir o rótulo de um medicamento?
A empresa detentora do registro do medicamento deverá peticionar a inclusão do rótulo por meio do Sistema Solicita , utilizando um dos assuntos abaixo, de acordo com a categoria regulatória do medicamento.
| Código de assunto | Descrição do assunto de petição |
| 11848 | DINAMIZADO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11849 | ESPECÍFICO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11850 | GENÉRICO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11851 | MEDICAMENTO FITOTERÁPICO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11852 | MEDICAMENTO NOVO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11853 | PRODUTO BIOLÓGICO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11854 | SIMILAR - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
| 11855 | RADIOFÁRMACO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
|
12134 |
PRODUTO TRADICIONAL FITOTERÁPICO - Notificação para publicação no Rotulário Eletrônico de Medicamentos |
Além disso, a empresa deverá anexar os seguintes documentos:
1
.
Formulários
de
Petição
(
FP1 e FP2
)
devidamente preenchidos.
2
.
Justificativa da solicitação.
3
.
Layout
de rótulos e embalagens –
o
s arquivos deve
rão
ser anexados em
PDF
e serão exibidos no
Portal de Consultas
.
É importante mencionar que será necessário incluir
um arquivo para cada forma farmacêutica existente no processo de registro.
Imediatamente após o peticionamento, os r ótulos poderão ser visualizad o s no Portal de Consultas .
Como localizar o rótulo de um medicamento?
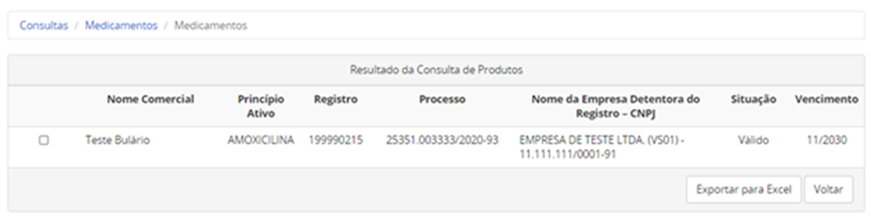
Acesse o link Consultas e preencha pelo menos um dos filtros de busca.
Você pode utilizar mais de um filtro simultaneamente, se assim desejar, para facilitar sua busca. Se quiser localizar o rótulo de um determinado medicamento, a busca apenas pelo nome do medicamento é a mais indicada.
Ao clicar na tela de resultado da consulta, em detalhes do produto, será possível visualizar o arquivo com o r ótulo , caso a empresa tenha realizado o peticionamento.
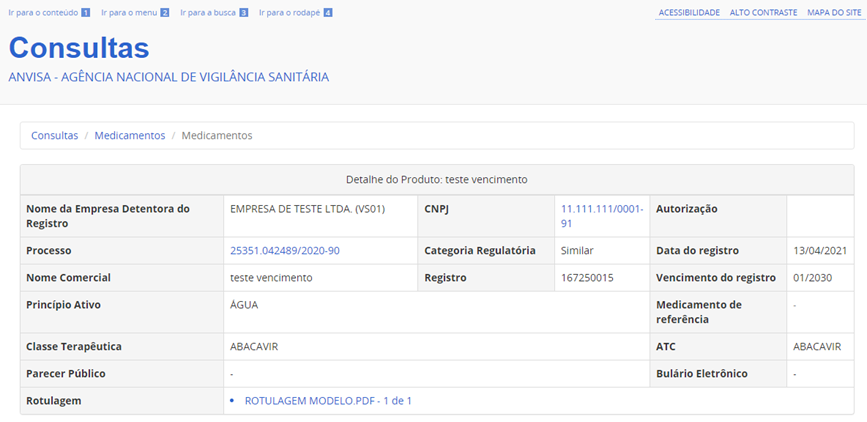
Ressalta-se ainda que a atualização da rotulagem é voluntária e executada diretamente pela empresa detentora do registro do medicamento, que deve declara r que seu conteúdo guarda total concordância com a legislação vigente.
Desmistificando outros códigos de assunto que envolvem rotulagem
Existem outros códigos de assuntos referentes a alterações ou notificações de rotulagem . S aiba quando cada um deles deve ser utilizado:
C ategoria regulatória “ Alteração de rotulagem ” – esse código deve ser utilizado conforme o art. 78 d a RDC 71/2009: “Caso seja identificada a necessidade de incluir alguma informação não prevista nesta Resolução nos rótulos de medicamentos, as empresas deverão peticionar uma alteração de rotulagem acompanhada de justificativa técnica”.
C ategoria regulatória “ Documentação para análise de bula, dizeres de rotulagem e nome comercial ” – esse código deve ser protocolizado como petição secundária , sempre vinculada à petição de registro, conforme disposto na OS 90/20.
C ategoria regulatória “ Inclusão de rotulagem : n ova destinação ” – esse código deve ser protocolizad o como petição terciária à petição de nova destinação comercial, caso esta seja aprovada e a empresa precise alterar a rotulagem conforme nova destinação.
C ategoria regulatória “ Notificação de alteração de rotulagem ” – esse código deve ser utilizado conforme o art. 74 da RDC 71/2009: “São passíveis de notificação de alteração de rotulagem, com implementação imediata sem manifestação prévia da Anvisa, as atualizações de informações nos rótulos a seguir relacionadas” .
C ategoria regulatória “ Notificação de alteração de rotulagem – adequação à RDC 71/2009 ” – esse código deve ser utilizado conforme o art. 80 d a RDC 71/2009: “As empresas devem notificar a adequação da rotulagem, atendendo ao disposto nesta Resolução, e disponibilizar os novos rótulos nas embalagens dos medicamentos fabricados ou importados para venda no mercado nacional em até 540 (quinhentos e quarenta) dias a partir da publicação desta Resolução. (Prazo suspenso pela RDC 26, de 16 de junho de 2011)”.
Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter @anvisa_oficial, Facebook@AnvisaOficial , Instagram @anvisaoficial e YouTube @anvisaoficial