Notícias
COVID-19
Uso emergencial: confira votos, relatório e apresentações da reunião
Por unanimidade, Diretoria Colegiada aprovou autorização temporária de uso emergencial das vacinas CoronaVac e Covishield.
Publicado em
17/01/2021 17h29
Atualizado em
01/11/2022 15h19
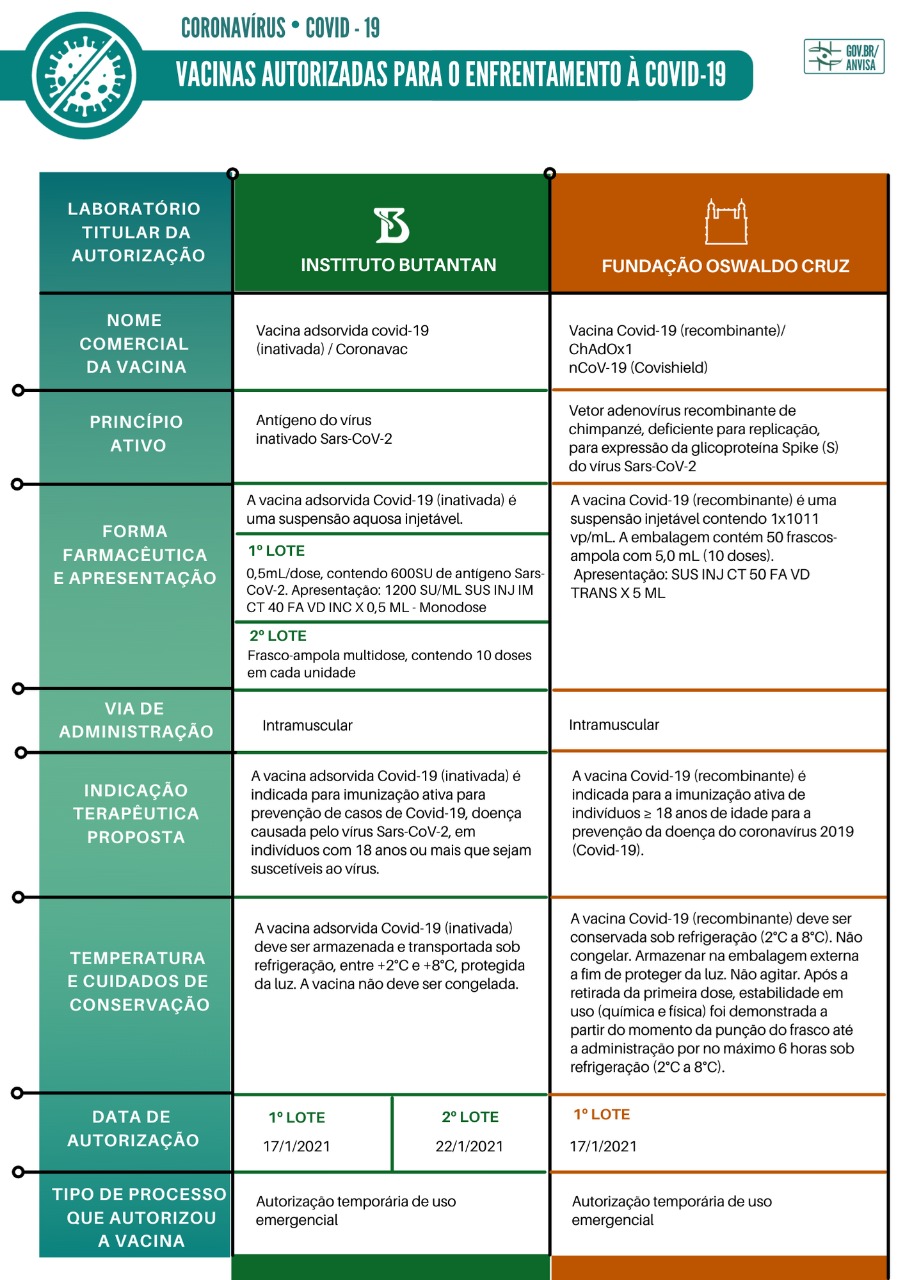
Confira a seguir os materiais utilizados na reunião da Diretoria Colegiada da Anvisa deste domingo (17/1), que decidiu por unanimidade pela autorização temporária de uso emergencial da vacina CoronaVac, desenvolvida pela farmacêutica Sinovac em parceria com o Instituto Butantan, e da vacina Covishield, produzida pela farmacêutica Serum Institute of India, em parceria com a AstraZeneca/Universidade de Oxford/Fiocruz. Confira a seguir os materiais apresentados durante a reunião:
- Relatório - Bases técnicas para decisão do uso emergencial
- Apresentação CoronaVac
- Apresentação Covishield
- Plano de gerenciamento de risco do Butantan
- Plano de gerenciamento de risco da FioCruz
- Boas Práticas de Fabricação do Butantan
- Boas Práticas de Fabricação da FioCruz
- Parecer Nº 2/2021- GPBIO/GGMED/DIRE2/ANVISA/BUTANTAN
- Parecer Nº 2/2021 -GGFIS/DIRE4/ANVISA/BUTANTAN
- Parecer Nº 3/2021- GIMED/GGFIS/DIRE4/ANVISA/FIOCRUZ
- Parecer Nº 3/2021- GPBIO/GGMED/DIRE2/ANVISA/FIOCRUZ
- Extrato da deliberação da Dicol
- Voto Primeira Diretoria
- Voto Segunda Diretoria (relatora)
- Voto Terceira Diretoria
- Voto Quarta Diretoria
- Voto Quinta Diretoria
- Bula para profissional de saúde CoronaVac
- Relatório técnico público elaborados pela GGMED - Fiocruz
- Relatório técnico público elaborados pela GGMED - Butantan
Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter @anvisa_oficial, Facebook@AnvisaOficial , Instagram @anvisaoficial e YouTube @anvisaoficial