Notícias
Anvisa recebe pedido de registro definitivo da vacina de Oxford
Quando finalizada a análise, o registro concedido pela Anvisa será o sinal verde para que a vacina seja comercializada, distribuída e utilizada pela população, nos termos da indicação estabelecida na bula. O registro definitivo é a avaliação completa com dados mais robustos dos estudos de qualidade, eficácia e segurança, bem como do plano de mitigação dos riscos e da adoção das medidas de monitoramento.
Prazo
Devido ao estágio das avaliações já realizadas, buscando superar os prazos legais estabelecidos, a Anvisa manterá total prioridade na análise para fins de concluir o processo no menor tempo possível.
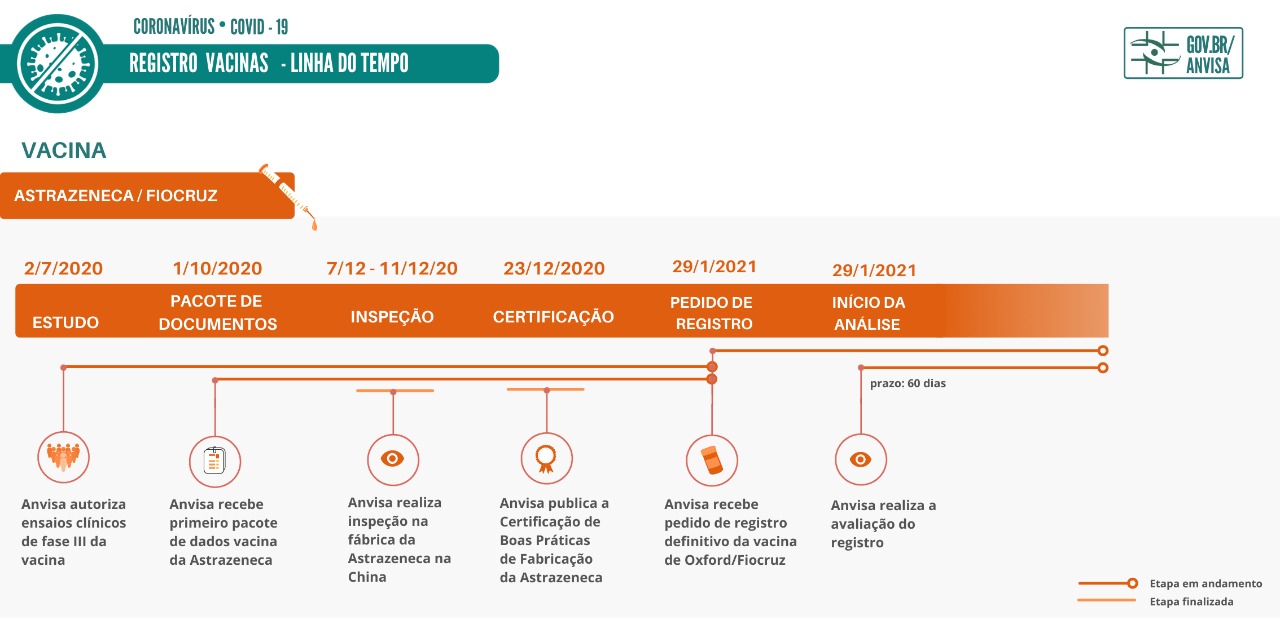
A Agência vem avaliando de forma emergencial e com total prioridade as vacinas contra a Covid-19, e para tanto adotou os procedimentos de submissão e análise contínua dos dados e das informações submetidas pela empresa, antes do peticionamento do registro.
Considerando a pandemia, a Anvisa editou a Resolução da Diretoria Colegiada (RDC) 415/2020, que estabeleceu o prazo de 60 dias para o registro. Entretanto, a todo momento, a Agência vem buscando a superação dos prazos para favorecer o acesso e apoiar as ações para o enfrentamento dessa emergência da saúde pública.
A decisão sobre o registro é da área técnica e o registro é publicado no Diário Oficial da União.
Clique aqui e entenda o processo de registro de vacinas contra a Covid-19.
Veja o andamento das análises de vacinas.
Histórico
No dia 2 de julho de 2020, a Anvisa autorizou os ensaios clínicos da vacina contra a Covid-19 da AstraZeneca e da Fiocruz, que têm uma parceria para este produto. Por meio do rito de submissão contínua de documentos, a Agência recebeu o primeiro pacote de dados da vacina da empresa em 1º de outubro do mesmo ano.
Entre os dias 7 e 11 de dezembro do ano passado, a Anvisa realizou inspeção na fábrica da AstraZeneca na China. No dia 23 do mesmo mês, foi publicado o Certificado de Boas Práticas de Fabricação da empresa. Veja aqui mais informações sobre o processo de certificação .
Em 8 de janeiro deste ano, a Fiocruz solicitou à Anvisa o pedido de uso emergencial da vacina contra a Covid-19.
No dia 17 de janeiro, a Diretoria Colegiada da Anvisa aprovou por unanimidade a autorização temporária de uso emergencial da vacina Covishield, produzida pela farmacêutica Serum Institute of India, em parceria com a AstraZeneca/Universidade de Oxford/Fiocruz. Saiba mais sobre a autorização temporária.