Notícias
VACINA
Anvisa autoriza inclusão de dose de reforço na bula da Pfizer
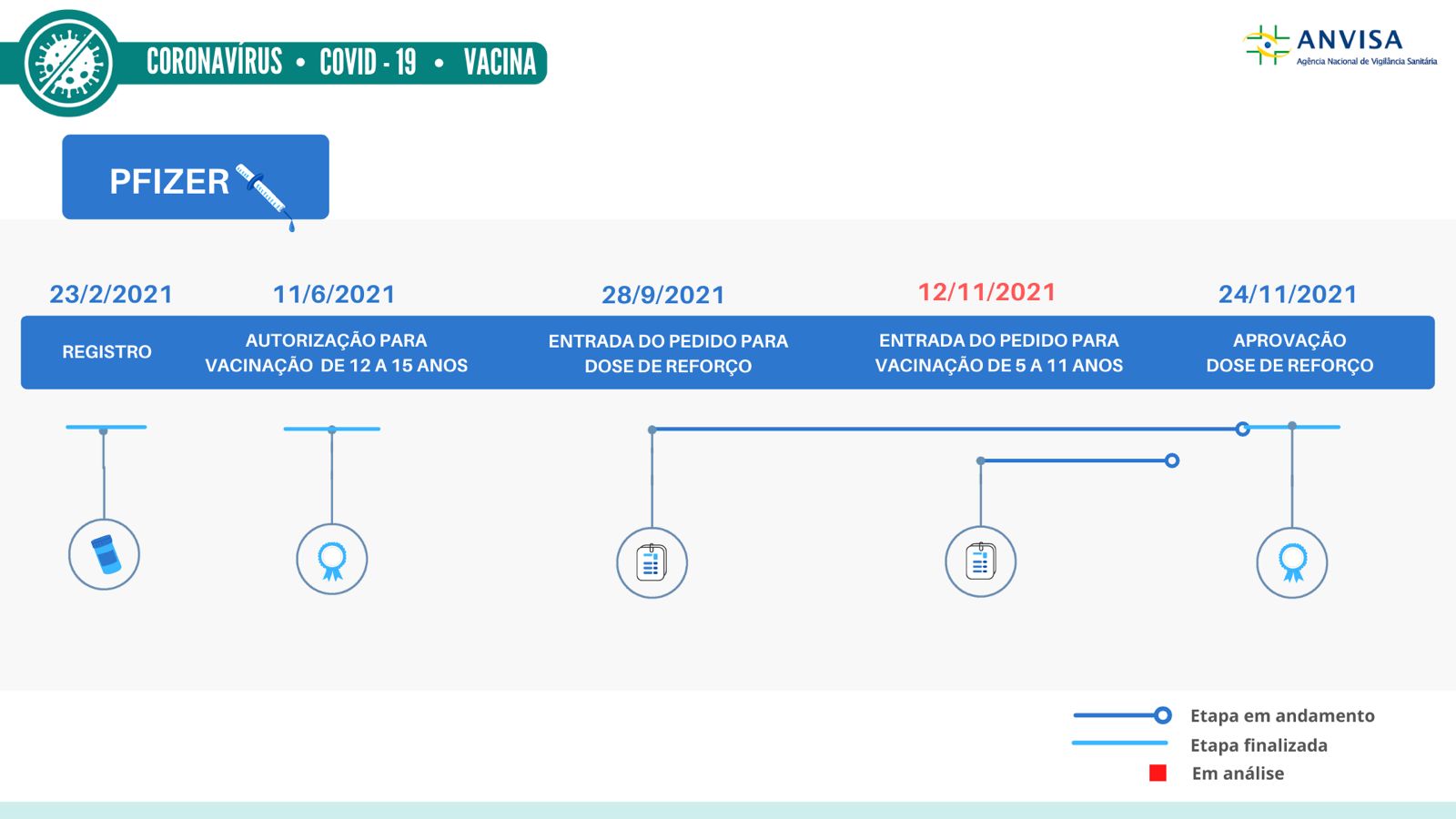
A Anvisa aprovou a autorização da dose de reforço solicitada pela Pfizer para a sua vacina contra Covid -19 , a Comirnaty. Isso s ignifica que a Agência avaliou os dados e estudos apresentados pelo laboratório e concluiu que as evidências científicas demonstram segurança e eficácia para a aplicação da dose de reforço da Pfizer.
Com a aprovação d a Anvisa , a bula da vacina Comirnaty trará a indicação de dose de reforço pelo menos seis meses após o recebimento da segunda dose, para pessoas com 18 anos de idade ou mais . A indicação de reforço aprovada pela Agência é de uso homólogo, ou seja, para pessoas que receberam a mesma vacina (Comirnaty) n a primeira imunização.
Como a Comirnaty é uma vacina já registrada no país, a decisão final sobre a inclusão da dose de reforço na bula é da própria Gerência-Geral de Medicamentos da Agência.
Indicação aprovada e motivos
A indicação de bula é baseada nos estu dos clínicos e resultados desenvolvidos pelo laboratório, que neste caso avaliou a administração d o reforço em voluntários que foram imunizados inicialmente com o esquema de duas doses da Pfizer . Também foram avaliados dados de monitoramento do uso da vacina da Pfizer no Brasil .
Entre as justificativas avaliadas pela Anvisa estão d ados de estudos científicos que indicam a diminuição dos anticorpos neutralizantes e algumas evidências de diminuição de eficácia da vacina contra a Covid-19. Outro dado considerado foi o surgimento de variantes do vírus Sars-CoV-2, incluindo a variante Delta .
Principais pontos da decisão
-
Foi aprovada tecnicamente a dose de reforço para pessoas imunizadas anteriormente com a vacina da Pfizer.
-
A dose de reforço será indicada em bula apenas para pessoas com 18 anos de idade ou mais.
-
A dose de reforço deve ser aplicada pelo menos seis meses após a segunda dose (vacinação completa).
-
O estudo analisado reuniu dados de 300 indivíduos incluídos no estudo clínico de fases 1/2/3 da vacina.
-
Não foram apresentados dados de reforço heterólogo, ou seja, para pessoas que se imunizaram com outras vacinas contra a Covid-19.
-
A vacina Comirnaty está registrada no Brasil desde 23 de fevereiro de 2021.
Reforço
ou
terceira dose
?
A dose de reforço é uma aplicação adicional de uma vacina após a pessoa ter o esquema completo de imunização previsto na bula . N o c aso da vacina da Pfizer, a imunização completa acontece com duas doses , com um intervalo maior ou igual a 21 dias após a primeira . A dose de reforço tem o objetivo de mant er ou mesmo melhorar a imunidade gerada pelo esquema primário de vacinação , evitando que após um longo período a resposta imune no organismo comece a diminuir .
Terceira dose é o termo que se aplica ria aos casos em que o esquema completo de imunização fosse alcançado somente com três doses . Ou seja, seria o caso de um imunizante em que são necessária s três doses da vacina para que o indivíduo possa estar imunizado.
Na prática , não existem vacinas contra Covid-19 no Brasil com esquema de três doses. A s vacinas autorizadas pela Anvisa no país são de dose única, como no caso da vacina da Janssen, ou de duas doses, no caso das demais.
Termo de compromisso
Para a autorização da inclusão da dose de reforço em bula, a Pfizer ainda deve firmar um termo de compromisso para a apresentação de dados complementares identificados como lacunas durante a avaliação técnica.
Os principais pontos do termo de compromisso são:
• Dados clínicos adicionais sobre eficácia, imunogenicidade e segurança da dose de reforço.
• Plano de gerenciamento de risco com inclusão da dose de reforço.
• Dados de efetividade e de segurança de "vida real".
Outras análises em andamento
A Anvisa analisa, neste momento, os pedidos da AstraZeneca e da Janssen para inclusão de dose de reforço na bula de suas vacinas. No caso da CoronaVac , também em uso no Brasil, ainda não há pedido do laboratório para avaliação de doses de reforço.
Confira os detalhes dos outros processos em análise
O pedido da AstraZeneca trata do reforço homólogo, ou seja, aplicação da vacina da AstraZeneca como reforço para pessoas que foram imunizadas inicialmente com a mesma vacina. Esse pedido foi solicitado no último dia 17 de novembro.
Já o pedido da Janssen abrange tanto o reforço homólogo como heterólogo. No caso do uso heterólogo (vacina diferente do esquema inicial), a proposta da empresa pede a indicação apenas para pessoas que concluíram a vacinação primária com uma vacina de tecnologia mRNA. Atualmente, a única vacina de mRNA aprovada no Brasil é a vacina da Pfizer. Esse pedido da Janssen foi apresentado à Anvisa no último dia 19 de novembro.
No caso da CoronaVac , a Anvisa solicitou ao Instituto Butantan, em 27 de agosto, informações sobre o andamento dos estudos científicos ou regulatórios que possam subsidiar doses de reforço ou revacinação com a sua vacina. Até agora, não há solicitação do Butantan para esta análise. No momento, as lacunas sobre a imunogenicidade e o acompanhamento dos vacinados no estudo da CoronaVac limitam as conclusões sobre a duração da proteção desta vacina.