Notícias
Enfrentamento à pandemia
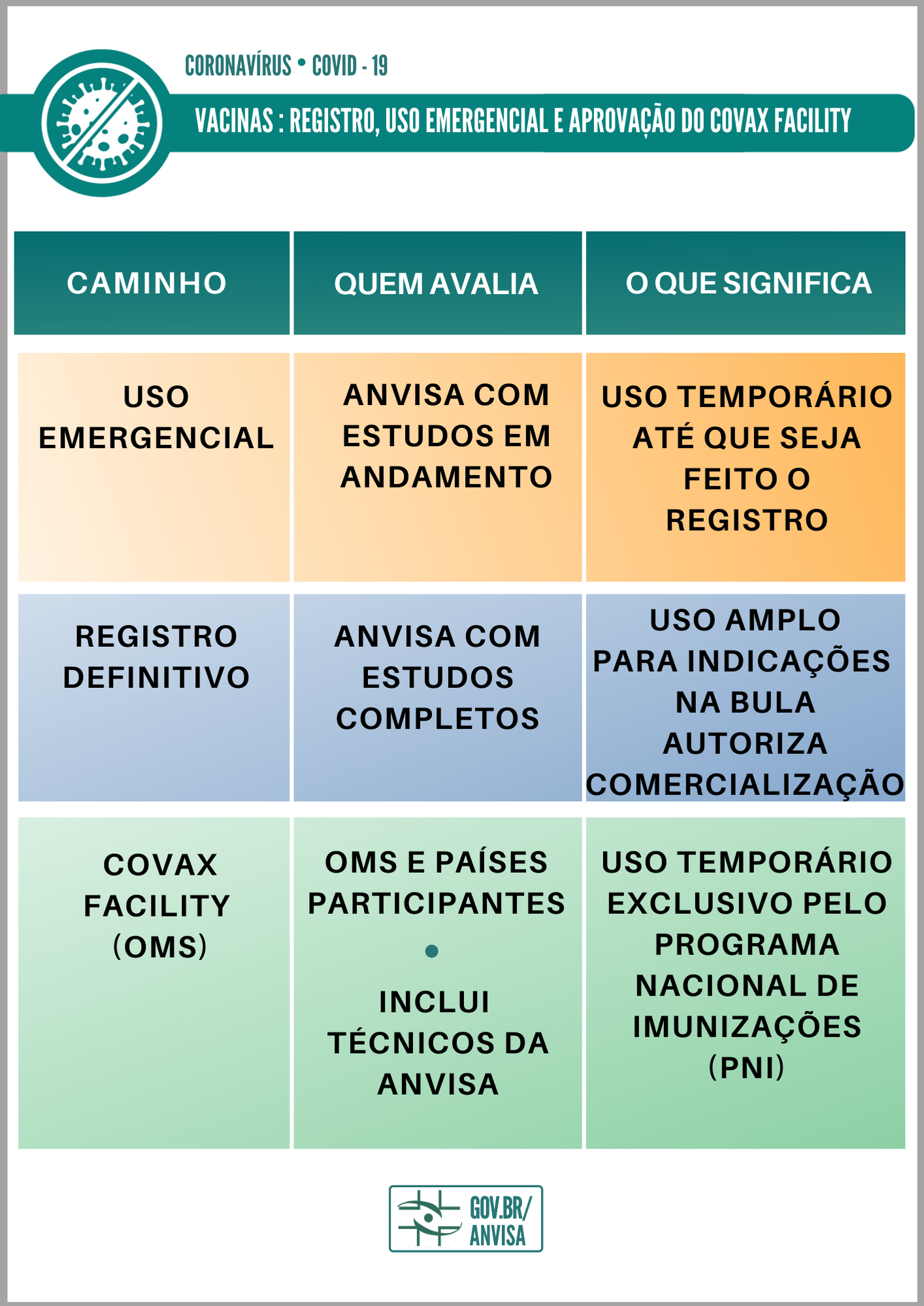
Anvisa abre caminho para mais vacinas chegarem ao país
A Diretoria Colegiada da Anvisa (Dicol) aprovou, nesta terça-feira (9/2), resolução que agiliza a chegada de vacinas adquiridas pelo Ministério da Saúde (MS) no âmbito do Instrumento de Acesso Global de Vacinas Covid-19, o Covax Facility. O ato normativo estabelece também os procedimentos para importação e monitoramento desses imunizantes. A iniciativa irá simplificar os processos, de modo a garantir que as vacinas sejam disponibilizadas com qualidade, segurança e eficácia à população brasileira, no menor tempo possível.
De acordo com a diretora Meiruze Freitas, relatora do processo, “a regulamentação foi construída no espírito de simplificação, redução de duplicação de esforços regulatórios e garantia de previsibilidade para que as vacinas com qualidade, eficácia e segurança, que tenham passado por avaliação regulatória equivalente à desempenhada pela própria Agência, possam ser disponibilizadas ao país no menor tempo possível, fortalecendo o processo de imunização”.
A dispensa de registro e de autorização de uso emergencial foi possível porque, além da equivalência no que se refere à avaliação regulatória, o consórcio internacional conta com a participação de especialistas da Agência entre os responsáveis pelas análises dos estudos e dados necessários à aprovação das vacinas.
Entenda
As vacinas contra Covid-19 importadas devem ter qualidade, segurança e eficácia comprovadas a partir da aprovação pelo Covax Facility, por meio do Procedimento Pré-qualificação de Uso Emergencial (Emergency Use Listing Procedure / Prequalification, em inglês) da Organização Mundial da Saúde (OMS). Esses imunizantes são destinados, exclusivamente, ao Programa Nacional de Imunizações (PNI).
Segundo a Resolução da Diretoria Colegiada (RDC), caberá ao Ministério da Saúde:
- Realizar os procedimentos para o protocolo, em tempo hábil, da licença de importação.
- Assegurar e monitorar as condições da cadeia de transporte, para que os produtos importados estejam com o prazo de validade vigente. Além disso, deverá estabelecer mecanismos para garantir as condições gerais e a manutenção da qualidade das vacinas e seu adequado armazenamento.
- Prestar orientações aos serviços de saúde sobre o uso e os cuidados de conservação das vacinas importadas.
- Criar estratégias para a realização do monitoramento pós-distribuição e pós-uso das vacinas importadas. Os casos de queixas técnicas e eventos adversos identificados devem ser informados à Anvisa, por meio dos sistemas de informação adotados.
A Anvisa, por sua vez, deverá monitorar o perfil de queixas técnicas e eventos adversos associados às vacinas importadas nos termos da nova resolução, adotar as ações de controle, monitoramento e fiscalização sanitária pertinentes e realizar os trâmites operacionais para o desembaraço aduaneiro, em até 48 horas.
Importante observar que os lotes das vacinas só poderão ser destinados ao uso após liberação pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), nos termos da RDC 73/2008.
As vacinas contra Covid-19 adquiridas via Covax Facility poderão ser importadas com embalagens, rótulos e bulas nos padrões e idiomas estabelecidos e divulgados pela OMS.
Confira na íntegra o voto da relatoria .
Saiba mais
A Covax Facility, aliança global liderada pela OMS, tem como objetivo fomentar o desenvolvimento e a produção de imunizantes contra a Covid-19, de modo a permitir o acesso justo e igualitário a esses produtos. O Brasil é um dos 191 países que, atualmente, integram a iniciativa.
O que dizem os diretores
“As medidas aqui apresentadas trarão grande agilidade para obtermos, por intermédio do Ministério da Saúde, mais uma gama de imunizantes ofertados pelo consórcio Covax Facility e com a chancela da Organização Mundial da Saúde.” Diretora Cristiane Gomes
“Triste e com pesar pelas mais de 231 mil vidas já ceifadas no país pela Covid-19, mas emocionado pela oportunidade de, na qualidade de servidor público concursado da Anvisa, participar da aprovação dessa importante RDC que trará agilidade na internalização e utilização das vacinas do Covax Facility no Brasil.” Diretor Romison Mota
“Essa aprovação demonstra que a Anvisa atua de mãos dadas com a realidade, sensível ao drama dos brasileiros e de suas famílias. Sem abrir mão dos requisitos de segurança, eficácia e qualidade, a Anvisa viabiliza modalidade regulatória que assegura mais vacinas para o Brasil.” Diretor Alex Campos
"Mais uma decisão importante da Agência, que garante o acesso ágil à vacina segura e eficaz." Diretor-presidente Antonio Barra Torres